蛋白質剪接在蛋白質研究和蛋白質工程中的應用
戴旭東 孟 清 劉相欽
①博士研究生,②教授,東華大學生物科學與技術研究所,上海 201620;③教授,Department of Biochemistry &Molecular Biology,Faculty of Medicine,Dalhousie University,Halifax,Nova Scotia,Canada B3H1X5
蛋白質剪接(protein splicing)是由蛋白質內含子介導的在蛋白質水平上翻譯后的加工過程。蛋白質內含子(intein)是指前體蛋白中的一段插入序列,它在蛋白質翻譯后的成熟過程中能自我催化,使自身從前體蛋白中切除,并將其兩側的多肽片段以肽鍵連接,形成成熟的蛋白質。蛋白質內含子的發現豐富了基因表達和蛋白質翻譯成熟過程的理論,而且在蛋白質研究和蛋白質工程中有廣泛的應用。本文試圖綜述蛋白質剪接在蛋白質特異位點標記、蛋白質片段化標記同位素、蛋白質環化、蛋白質芯片、基因治療等研究中的應用。
蛋白質內含子(intein)是指前體蛋白中的一段插入序列,它在蛋白質翻譯后的成熟過程中能自我催化,使自身從前體蛋白中切除,并將其兩側稱為蛋白質外顯子(extein)的多肽片段以正常的肽鍵連接形成有功能的成熟蛋白質[1-2]。截至到2011年8月,已經有500多種蛋白質內含子(intein)被發現(inbase,http://www.neb.com/neb/inteins.html)[3]。它們分布在單細胞真核生物、細菌、古細菌、噬菌體和病毒的基因組中,但是在多細胞生物中尚未發現蛋白質內含子,而且它們主要分布在與DNA復制、轉錄、翻譯有關的蛋白酶或轉移因子上,這可能有利于蛋白質內含子的歸巢(homing)和生存[4]。由于蛋白質剪接能把兩個多肽以一個天然肽鍵相連(splicing),形成成熟的有活性的蛋白質,為蛋白質合成和翻譯后修飾提供了新的途徑,因而蛋白質剪接已經被廣泛的應用到蛋白質研究和蛋白質工程中。例如,這項技術可以應用到蛋白質特異位點標記、蛋白質片段化標記同位素、蛋白質環化、基因治療、蛋白質芯片等研究中[5-7]。
1 蛋白質內含子的生物學特性
1.1 蛋白質內含子
1990年,分別由Kane和Hirata領導的研究小組同時在酵母中發現蛋白質剪接(protein splicing)[8-9]。1994年,Perler將“插入片段”正式命名為“intein”,即蛋白質內含子。并將其定義為:在蛋白質成熟過程中被剪接掉的一段框內融合于前體蛋白的氨基酸序列,蛋白質內含子兩端的序列稱為“extein”,即外顯子[10](圖1)。
蛋白質內含子不同于RNA內含子,前者存在于蛋白質,后者則存在于mRNA前體。然而,蛋白質內含子與RNA內含子(intron)也有相似之處。首先,它們都插入到基因中,通過自身剪接從前體中剪接下來,將兩邊的前體連接。另外,二者都包含核酸內切酶結構域,可以通過類似的歸巢機制在基因中轉移。
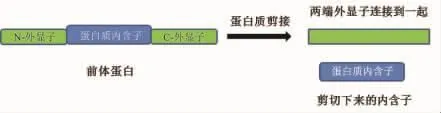
圖1 蛋白質剪接示意圖[1]
1.2 蛋白質內含子的結構
每一個蛋白質內含子都包含N端剪接結構域和C端剪接結構域。N端剪接結構包含兩個序列模塊即A和B,C端剪接結構包含兩個序列模塊即F和G。除此之外,標準蛋白質內含子在N端剪接結構域和C端剪接結構域之間還存在歸巢核酸內切酶結構域,由模塊C,D和E組成(圖2)。模塊A位于蛋白質內含子的N端,其N端的第一個氨基酸殘基非常保守,一般是Cys或Ser;模塊G位于蛋白質內含子的C端,其C端的第一個氨基酸殘基非常保守,一般是Asn,第二個氨基酸殘基也非常保守,一般是His;模塊B中Thr-X-X-His序列的Thr和His非常保守,X是任何氨基酸殘基;另外,C端蛋白質外顯子的第一個氨基酸殘基非常保守,一般是Cys,Ser或Thr。越來越多的證據,特別是突變分析和一些蛋白質內含子晶體結構的解析表明這些保守的氨基酸殘基參與了蛋白質的剪接,如果它們發生突變,將會影響蛋白質剪接活性[11]。

圖2 標準蛋白質內含子結構示意圖[1]。兩端分別是蛋白質內含子的剪接結構域,中間部分是歸巢核酸內切酶結構域。A,B,C,D,E,F,G是蛋白質內含子的保守模塊。
1.3 蛋白質的順式剪接(cis-splicing)與反式剪接(trans-splicing)
蛋白質內含子根據其結構特征可分為三類:標準蛋白質內含子(canonical intein),微小蛋白質內含子(miniintein)和斷裂蛋白質內含子(split intein)(圖3)。標準蛋白內含子含有大約400個氨基酸并包括一個歸巢核酸內切酶結構域,而微小蛋白質內含子只有大約140個氨基酸不包含歸巢核酸內切酶結構域,只有蛋白剪切的功能。雖然很多蛋白內含子在序列上沒有同源性,但是它們的晶體結構非常接近。微小蛋白質內含子的晶體結構包括12個β折疊,它們形成一個圓盤狀的蛋白質,其剪切活性中心位于圓盤的中央[11-12]。對于標準蛋白質內含子和微小蛋白質內含子來說,蛋白質內含子和蛋白質外顯子位于同一多肽鏈上,這時發生的蛋白剪接稱為順式剪接(cis-splicing)。斷裂蛋白質內含子是蛋白質內含子中部區域特定位點發生斷裂,被分裂成兩部分即N端區域(IN)和C端區域(IC),分別由不同的開放閱讀框(ORF)編碼。斷裂蛋白質內含子的IN和IC在剪接時相互識別,然后重建催化活性中心,進而發生蛋白質反式剪接(protein trans-splicing)。
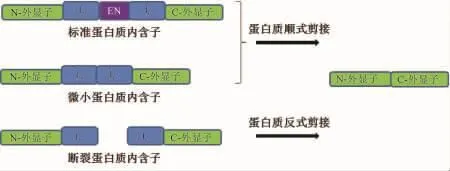
圖3 蛋白質的順式剪接(cis-splicing)與反式剪接(trans-splicing)。IN:蛋白質內含子N端剪接結構域,IC:蛋白質內含子C端剪接結構域,EN:歸巢核酸內切酶結構域。
1.4 蛋白質內含子的剪接機制
蛋白質內含子介導的蛋白質剪接是一個自我催化過程,只與蛋白質內含子剪接活性中心的保守氨基酸和C端外顯子的第一個氨基酸有關。內含子可以不依賴其他任何因素催化蛋白質就可以剪接。
蛋白質順式剪接(cis-splicing)包括4步親核反應(圖4)[13-14]。第一步,蛋白質內含子 N-端的第一個保守氨基酸Cys或Ser引起酰基化重排(acyl rearrangement),N-端蛋白質外顯子與蛋白質內含子之間的肽鍵被打開,形成硫酯鍵或酯鍵。第二步,C-端蛋白質外顯子的第一位氨基酸Cys,Ser或Thr的巰基或羥基攻擊第一步反應形成的硫酯鍵或酯鍵,導致N-端蛋白質外顯子以硫酯鍵或酯鍵連接到C-端蛋白質外顯子的第一位氨基酸殘基的側鏈上。蛋白質內含子的N-端剪接點被切斷,形成分支中間體(branched intermediate)。第三步,蛋白質內含子C-端的Asn或Gln側鏈上的酰胺基攻擊C-端剪接點的肽鍵,導致該剪接點斷裂。至此,蛋白質內含子與兩側的蛋白質外顯子分開。第四步,通過自發的S-N或O-N之間的酰基化重排,兩個蛋白質外顯子之間的硫酯鍵或酯鍵轉變成正常的肽鍵。這樣,就完成了標準的蛋白質剪接反應。
斷裂蛋白質內含子介導的反式剪接(trans-splicing)起始于斷裂蛋白質內含子IN和IC的相互識別和結合。IN和IC緊密結合后,斷裂蛋白質內含子正確折疊而重建活性中心,之后按照標準蛋白質剪接途徑完成蛋白質外顯子的連接[15-17]。
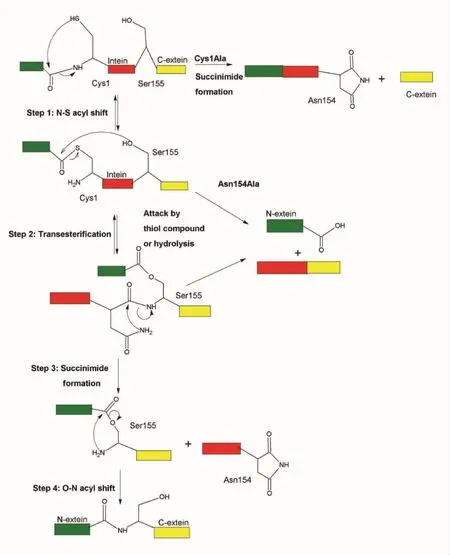
圖4 標準蛋白質內含子剪接機制[18]
2 天然斷裂蛋白質內含子和人工斷裂蛋白質內含子
2.1 尋找天然斷裂蛋白質內含子
蛋白質反式剪接(trans-splicing)是基于斷裂蛋白質內含子的一種剪接方式。斷裂蛋白質內含子分為兩種:一種是天然存在的,另一種是通過基因工程的方法斷裂微小蛋白質內含子的方式獲得。1998年,Paul Liu實驗室在藍藻sp.PCC6803的DnaE蛋白中首次發現了天然斷裂蛋白質內含子,IN和IC在不同的閱讀框中表達,二者在基因組中相距745226 bp[15]。這種兩段蛋白組成的斷裂蛋白質內含子在許多藍藻中也被發現[19-20]。天然斷裂蛋白質內含子的發現,暗示了標準蛋白質內含子在進化中丟失了歸巢內切酶結構域,導致兩端的剪接結構域在不同的閱讀框中表達,而且這兩段蛋白可以重新組裝成為有活性的蛋白質內含子,這為構建人工斷裂蛋白質內含子提供了理論依據。
2.2 構建人工斷裂蛋白質內含子
歸巢核酸內切酶結構域的作用是使蛋白質內含子基因可以在基因組中自由轉移,與蛋白質剪接功能無關,而且科學家們還發現有些蛋白質內含子去除核酸內切酶結構域后也有剪接活性[15,17,21],蛋白質內含子的晶體結構解析也證明了核酸內切酶是獨立的結構域,不參與蛋白質剪接[22]。所以科學家們通過基因工程的方法去除標準蛋白質內含子的歸巢核酸內切酶結構域,并以此為斷裂位點將微小蛋白質內含子斷裂,使IN和IC在不同的閱讀框中表達,構建了一系列人工斷裂蛋白質內含子[17,23-24]。
2.3 新型斷裂蛋白質內含子
典型蛋白質內含子去除歸巢核酸內切酶結構域后,N端有110~130個氨基酸,C端有35~40個氨基酸。在蛋白質工程和蛋白質研究中,蛋白質內含子可以被應用于蛋白質的半合成。因為現有的多肽合成技術不能合成多于100aa的多肽,所以只有C端可以通過化學方法合成,而N端不可以通過化學合成的方式獲得。
為了將N端合成多肽也能連接到與其互補的重組表達蛋白上,Paul Liu實驗室首先在典型斷裂位點(S0)以外設計了一系列斷裂位點(圖5),其中S0是歸巢核酸內切酶的位置,其余大部分斷裂位點是在預測的β-折疊之間的環狀區域[25]。通過他們的測試,發現蛋白質內含子的四個斷裂位點(S1,S6,S7和S8)具有蛋白質反式剪接活性。其中S1型的IN只有11個氨基酸,IC有125個氨基酸。隨后,Paul Liu實驗室又驗證了在微小蛋白質內含子Ssp GyrB中S11斷裂位點處有高剪接活性[26]。S11型斷裂蛋白質內含子的IC只有6個氨基酸,IN有150個氨基酸。
新型斷裂蛋白質內含子S1和S11的構建拓寬了蛋白質剪接在蛋白質研究和蛋白質工程中的應用。可以把熒光基團、多聚物等化學修飾分子直接通過合成到化學合成多肽上,通過反式剪接把帶有蛋白修飾分子的多肽連接到重組蛋白上。新型斷裂蛋白質內含子的構建成功,使斷裂位點不再局限于S0位點,為人們設計斷裂蛋白質內含子拓寬了思路。由于化學法合成多肽對氨基酸數目有限制,所以蛋白質內含子IN和IC的氨基酸數目越少,那么與IN或IC一同合成的目的蛋白的氨基酸數目就越多,尋找更小的IN或IC仍然是蛋白質內含子研究的一個方向。

圖5 斷裂蛋白質內含子序列中的斷裂位置。154 aa長的微小蛋白質內含子Ssp DnaB,每隔10個位置空一格排列,選出的13個斷裂位點(S1-S13)用箭頭在上方標示,S0是歸巢核酸內切酶結構域的位置,是典型的斷裂位點。下劃線的是β-折疊(β1-β12)[25]。
3 蛋白質剪接的應用
蛋白質剪接的獨特性能是它能將兩個多肽以一個天然肽鍵相連(splicing),為蛋白質合成和修飾提供了新的途徑,因而在蛋白質工程及其他領域具有廣泛的應用前景。在蛋白質反式剪接中,斷裂蛋白質內含子的兩個片段可以分別表達或合成,每個片段自身不能發生剪接反應,只有兩個片段相互識別,重新構建活性中心才能發生反式剪接。蛋白質剪接可以應用涉及到蛋白質化學修飾、蛋白片段標記同位素、蛋白質環化、蛋白芯片、基因治療等領域。
3.1 蛋白質剪接在蛋白質化學修飾中的應用
在蛋白質工程和蛋白質研究中,蛋白質的化學修飾技術是非常重要的。對蛋白質進行化學修飾的分子可以是熒光基團、多聚物、非天然氨基酸、酶的輔基、蛋白質翻譯后修飾的基團等。化學修飾過的蛋白質會擁有一些新的性質:用生物物理探針修飾蛋白質,可以研究蛋白質的結構和功能;用多聚物修飾蛋白質藥物,可以增加蛋白藥物的穩定性,提高蛋白藥物的利用度等。
氨基修飾或巰基修飾是常見的化學修飾方法,但是標準的化學標記方法做不到特異位點標記。氨基(N端氨基和Lysε位氨基)在蛋白質中的頻率較高,如果一個蛋白質中的多個氨基被標記,就會出現蛋白沉淀和熒光猝滅。雖然在蛋白質中低頻率出現的Cys使飽和修飾成為可能,但是如果Cys在一種蛋白中出現多次或者Cys位于蛋白的活性中心,就不能做到位點特異性標記。
有些新的化學方法可以進行特異位點標記,但是這些方法僅限于N端氨基的標記,而且還要求蛋白的N端是暴露在外面的,也就是說能否被標記還要依賴N端氨基酸殘基的特點[27-29]。有些方法已經可以標記重組蛋白,但是這些方法存在不足之處,其中有一種方法是用一種配體與多肽標簽共價相連,通過配體與重組蛋白的非共價結合達到標記的目的,這種方法很簡便,但是非共價鍵標記不穩定,而且多肽標簽對目的蛋白的結構和功能有影響[30-31]。蛋白質反式剪接為蛋白質特異位點修飾提供了另一種方法。選擇特定的位點,將目的蛋白斷裂成兩段,分別與IN和IC融合表達。目的蛋白斷裂位點的選擇根據蛋白的不同而不同,其中一段目的蛋白只含有一個Cys或Lys。把要標記的化學分子標記到Cys或Lys上,再通過蛋白質反式剪接將目的蛋白的兩個片段連接在一起[32-34](圖6)。由于S1型斷裂蛋白質內含子的N端僅含有11個氨基酸,S11型斷裂蛋白質內含子的C端僅含有6個氨基酸,易于化學合成,使重組蛋白質的N-末端或C-末端標記更加方便。可以將要標記的分子和目的蛋白的片段直接通過化學合成的方法合成到IN或IC上,通過反式剪接將合成的片段和重組表達的片段拼接到一起。
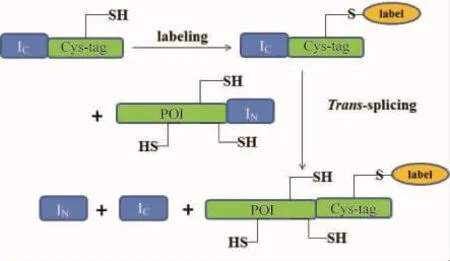
圖6 利用蛋白質反式剪接對蛋白質進行特異位點修飾[35]。第一步,將目的蛋白(protein of interest,POI)斷裂,分別與IN和IC融合表達,與IC融合表達的片段只含有一個Cys。第二步,將標記物選擇性的標記到半胱氨酸上。第三步,兩段蛋白發生反式剪接,形成帶有標記物的蛋白。
3.2 蛋白質剪接在NMR中的應用
NMR(nuclear magnetic resonance,核磁共振)技術是繼x射線晶體衍射技術后研究蛋白3D結構的又一重大進步,這項技術在生命科學、生物醫學和材料學中將是至關重要的。NMR技術除了可以研究蛋白的3D結構以外,還可以對蛋白的構象變化以及蛋白間的相互作用進行研究。但是,NMR技術受限于被檢測蛋白的分子量,原因是分子量增大會造成譜峰重疊,橫向弛豫時間減少(線寬增加)。傳統的NMR技術很難用于研究溶液和活細胞中30kDa以上的蛋白質。
對蛋白質進行片段化同位素標記使NMR技術得到進一步的改善,可以檢測更大的蛋白質分子。蛋白質片段化標記的方法有天然化學連接(NCL)、表達蛋白連接(EPL)和反式剪接(PTS)等幾種方法。天然化學連接(NCL)和表達蛋白連接(EPL)反應中包含兩個蛋白,這兩個蛋白分別含有a-thioester和a-Cyseine,a-thioester與a-Cyseine發生反應將兩個蛋白片段連接在一起[36]。

圖7 利用蛋白質反式剪接對蛋白質進行片段化標記同位素[37]。a.含有Tag與IC的質粒首先在普通培養基中被誘導表達。b.更換含有同位素的培養基后,誘導表達目的蛋白(protein of interest,POI)與IN。c.在體內發生反式剪接。d.經過純化,得到有片段被標記的蛋白。
體內(in vivo)反式剪接簡化了標記步驟,成功的對多結構域蛋白進行片段同位素標記[37-38](圖7)。在這種方法中,兩個前體蛋白在同一細胞內兩個不同的質粒中表達,兩個質粒的誘導方式不一樣。第一個質粒在含有同位素的培養基中進行誘導,然后把培養基換成不含同位素的培養基,緊接著誘導另一的前體蛋白。細胞內出現兩種前體之后,會自發剪接反應。經過破碎細胞和純化,得到片段標記的蛋白質。Hideo Iwai研究組利用這種方法分別檢測了Src homology結構域和酵母中Sup35p蛋白的3D 結構[37-38]。
3.3 蛋白質剪接在蛋白質環化中的應用
蛋白質環化是指將線性蛋白質的N端和C端連接形成環形蛋白質骨架,是設計新酶和新藥以及研究蛋白質結構與功能的新方法。蛋白質環化之后限制了蛋白質的構象變化,降低了熵值,環化后的蛋白質有更高的生物活性和更長的藥物半衰期[39]。
通常利用化學方法環化蛋白質,這些方法包括:在N端和C端氨基酸殘基間形成二硫鍵、肽鍵或是通過連接內部氨基酸的側鏈。但是,這些化學方法一般只用于較小的蛋白質,不易應用于較大的蛋白質環化[40]。
Paul Liu和Ming-Qun Xu實驗室利用蛋白質反式剪接技術分別對麥芽糖結合蛋白(42 kDa),酰基載體蛋白(9 kDa)和綠色熒光蛋白(27 kDa)等蛋白進行了成功的環化(圖8)[41-43]。在這種方法中,IN和IC分別與目的蛋白質的C末端和N末端融合表達,經過蛋白質反式剪接之后,目的蛋白的N末端與C末端以肽鍵相連,形成環形蛋白質。

圖8 利用蛋白質反式剪接技術環化蛋白質[41]。IN和IC分別與目的蛋白(protein of interest,POI)的C末端和N末端融合表達。經過蛋白質反式剪接之后,目的蛋白的N末端與C末端以肽鍵相連,形成環形蛋白質。
3.4 蛋白質剪接在基因治療中的應用
在基因治療研究中,由于有些基因治療載體對外源基因的大小有限制,導致分子量大的外源基因不能應用到基因治療中。Paul liu實驗室利用蛋白質反式剪接成功的解決了這個問題,為基因治療中蛋白表達提供了新的方法(圖9)[44]。在實驗中,選擇分子量比較大的肌營養不良蛋白基因(dystrophin gene)和腺病毒載體(AAV)。6.3 kb的肌營養不良蛋白基因(dystrophin gene)不能被腺病毒載體(AAV)帶入宿主細胞。肌營養不良蛋白基因cDNA被斷裂成兩段,并分別與斷裂內含子的IN和IC的基因融合表達,將兩段基因克隆到兩個載體中,將兩個載體共轉到宿主細胞中,蛋白在宿主細胞中表達,通過蛋白質反式剪接形成成熟的蛋白,行使基因治療的功能。
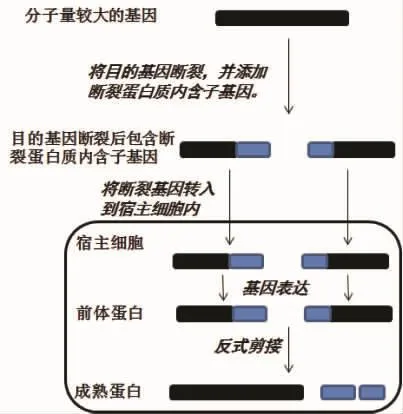
圖9 蛋白質反式剪接在基因治療中的應用[44]
3.5 蛋白質剪接在其他方面的應用
蛋白質反式剪接還可以應用到蛋白質研究的其他領域。利用反式剪接獲得對宿主細胞有毒性的蛋白的全長序列,例如I-Tev I核酸內切酶[45]和b-amyloid(Ab)[46];可以利用蛋白質反式剪接重構球蛋白的活性,可以基于這個方法檢測蛋白質-蛋白質相互作用[47];利用反式剪接重新構建herbicide-resistance蛋白活性,確保轉基因植物的環境安全性[48];利用蛋白質反式剪接把目的蛋白固定到芯片上,應用于蛋白質組學研究[49]。
4 小結與展望
蛋白質剪接技術為蛋白質研究和蛋白質工程提供了新工具,在蛋白質特異位點標記、蛋白質片段化同位素標記、蛋白質環化和基因治療等方面取得了一些成果。另外,蛋白質剪接技術可以應用在毒性蛋白的表達、蛋白質相互作用、蛋白固定等方面。新型斷裂蛋白質內含子在此基礎上擴大了斷裂蛋白質內含子的應用范圍,提供了在目的蛋白質的N-末端或C-末端標記任意化學基團的潛力。隨著蛋白質剪接技術的日趨完善,蛋白質剪接還會應用在蛋白質研究的其他領域。
然而,蛋白質剪接技術還存在一些限制。例如,蛋白質內含子剪接活性受外顯子的影響,所以會在目的蛋白的斷裂位點插入一些外源氨基酸,這些氨基酸可能會對目的蛋白的結構與功能產生影響。所以在設計目的蛋白的斷裂位點時要充分考慮到這一點。另外,有些人工構建的蛋白質內含子與有些蛋白融合表達時,會得到很少的可溶性蛋白,要經過變復性才能使蛋白質內含子有活性。盡管有這些限制,蛋白質剪接技術還是應用到了蛋白質研究與蛋白質工程的很多領域。
(2011年9月30日收到)
[1]LIU X Q.Protein-splicing intein:genetic mobility,origin,and evolution[J].Annu Rev Genet,2000,34:61-76.
[2]SALEH L,PERLER F B.Protein splicing in cis and in trans[J].Chem Rec,2006,6(4):183-193.
[3]PERLER F B.InBase:the Intein Database[J].Nucleic Acids Res,2002,30(1):383-384.
[4]HALL T M,PORTER J A,YOUNG K E,et al.Crystal structure of a Hedgehog autoprocessing domain:homology between Hedgehog and self-splicing proteins[J].Cell,1997,91(1):85-97.
[5]MOOTZ H D.Split inteins as versatile tools for protein semisynthesis[J].Chembiochem,2009,10(16):2579-2589.
[6]CHERIYAN M,PERLER F B.Protein splicing:a versatile tool for drug discovery[J].Adv Drug Deliv Rev,2009,61(11):899-907.
[7]VILA-PERELLO M,MUIR T W.Biological applications of protein splicing[J].Cell,2010,143(2):191-200.
[8]KANE P M,YAMASHIRO C T,WOLCZYK D F,et al.Protein splicing converts the yeast TFP1 gene product to the 69-kD subunit of the vacuolar H(+)-adenosine triphosphatase[J].Science,1990,250(4981):651-657.
[9]HIRATA R,OHSUMI Y,NAKANO A,et al.Molecular structure of a gene,VMA1,encoding the catalytic subunit of H(+)-translocating adenosine triphosphatase from vacuolar membranes of Saccharomyces cerevisiae[J].J Biol Chem,1990,265(12):6726-6733.
[10]PERLER F B,DAVIS E O,DEAN G E,et al.Protein splicing elements:inteins and exteins—a definition of terms and recommended nomenclature[J].Nucleic Acids Res,1994,22(7):1125-1127.
[11]SUN P,YE S,FERRANDON S,et al.Crystal structures of an intein from the split dnaE gene of Synechocystis sp.PCC6803 reveal the catalytic model without the penultimate histidine and the mechanism of zinc ion inhibition of protein splicing[J].J Mol Biol,2005,353(5):1093-1105.
[12]DING Y,XU M Q,GHOSH I,et al.Crystal structure of a mini-intein reveals a conserved catalytic module involved in side chain cyclization of asparagine during protein splicing[J].J Biol Chem,2003,278(40):39133-39142.
[13]XU M Q,PERLER F B.The mechanism of protein splicing and its modulation by mutation[J].EMBO J,1996,15(19):5146-5153.
[14]PAULUS H.Protein splicing and related forms of protein autoprocessing[J].Annu Rev Biochem,2000,69:447-496.
[15]WU H,HU Z,LIU X Q.Protein trans-splicing by a split intein encoded in a split DnaE gene of Synechocystis sp.PCC6803[J].Proc Natl Acad Sci U S A,1998,95(16):9226-9231.
[16]MOOTZ H D,MUIR T W.Protein splicing triggered by a small molecule[J].J Am Chem Soc,2002,124(31):9044-9045.
[17]WU H,XU M Q,LIU X Q.Protein trans-splicing and functional mini-inteins of a cyanobacterial dnaB intein [J].Biochim Biophys Acta,1998,1387(1-2):422-432.
[18]MATHYS S,EVAN JR T C,CHUTE I C,et al.Characterization of a self-splicing mini-intein and its conversion into autocatalytic N-and C-terminal cleavage elements:facile production of protein building blocks for protein ligation [J].Gene,1999,231(1-2):1-13.
[19]LIU X Q,YANG J.Split dnaE genes encoding multiple novel inteins in Trichodesmium erythraeum [J].J Biol Chem,2003,278(29):26315-26318.
[20]CASPI J,AMITAI G,BELENKIY O,et al.Distribution of split DnaE inteins in cyanobacteria[J].Mol Microbiol,2003,50(5):1569-1577.
[21]SHINGLEDECKER K,JIANG S Q,PAULUS H.Molecular dissection of the Mycobacterium tuberculosis RecA intein:design of a minimal intein and of a trans-splicing system involving two intein fragments[J].Gene,1998,207(2):187-195.
[22]ICHIYANAGI K,ISHINO Y,ARIYOSHI M,et al.Crystal structure of an archaeal intein-encoded homing endonuclease PI-PfuI[J].J Mol Biol,2000,300(4):889-901.
[23]SOUTHWORTH M W,ADAM E,PANNE D,et al.Control of protein splicing by intein fragment reassembly[J].EMBO J,1998,17(4):918-926.
[24]MILLS K V,LEW B M,JIANG S Q,et al.Protein splicing in trans by purified N-and C-terminal fragments of the Mycobacterium tuberculosis RecA intein[J].Proc Natl Acad Sci U S A,1998,95(7):3543-3548.
[25]SUN W,YANG J,LIU X Q.Synthetic two-piece and threepiece split inteins for protein trans-splicing[J].J Biol Chem,2004,279(34):35281-35286.
[26]APPLEBY J H,ZHOU K,VOLKMANN G,et al.Novel split intein for trans-splicing synthetic peptide onto C terminus of protein[J].J Biol Chem,2009,284(10):6194-6199.
[27]TSIEN R Y.Constructing and exploiting the fluorescent protein paintbox(Nobel Lecture)[J].Angew Chem Int Ed Engl,2009,48(31):5612-5626.
[28]MCCANN C M,BAREYRE F M,LICHTMAN J W,et al.Peptide tags for labeling membrane proteins in live cells with multiple fluorophores[J].Biotechniques,2005,38(6):945-952.
[29]GUIGNET E G,HOVIUS R,VOGEL H.Reversible site-selective labeling of membrane proteins in live cells[J].Nat Biotechnol,2004,22(4):440-444.
[30]KEPPLER A,GENDREIZIG S,GRONEMEYER T,et al.A general method for the covalent labeling of fusion proteins with small molecules in vivo[J].Nat Biotechnol,2003,21(1):86-89.
[31]CHEN I,HOWARTH M,LIN W,et al.Site-specific labeling of cell surface proteins with biophysical probes using biotin ligase[J].Nat Methods,2005,2(2):99-104.
[32]KURPIERS T,MOOTZ H D.Regioselective cysteine bioconjugation by appending a labeled cystein tag to a protein by using protein splicing in trans[J].Angew Chem Int Ed Engl,2007,46(27):5234-5237.
[33]LUDWIG C,PFEIFF M,LINNE U,et al.Ligation of a synthetic peptide to the N terminus of a recombinant protein using semisynthetic protein trans-splicing [J].Angew Chem Int Ed Engl,2006,45(31):5218-5221.
[34]VOLKMANN G,LIU X Q.Protein C-terminal labeling and biotinylation using synthetic peptide and split-intein [J].PLoS One,2009,4(12):e8381.
[35]KURPIERS T,MOOTZ H D.Site-specific chemical modification of proteins with a prelabelled cysteine tag using the artificially split Mxe GyrA intein[J].Chembiochem,2008,9(14):2317-2325.
[36]XU R,AYERS B,COWBURN D,et al.Chemical ligation of folded recombinant proteins:segmental isotopic labeling of domains for NMR studies[J].Proc Natl Acad Sci U S A,1999,96(2):388-393.
[37]ZUGER S,IWAI H.Intein-based biosynthetic incorporation of unlabeled protein tags into isotopically labeled proteins for NMR studies[J].Nat Biotechnol,2005,23(6):736-740.
[38]MUONA M,ARANKO A S,IWAI H.Segmental isotopic labelling of a multidomain protein by protein ligation by protein trans-splicing[J].Chembiochem,2008,9(18):2958-2961.
[39]KEE K S,JOIS S D.Design of beta-turn based therapeutic agents[J].Curr Pharm Des,2003,9(15):1209-1224.
[40]XU M Q,EVANS T J.Intein-mediated ligation and cyclization of expressed proteins[J].Methods,2001,24(3):257-277.
[41]EVANS T C Jr,MARTIN D,KOLLY R,et al.Protein trans-splicing and cyclization by a naturally split intein from the dnaE gene of Synechocystis species PCC6803[J].J Biol Chem,2000,275(13):9091-9094.
[42]VOLKMANN G,MURPHY P W,ROWLAND E E,et al.Intein-mediated cyclization of bacterial acyl carrier protein stabilizes its folded conformation but does not abolish function[J].J Biol Chem,2010,285(12):8605-8614.
[43]ZHAO Z,MA X,LI L,et al.Protein cyclization enhanced thermostability and exopeptidase-resistance of green fluorescent protein[J].J Microbiol Biotechnol,2010,20(3):460-466.
[44]LI J,SUN W,WANG B,et al.Protein trans-splicing as a means for viral vector-mediated in vivo gene therapy [J].Hum Gene Ther,2008,19(9):958-964.
[45]WU W,WOOD D W,BELFORT G,et al.Intein-mediated purification of cytotoxic endonuclease I-TevI by insertional inactivation and pH-controllable splicing [J].Nucleic Acids Res,2002,30(22):4864-4871.
[46]BOCKHORN J J,LAZAR K L,GASSER A J,et al.Novel semisynthetic method for generating full length beta-amyloid peptides[J].Biopolymers,2010,94(4):511-520.
[47]OZAWA T,UMEZAWA Y.Detection of protein-protein interactions in vivo based on protein splicing [J].Curr Opin Chem Biol,2001,5(5):578-583.
[48]EVANS T J,XU M Q,PRADHAN S.Protein splicing elements and plants:from transgene containment to protein purification[J].Annu Rev Plant Biol,2005,56:375-392.
[49]KWON Y,COLEMAN M A,CAMARERO J A.Selective immobilization of proteins onto solid supports through splitintein-mediated protein trans-splicing [J].Angew Chem Int Ed Engl,2006.45(11):1726-1729.

