姜黃素對阿爾茨海默病中Aβ誘導的神經毒性保護作用的研究進展
張莉莉,査曉明,樓影涵,張 茵,陳 莉,張陸勇
(1.中國藥科大學 新藥篩選中心,江蘇 南京 210009;2.中國藥科大學 中藥學院 天然藥物化學教研室,江蘇 南京 210009;3.中國藥科大學 藥學院 藥物化學教研室,江蘇 南京 210009)
阿爾茨海默病(Alzheimer's disease,AD)是一種進行性神經退變性疾病,其病理特征主要有3個:老年斑(senile plague,SP)、神經纖維纏結(neurofibrillary tangles,NFT)和神經元尤其是膽堿能神經元的缺失。β淀粉樣蛋白(Amyloidβ-peptide,Aβ)是AD三大病變之一SP的核心成分,也是其他AD腦病變產生的基礎,Aβ對神經元具有神經營養和神經毒雙重作用,低濃度的 Aβ(pmol·L-1~nmol·L-1)對未成熟分化的神經元表現出營養作用,但隨著Aβ濃度的升高(mol·L-1),對成熟分化的神經元則呈現出神經毒性,使樹突和軸突退縮,導致神經元減少或缺失。姜黃素[(3-甲氧基-4-羥基)苯基-1,6-庚二烯-3,5-二酮,圖1]是從姜黃根莖中分離出來的β-二酮類化合物,具有抗腫瘤、降血脂、抗氧化等活性。本文綜述了近年來姜黃素對Aβ誘導的神經毒性保護作用的研究進展。
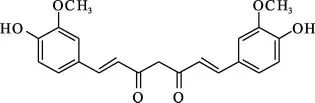
圖1 姜黃素的化學結構
1 由Aβ誘導的神經毒性作用
Aβ是由β淀粉樣蛋白前體蛋白(β-amyloid precursor protein,APP)分別經β-分泌酶(β-secretase)和γ-分泌酶(γ-secretase)的酶切作用產生[1]。APP在β-分泌酶作用下,生成分泌性APP(secretoryAPP,sAPPβ)和含有Aβ結構的羥基端片段稱 C99(C-terminal membrane-bound 99-amino acid residue fragment C99),C99在γ-分泌酶的作用下,生成Aβ并釋放至細胞外[2]。大量研究證實Aβ的生成、聚集和沉積是AD致病的核心因素,Aβ的大量沉積形成淀粉樣斑塊即老年斑,繼而出現神經元喪失、神經纖維纏結等病理特征[3]。Aβ誘導的神經毒性的分子機制比較復雜,已有的研究主要包括通過氧化和脂質過氧化促進自由基的形成,增強致炎細胞因子引起炎癥反應,Tau蛋白的磷酸化形成神經纖維纏結,破壞細胞內的Ca2+穩態,促進金屬離子Fe2+和Cu2+等的增多,激活細胞凋亡級聯反應,降低K+通道的功能等[4-5]。
2 姜黃素對Aβ誘導的神經毒性的保護作用
近年來研究發現,姜黃素能顯著抑制Aβ的生成和聚集。姜黃素不僅可以通過與Aβ自身的結合抑制其生成和聚集、透過血腦屏障與斑塊結合促進斑塊的降解,還可以通過其他多種途徑來保護Aβ誘導的神經毒作用。Ono等[6]在實驗中證明姜黃素能夠劑量依賴性地與Aβ40和Aβ42結合抑制它們進一步的聚集(EC50=0.19~0.63μM)。Yang等[7]也證實姜黃素在0.1~1.0μM 的濃度下與 Aβ40和Aβ42結合抑制其低聚物的形成。Yanagisawa等[8]從構效關系上發現姜黃素的酮-烯醇結構比酮式結構更易與Aβ的聚合物結合,證明姜黃素的烯醇化是其與Aβ結合的關鍵。
2.1 姜黃素通過抑制Aβ的生成保護Aβ誘導的神經毒作用
Aβ由β淀粉樣蛋白前體(APP)轉化而來,APP經β-或γ-分泌酶和一系列其他蛋白酶的作用產生易聚集和沉淀的Aβ。王蓬文等[9]通過實驗觀察姜黃素對APPswe/PS1dE9雙轉基因小鼠Aβ生成酶早老素2(presenilin2,PS2)和Aβ降解酶胰島素降解酶(insulin degrading enzyme,IDE)表達的影響,證實姜黃素能通過減少Aβ生成酶和增加Aβ降解酶的表達,降低Aβ蛋白的生成進而改善APPswe/PS1dE9雙轉基因小鼠的學習記憶能力,從而抑制Aβ誘導的神經毒作用。
姜黃素還可以通過降低APP和β位點APP切割酶1(β-site APP cleavage enzyme1,BACE1)的水平來抑制 Aβ生成。APP和BACE1過度表達導致 Aβ生成增加,Cu2+和Mn2+能增加嗜鉻細胞瘤(pheochromocytoma)PC12細胞的APP和BACE1表達,姜黃素可以通過阻止這些金屬離子的效應降低 APP和BACE1過度表達從而降低 Aβ生成[10]。Shimmyo等[11]發現在胚胎小鼠大腦皮層神經細胞的培養研究中,3~30μM的姜黃素能夠抑制BACE1的過度表達。
2.2 通過抗氧化作用保護Aβ誘導的神經毒作用
姜黃素獨特的抗氧化活性與其結構密切相關。姜黃素的兩個苯環上各有一個酚羥基和一個甲氧基,兩個苯環中間通過一個共軛的β-雙酮/烯醇式鏈連接。Priyadarsini指出酚基團對于姜黃素清除氧自由基是必要的,甲氧基的存在進一步增加其抗氧化活性[12]。Miriyala[13]認為姜黃素的抗氧化活性歸因于酚基團和甲氧基團與1,3-二酮結合的雙烯系統連接起來。AD患者腦內的活性氧(reactive oxygen species,ROS)是 Aβ的毒性產物[14],可損傷細胞,引起細胞主要成分如蛋白質和脂類氧化,最終導致基因組的不穩定從而導致神經元細胞的死亡[15]。姜黃素的神經保護作用主要是通過刺激轉錄因子Nrf2表達[16],抑制 MAP激酶信號和影響細胞分裂周期對抗氧化的谷氨酸毒性[17],從而阻礙氧化應激對AD腦中Aβ誘導的神經毒性的影響。Park等[18]發現當PC12細胞被暴露在10μM 的 Aβ25-35中24h后,抗氧化酶水平明顯增高,同時伴有DNA的損傷和細胞活性的下降,而當PC12細胞被10μg·mL-1的姜黃素預處理1h后,則能通過降低氧化應激抑制Aβ的這種效應。
2.3 通過抗炎作用保護Aβ誘導的神經毒作用
AD的重要發病機制之一是神經細胞的慢性炎癥。研究證實,Aβ的沉積能夠誘導炎癥物質如小膠質細胞、星型細胞和促炎癥物質的增加。在一項PBM和THP-1細胞的研究中發現Aβ1-40或 Aβ1-42的增多能夠誘導Erg-1蛋白的表達,而Erg-1可以刺激單核細胞中細胞因子TNF-α、IL-1β和炎癥趨化因子 MIP-1β、MCP-1、IL-8的表達,姜黃素(12.5~25μM)能夠抑制早期 Erg-1蛋白的增多[19]。Lee等[20]發現 Aβ25-35可激活小膠質細胞,導致 NO、TNF-α、IL-1和IL-6促炎癥反應,引起神經細胞的損傷,而姜黃素可以通過阻止炎癥狀態時小膠質細胞的活性來保護神經元的損傷。Cole等[21]發現AD模型中,Aβ的生成和堆積能夠誘導多種炎癥因子的增多,如 IL-1、TNFα、COX-2、iNOS、JNK、NF-κB等,這些炎癥因子能夠通過炎癥反應產生神經毒作用,姜黃素能夠抑制這些炎癥因子的表達,從而起到神經保護作用。
2.4 通過抑制Tau蛋白的過度磷酸化發揮保護Aβ誘導的神經毒作用
神經纖維纏結(neurofibrillary tangles,NFTs)是AD的一個病理特征,NFTs由細胞內高度磷酸化的Tau蛋白聚集形成,而Tau蛋白的過度磷酸化與Aβ的生成和聚集密切相關。在一項姜黃素通過抑制氧化損傷和Tau蛋白的磷酸化保護Aβ對PC12細胞產生的神經毒性實驗中,Park等[18]發現Aβ25-35能顯著誘導細胞內Tau蛋白磷酸化的增加,而用10μg·mL-1的姜黃素預處理PC12細胞則能明顯抑制Tau蛋白的過度磷酸化。于嵩等[22]用姜黃素飼料喂養APP/PSI轉基因小鼠9個月后,用 Western blot檢測p-Tau的表達水平,發現姜黃素喂養組與正常對照組比較p-Tau蛋白表達顯著降低,表明姜黃素可能通過抑制Tau蛋白的磷酸化起到對APP/PSl轉基因小鼠大腦神經元的保護作用。
2.5 通過抑制細胞內鈣的水平保護Aβ誘導的神經毒作用
研究表明,在病變部位Aβ的增多能夠引起神經元細胞內Ca2+濃度的增高,造成Ca2+穩態的失衡,從而引起一系列鈣依賴型反應。如使鈣依賴型Tau蛋白磷酸化相關激酶活性增強,誘導Tau蛋白磷酸化并最終導致神經元損傷等。在動物試驗中可觀察到口服姜黃素能夠降低Aβ誘導的細胞內Ca2+的濃度,從而保護神經元細胞免受損傷[23]。Aβ也可通過參與與谷氨酸相互作用而損傷神經元,谷氨酸對神經細胞毒性作用是通過激活N-甲基-D-天門冬氨酸(NMDA)型受體,改變Ca2+、Na+、Cl+等離子的通透性,使細胞腫脹、變性及至死亡。姜黃素通過抑制NMDA受體介導的Ca2+內流,進而減輕興奮性中毒的損傷而起到細胞保護作用[24]。
2.6 姜黃素通過與金屬離子的螯合化作用保護Aβ誘導的神經毒作用
AD患者腦內Aβ的過度生成能誘導金屬離子(如Fe2+和Cu2+)的增多,這些金屬離子與Aβ結合,誘導Aβ聚集,催化產生自由基,在DNA和蛋白質水平導致神經細胞的損傷[25]。姜黃素是一種天然金屬螯合劑,螯合Fe2+和Cu2+等金屬離子,降低Aβ沉積,進而起到神經保護作用[26]。進一步發現一分子Fe2+和Cu2+等重金屬離子能與兩分子姜黃素作用形成金屬螯合物,保護神經細胞[27-28]。
2.7 通過抑制神經細胞的凋亡來保護Aβ誘導的神經毒作用
AD患者神經元的樹突棘與軸突丟失導致認知缺陷,Aβ學說認為Aβ毒性導致神經元的這種損傷。研究發現,姜黃素可以通過抑制細胞內Aβ(iAβ)誘導的細胞凋亡蛋白酶的水平和提高iAβ誘導的p-AKT的水平來保護iAβ誘導的神經毒作用。在一項姜黃素對小鼠的額葉前部皮質神經元iAβ誘導的神經毒性保護實驗中,Qin等[29]發現模型組在小鼠的額葉前部皮質神經元細胞內導入Aβ后,caspase-3的濃度顯著提高,而受試組在服用10μM的姜黃素后,則能明顯降低iAβ誘導的caspase-3濃度,該實驗也發現iAβ能夠降低神經保護通路蛋白AKT(p-AKT)的濃度,而姜黃素對iAβ有抑制作用。廖濤等[30]在一項姜黃素改善癡呆模型小鼠學習記憶能力及影響細胞凋亡實驗中發現,姜黃素可以通過上調bcl-2,下調bax,升高bcl-2/bax比值來有效抑制神經細胞凋亡。
3 結語
姜黃素通過抑制Aβ的生成、Tau蛋白的過度磷酸化和神經細胞凋亡,螯合腦組織中金屬離子、抑制胞內鈣離子水平和抗炎、抗氧化等方式對Aβ誘導的神經毒性起到保護作用。姜黃素的作用方式具有多靶向、多途徑的特點,且自身毒性極小。因此,深入研究姜黃素在AD中的神經保護及其作用機制,對于開發一類用于阿爾茨海默癥治療的神經保護藥物具有重要意義。
[1]THOMAS P,FENECH M.A review of genome mutation and Alzheimer's disease[J].Mutagenesis,2007,22(1):15-33.
[2]ZHANG C,KHANDELWAL PJ,CHAKRABORTY R,et al.An AICD-based functional screen toidentify APP metabolism regulators[J].Mol Neurodegener,2007,2(15):1-19.
[3]VASSAR R.beta-Secretase,APP and abeta in alzheimer's disease[J].Subcell Biochem,2005,38:79-103.
[4]CUMMINGS JL.Alzheimer's disease[J].N Engl J Med,2004,351(1):56-67.
[5]BAMBERGER ME,HARRIS ME,MCDONALD DR,et al.A cell surface receptor complex for fibrilar beta-amyloid mediates microglial activation[J].J Nettroscl,2003,23(7):2665-2674.
[6]ONO K,HASEGAWA K,NAIKI H,et al.Curcumin has potent anti-amyloid ogenic effects for Alzheimer's beta-amyloid fibrils in vitro[J].Neurosci Res2004,3(15):742-750.
[7]YANG F,LIM GP,BEGUM AN,et al.Curcumin inhibits formation of amyloid beta oligomers and fibrils,binds plaques,and reduces amyloid in vivo[J].Biol Chem2005,280:5892-5901.
[8]DAIJIRO Y,NOBUAKI S,TOMONE A,et al.Relationship between the tautomeric structures of curcumin derivatives and their Ab-binding activities in the context of therapies for Alzheimer's disease[J].Biomaterials,2010,31:4179-4185.
[9]王蓬文,李瑞晟,王虹,等.姜黃素對APPswe/PS1dE9雙轉基因小鼠Aβ生成和降解的影響[J].中國實驗動物學報,2010,18(5):367-371.
[10]LIN RZ,CHEN XH,LI WM,et al.Exposure to metal ions regulates mRNA levels of APP and BACE1in PC12 cells:blockage by curcumin[J].Neurosci Lett,2008,440(3):344-347.
[11]SHIMMYO Y,KIHARA T,AKAIKE A,et al.Epigallocatechin-3-gallate and curcumin suppress amyloid beta-induced beta-site APP cleaving enzyme-1upregulation[J].Neuroreport,2008,19:1329-1333.
[12]PRIYADARSINI KI,MAITY DK,NAIK GH ,et al.Role of phenolic OH and methylene hydrogen on the free radical reaction and antioxidant activity of curcumin[J].Free Rad Biol Med,2003,35(5):475-484.
[13]MIRIYALA S,PANCHATCHARAM M,RENGARAJULU P.Cardioprotective effects of curcumin[J].Adv Exp Med Biol,2007,595:359-377.
[14]LIM GP,CHU T,YANG FS,et al.The curry spice curcumin reduces oxidative damage and amyloid pathology in an alzheimer transgenic mouse[J].J Neurosci,2001,21(21):8370-8377.
[15]THOMAS P,WANG YJ,ZHONG JH,et al.Grape seed polyphenols and curcumin reduce genomic instability events in a transgenic mouse model for Alzheimer's disease[J].Mutat Res,2009,661(1/2):25-34.
[16]SALVIOLI S,SIKORA E,COOPER EL,et al.Curcumin in cell death processes:a challenge for CAM of age-related pathologies[J].eCAM,2007,4(2):181-190.
[17]SUH HW,KANG S,KWON KS.Curcumin attenuates glutamate-induced HT22cell death by suppressing MAP kinase signaling[J].Mol Cell Biochem,2007,298(1/2):187-194.
[18]PARK SY,KIM HS.Curcumin protected PC12cells against beta-amyloid-induced toxicity through the inhibition of oxidative damage and tau hyperphosphorylation[J].Food Chem Toxic,2008,46(8):2881-2887.
[19]GIRI RK,RAJAGOPAL V,KALRA VK.Curcumin,the active constituent of turmeric,inhibits amyloid peptide-induced cytochemokine gene expression and CCR5-mediated chemotaxis of THP-1monocytes by modulating early growth response-1transcription factor[J].Neurochem,2004,91:1199-1210.
[20]LEE HS,JUNG KK,CHO JY,et al.Neuroprotective effect of curcumin is mainly mediated by blockade of microglial cell activation[J].Pharmazie,2007,62(12):937-942.
[21]COLE GM,LIM GP,YANG F,et al.Prevention of Alzheimer's disease:Omega-3fattyacid and phenolic anti-oxidant interventions[J].Neurobiol Aging,2005,26(1):133-136.
[22]于嵩.姜黃素對帕金森病及阿爾茨海默病神經元保護作用的實驗研究[D].沈陽:中國醫科大學,2010:1-59.
[23]AMAUD L,ROBAKIS NK,FIGUEIREDO-PEREIRA ME.It may take inflammation,phosphorylation and ubiquitination to'tangle'in Alzheimer's disease[J].Neurodegener Dis,2006(3):313-319.
[24]AHUJAK DK,KUNDE DA,BALLM J,et al.Effects of capsaicin,dihydrocapsaicin,and curcumin on copper induced oxidation of human serumlipids[J].J Agric Foos Chem,2006,54(17):6436-6439.
[25]THOMAS P,FENECH M.A review of genome mutation and Alzheimer's disease[J].Mutagenesis,2006,22(1):15-33.
[26]HATCHER H,PLANALP R,CHO J,et al.Curcumin:From ancient medicine to current clinical trials[J].Cell Mol Life Sci,2008,65(11):1631-1652.
[27]BAUM L,NG A.Curcumin interaction with copper and iron suggests one possible mechanism of action in Alzheimer's disease animal models[J].Alzheimer's Dis,2004,6:367-377.
[28]HEGDE ML,BHARATHI P,SURAM A,et al.Challenges Associated with Metal Chelation Therapy in Alzheimer's Disease[J].J Alzheimer Dis,2009,17:457-468.
[29]QIN XY,CHENG Y,YU LC.Potential protection of curcumin against intracellular amyloidβ-induced toxicity in cultured rat prefrontal cortical neurons[J].Neurosci Lett,2010,480:21-24.
[30]廖濤,王飛.姜黃素對癡呆模型小鼠學習記憶能力的改善作用及對細胞凋亡的影響[J].中國藥理學通報,2009,25(10):1359-1363.

