亞低溫對大鼠腦缺血再灌注損傷后熱休克蛋白70表達及細胞凋亡的影響
華正宇,張春蕾
(1.大連醫科大學 附屬第一醫院 病理科,遼寧 大連116011; 2.大連大學 附屬中山醫院 中心實驗室,遼寧 大連 116001)
腦缺血再灌注損傷是一個復雜的病理生理過程,近幾年來許多臨床研究報告肯定了亞低溫的腦保護作用[1]。研究發現亞低溫腦保護作用的機制,可能涉及到損傷級聯中的多個事件,從多個環節影響基因、蛋白質的表達[2]。熱休克蛋白70(heat shock protein 70, HSP70)是所有原核細胞和真核細胞在高溫或應激情況下所產生的一組具有高度保守性的蛋白質。HSP70在腦缺血再灌注損傷中的表達研究報道較多,但亞低溫對腦缺血再灌注損傷中HSP70表達影響的研究報道較少。本研究通過亞低溫對缺血再灌注腦組織HSP70表達和細胞凋亡的影響,探討亞低溫對腦缺血再灌注保護作用的機制。
1 材料和方法
1.1 實驗動物及分組
健康SD雄性大鼠56只,體重(200~230)g,由哈爾濱醫科大學第二臨床醫院實驗動物中心提供[實驗動物生產許可證號:SCXK(黑)20020002],標準環境下飼養(常溫自由進食飲水)。將大鼠隨機分為4組(正常組、假手術組、常溫缺血組和亞低溫缺血組),正常組和假手術組每組4只,常溫缺血組和亞低溫缺血組每組24只,兩缺血組分別分為再灌注3、6、12、24、72 h和7 d組,每組4只。
1.2 動物模型的制備
采用改良的Longa線拴法建立大鼠局灶腦缺血再灌注損傷模型。假手術組大鼠除不栓塞大腦中動脈外,余處理同缺血組。亞低溫組大鼠于腦缺血后13 min左右采用可調控亞低溫儀[哈爾濱工業大學熱工教研室研制,專利號:ZL98236936.0]誘導頭部亞低溫,使大鼠于腦缺血后30 min時病灶側腦組織溫度控制在32~33℃。參照Longa等[3]的評分法,0分:無神經缺損癥狀;1分:右前肢屈曲;2分:向右旋轉;3分:向右傾倒;4分:不能行走或昏迷。1~4分為有效模型,納入實驗分組。出血較多,梗死灶不明顯或提前死亡的大鼠均剔除。
1.3 HE染色觀察神經細胞形態學改變
各組大鼠于相應時間點戊巴比妥鈉過量麻醉,用10%的甲醛溶液行心臟灌流固定后斷頭取腦,自視交叉向前后各取2.5 mm左右的冠狀腦片,充分固定脫水透明后石蠟包埋,連續切片作HE染色。
1.4 免疫組化染色檢測腦組織HSP70表達
按照HSP70免疫組化試劑盒(購自武漢博士德生物工程有限公司)說明進行實驗操作。光鏡下神經元胞漿中有棕黃色顆粒的為陽性細胞。每張切片于梗死灶周圍選擇10個表達最強的高倍視野計數。
1.5 細胞凋亡的檢測
TUNEL試劑盒購自Roche公司,步驟同說明書。光鏡下神經元胞核中有棕黃色顆粒的為陽性細胞。每張切片于梗死灶周圍選擇10個表達最強的高倍視野計數。
1.6 統計學方法
2 結 果
2.1 病理形態學觀察
正常組及假手術組均未見明顯病理改變。常溫缺血組可見梗死灶主要位于大鼠左側大腦皮質及基底核區,呈典型的缺血性改變,神經氈疏松,組織水腫明顯,神經元變性、壞死,胞體縮小,尼氏體消失,胞核固縮、碎裂、溶解,胞漿呈嗜酸性變。病變部位與周圍組織界限較清楚,其中心區神經元數量明顯減少。亞低溫缺血組較腦缺血組梗死灶明顯減小,梗死灶內殘存的神經元較多,可見輕度缺血性改變,腦水腫明顯減輕(圖1)。
2.2 腦組織HSP70表達
正常組及假手術組未見或偶見HSP70陽性細胞;缺血組HSP70陽性細胞較多;亞低溫組在相應時間點均明顯減少(P<0.05),見表1,圖2。
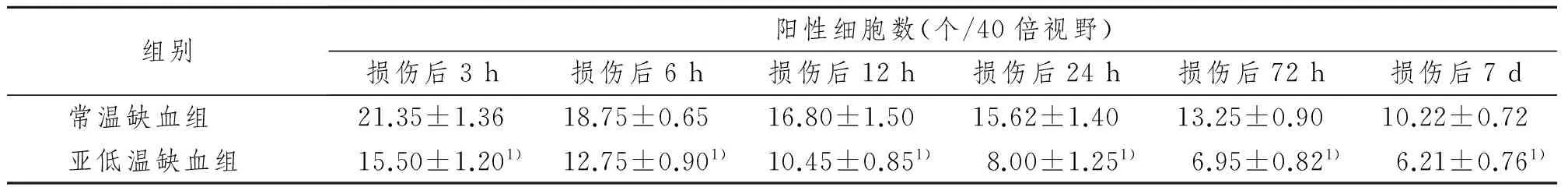
組別陽性細胞數(個/40倍視野)損傷后3h損傷后6h損傷后12h損傷后24h損傷后72h損傷后7d常溫缺血組21.35±1.3618.75±0.6516.80±1.5015.62±1.4013.25±0.9010.22±0.72亞低溫缺血組15.50±1.201)12.75±0.901)10.45±0.851)8.00±1.251)6.95±0.821)6.21±0.761)
1) 與相同時間點的常溫缺血組比較,P<0.05
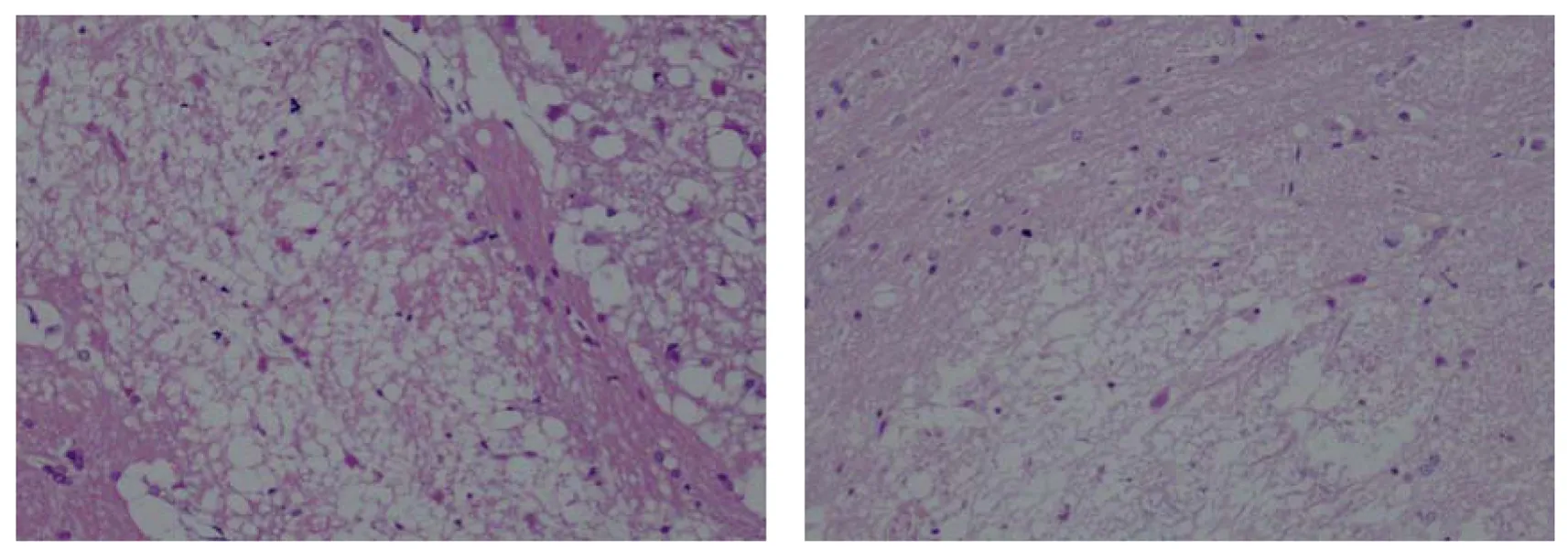
圖1 缺血再灌注24 h大鼠腦組織病理形態(HE染色 ×100)Fig 1 Ischemia/reperfusion 24 h pathological changes in rat brain tissue(hematoxylin and eosin ×100)A. 常溫缺血組梗死灶明顯形成,大量神經元壞死消失; B. 亞低溫缺血組梗死灶明顯減小,可見神經元固縮
A. Infarction region formed obviously with lots of neurons lost in normothermia ischemia/reperfusion group; B. Infarction region minished obviously with lots of neurons pyknosis in hypothermia ischemia/reperfusion group
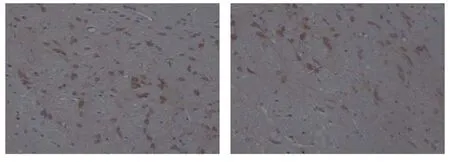
圖2 缺血再灌注24 h大鼠腦組織 HSP70表達(SP法 ×200)Fig 2 Ischemia/reperfusion 24 h HSP70 positive neurons in rat brain tissue (SP ×200)A. 常溫缺血組HSP70陽性細胞較多; B. 亞低溫缺血組HSP70陽性細胞較少
A. The expressions of HSP70 were higher in normothermia ischemia/reperfusion group;B. The expressions of HSP70 were lower in hypothermia ischemia/reperfusion group
2.3 TUNEL結果
TUNEL主要標記神經元及膠質細胞。常溫缺血組TUNEL陽性細胞數隨再灌注時間的延長而逐漸增多,至72 h達高峰;亞低溫缺血組各時間點的表達明顯減少(P<0.05),見表2,圖3。
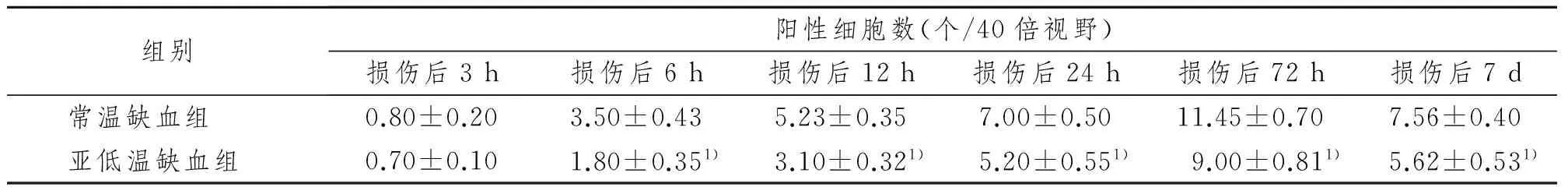
組別陽性細胞數(個/40倍視野)損傷后3h損傷后6h損傷后12h損傷后24h損傷后72h損傷后7d常溫缺血組0.80±0.203.50±0.435.23±0.357.00±0.5011.45±0.707.56±0.40亞低溫缺血組0.70±0.101.80±0.351)3.10±0.321)5.20±0.551)9.00±0.811)5.62±0.531)
1)與相同時間點的常溫缺血組比較,P<0.05
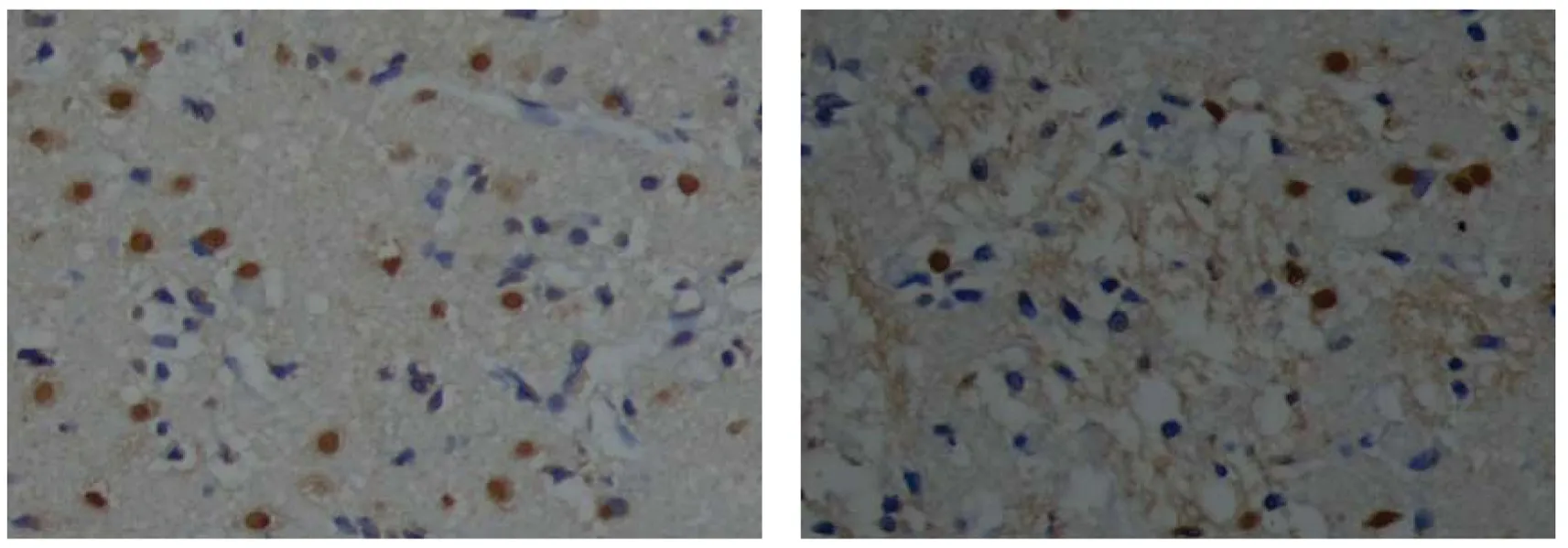
圖3 缺血再灌注72 h大鼠腦組織TUNEL陽性細胞表達(×200)Fig 3 Ischemia/reperfusion 72 h TUNEL positive cells in rat brain tissue(×200)A. 常溫缺血組TUNEL陽性細胞較多; B. 亞低溫缺血組TUNEL陽性細胞較少
A. The expressions of TUNEL were higher in normothermia ischemia/reperfusion group; B. The expressions of TUNEL were lower in hypothermia ischemia/reperfusion group
3 討 論
熱休克蛋白是一類在進化上高度保守,廣泛存在于原核和真核細胞內的,在高溫、缺血、缺氧、損傷等應激情況下誘導產生的蛋白質,又稱熱應激蛋白。其中HSP70是最保守和最主要的一類,在大多數生物中含量最高,它發揮“分子伴侶”的作用而增加細胞對應激的耐受性,參與細胞內蛋白質的折疊、裝配、降解、轉移和修復等過程,以維護細胞的蛋白自穩系統,在細胞的信息傳遞、生長、分化中具有重要的調控作用。同時,它又可以作為一種內源性保護物質對細胞的損傷產生自身保護作用。研究發現,缺血、創傷、氧化應激等均導致中樞神經系統內HSP70的大量表達,HSP70被認為是損傷后腦組織產生的一種重要的內源性保護因子[4],在缺血早期對神經元具有保護作用,在缺血后期對神經細胞的修復起著重要作用[5],其表達的強度可在一定程度上反映神經細胞的損傷程度及對缺血損傷的耐受性,是缺血性腦損傷較為敏感的指標。本實驗結果顯示,常溫缺血組HSP70陽性細胞較多,亞低溫缺血組在相應時間點較常溫缺血組HSP70陽性細胞均明顯減少,推測亞低溫可能通過降低腦組織氧耗量,提高腦組織對缺血缺氧的耐受性,從而保護血腦屏障,減少多種有害物質產生,提高離子穩定性,減少Ca2+內流,腦組織缺血性的損傷程度明顯減輕,使HSP70在神經細胞受損時的保護性表達程度降低,提示亞低溫治療腦缺血再灌注損傷不是通過誘導HSP70的表達而起保護作用。張秀洲等[6]通過制作右側大腦中動脈阻塞(MCAO)模型,觀察缺血2 h再灌注48 h后大鼠腦組織學改變和HSP70及膠質纖維酸性蛋白的表達。結果顯示,常溫組可見大量HSP70陽性細胞,胞漿呈棕黃色,染色較深,亞低溫組HSP70陽性細胞數比常溫組少,而且染色較淺,這與本研究結果相符。
腦缺血再灌注損傷的病理生理是一個多環節、多因素、多途徑損傷的酶促級聯反應,其機制與氧自由基損傷、興奮性氨基酸毒性、細胞內鈣超載、凋亡、炎癥反應等多種因素有關[7]。亞低溫對缺血性腦損傷的保護作用也是多因素相互作用共同完成的,如①降低腦組織氧耗量,減輕腦組織酸中毒[8];②保護血腦屏障,減輕缺血再灌注損傷[9];③減緩腦細胞內Ca2+超載,減輕神經元損傷以及腦水腫程度[10];④降低氨基酸遞質的釋放,減輕興奮性毒性腦損傷[11];⑤抑制氧自由基的生成[12];⑥抑制炎癥介質的釋放及炎性反應[13];⑦抑制一氧化氮合酶活性[14];⑧抑制神經元凋亡[15]等。本實驗通過病理形態學觀察發現常溫缺血組腦組織梗死灶明顯,呈典型的缺血性改變,神經氈疏松,組織水腫明顯,神經元變性、壞死,胞體縮小,尼氏體消失,胞核固縮、碎裂、溶解,胞漿呈嗜酸性變。亞低溫缺血組較常溫缺血組梗死灶明顯減小,梗死灶內殘存的神經元較多,可見神經元固縮和輕度缺血性改變,腦水腫明顯減輕,說明亞低溫可以減輕缺血再灌注后腦組織的損傷。發生損傷性缺血再灌注后,腦組織中產生大量的自由基、興奮性氨基酸及NO,這些物質除了自身對細胞的直接毒性作用外,還下調參與應激保護的生物活性物質,下調Bcl-2等基因的表達等,最終誘導細胞凋亡的發生[16]。本實驗凋亡細胞的檢測結果顯示,常溫缺血組TUNEL陽性細胞數隨再灌注時間的延長而逐漸增多,至72 h達高峰;亞低溫缺血組各時間點TUNEL的表達較常溫缺血組明顯減少,說明亞低溫可以抑制神經元及膠質細胞凋亡。
[1] 張同圓,王龍.重型顱腦損傷圍術期亞低溫治療路徑—循證醫學指導下的治療抉擇[J].醫學與哲學(臨床決策論壇版),2010,31(9):3-4.
[2] 潘寧, 杜怡峰. 亞低溫腦保護的分子生物學機制研究進展[J]. 中華老年心腦血管病雜志, 2008, 10(7):555-557.
[3] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery: occlusion without craniectomy in rats[J]. Stroke, 1989, 20(1):84-91.
[4] 馬旭,呂剛.HSP-70與細胞保護的研究進展[J].大連醫科大學學報,2007,29(2):194-197.
[5] 劉耘,史佳巍,袁翔宇.丹星通絡湯對腦缺血再灌注損傷大鼠熱休克蛋白70表達的影響[J].現代中西醫結合雜志,2007,16(11):1463-1465.
[6] 張秀洲,李文華,劉雪平.亞低溫對大鼠腦缺血再灌注損傷后熱休克蛋白70及膠質纖維酸性蛋白表達的影響[J].臨床神經病學雜志,2006,19(2):112-114.
[7] Ferrer I,Planas AM.Signaling of cell death and cell survival following focal cerebral ischemia:life and death struggle in the penumbra[J].J Neuropathol Exp Neurol,2003,62(4):329-339.
[8] Erecinska M,Thoresen M,Silver IA,et al.Effects of hypothermia on energy metabolism in Mammalian central nervous system[J].J Cerebr Blood F Met,2003,23(5):513- 530.
[9] Shiozaki T,Nakajima Y,Taneda M,et al.Efficacy of moderate hypothermia in patients with severe head injury and intracranial hypertension refractory to mild hypothermia[J].J Neurosurg,2003,99(1):47-51.
[10] 周峰,鄭豐任.亞低溫對顱腦損傷后腦細胞內鈣離子濃度及腦水腫影響的實驗研究[J].創傷外科雜志,2003,5(3):191-194.
[11] Van Hemelrijck A,Vermijlen D,Hachimi-Idrissi S,et al.Effect of resuscitative mild hypothermia on glutamate and dopamine release,apoptosis and ischaemic brain damage in the endothelin-1 rat model for focal cerebral ischaemia[J].J Neurochem,2003,87(1):66-75.
[12] 林淑香,劉亢丁,付鐵娟,等.亞低溫對大鼠局灶性腦缺血氧自由基和一氧化氮的影響[J].中國實驗診斷學,2009,13(12):1680-1682.
[13] Wang GJ,Deng HY,Maier CM,et al.Mild hypothermia reduces ICAM-1 expression,neutrophil infiltration and microglia/monocyte accumulation following experimental stroke[J].Neuroscience,2002,114(4):1081-1090.
[14] Karabiyikoglu M,Han HS,Yenari MA,et al.Attenuation of nitric oxide synthase isoform expression by mild hypothermia after focal cerebral ischemia: variations depending on timing of cooling[J].J Neurosurg,2003,98(6):1271-1276.
[15] Wang LM,Yan Y,Zou LJ,et al.Moderate hypothermia prevents neural cell apoptosis following spinal cord ischemia in rabbits[J].Cell Res,2005,15(5):387-393.
[16] 呂鵬,李玲,張麗.大鼠全腦缺血對再灌注海馬區NO含量和Bcl-2表達的影響[J].大連醫科大學學報,2009,31(6):649-652.

