鈀/銅協同催化合成3,4-二氫香豆素衍生物
王晗深 邵江斌 鄧 云 劉運奎 許響生
(浙江工業大學化學工程與材料學院,浙江 杭州 310014)
香豆素衍生物是一類重要的有機雜環化合物,由于具有抗菌、消毒、抗凝和抗腫瘤等多種生理活性而倍受人們的關注,已被廣泛應用于醫藥領域[1]。另外,香豆素骨架還具有優良的光電性能,在熒光增白劑[2]、電致發光材料[3]和有機光敏材料[4]等領域都有廣泛應用。合成香豆素類化合物最常見的方法有Pechman法[5]、Perkin法[6]和Reimer-Tiemann法[7]等,但這些方法一般存在副產物多、反應條件苛刻等弊端和缺陷。因此,人們一直致力于合成香豆素類化合物的新方法和新工藝研究。最近,徐振元課題組發現Au/Ag復合催化劑能催化Baylis-Hillman加成物的分子內環化反應合成3,4-二氫香豆素[8]。
鈀催化反應是現代有機合成中應用最為廣泛的工具之一,該類反應具有活性及選擇性高、使用范圍廣、反應條件溫和、催化劑用量少和操作簡便等特點[9]。另外,與Au和Ag等貴金屬催化劑相比,鈀催化劑的價格相對便宜。近年來,鈀催化的Baylis-Hillman加成物分子內環化反應成為合成環狀化合物的有效方法[10-11]。因此本文對鈀催化分子內環化反應合成3,4-二氫香豆素進行了報道。如圖1(Scheme 1)所示,以Baylis-Hillman加成物1為原料,經氫溴酸溴代,得到溴代物2,再與2-萘酚反應得到醚化物3,最后經Pd(OAc)2/Cu(OTf)2復合催化劑的催化環化,合成了4個3,4-二氫香豆素衍生物(4a~4d)。
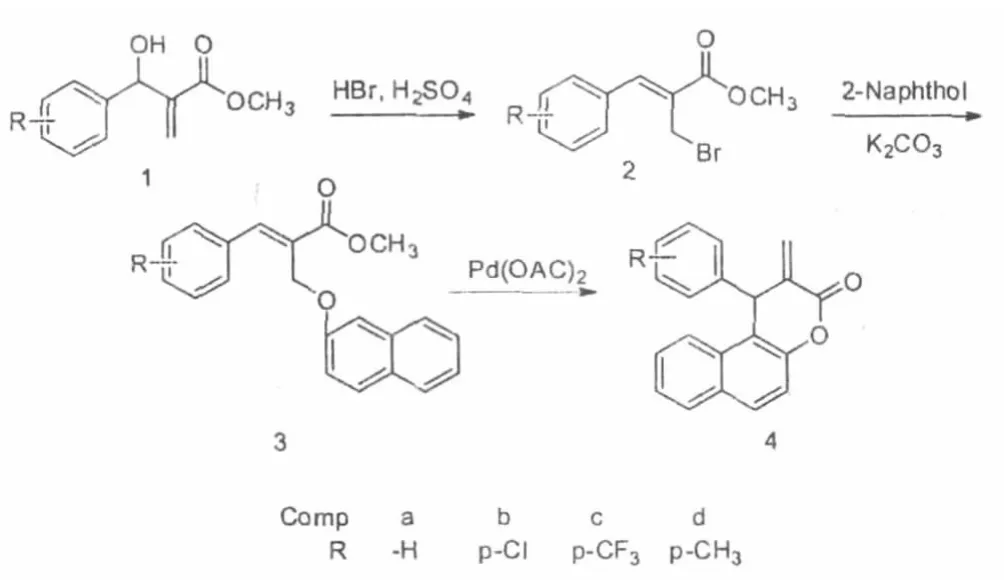
Scheme 1
1 實驗部分
1.1 儀器及試劑
Baylis-Hillman加成物根據文獻方法合成[12],其它藥品為市售分析純或化學純試劑。熔點用B-540型熔點儀測定,未經校正;1H-NMR由Bruker AC-500核磁共振儀測定,溶劑為CDCl3,內標物為TMS;GC-MS由Agilent 6890N GC/5973N氣質聯用儀測定。
1.2 合成
1.2.1 Baylis-Hillman加成物的溴代反應(以2a為例)
在裝有溫度計、磁力攪拌的25mL三口燒瓶中加入Baylis-Hillman加成物1a(0.78g,4mmol)和無水CH2Cl2(2mL),冰水浴下加入HBr(0.4mL,48%)和濃硫酸(0.16mL,98%),反應30min后撤去冰水浴,室溫下繼續反應3h。反應完畢加入CH2Cl2(10mL)稀釋,再分別用蒸餾水、5%NaHCO3水溶液和飽和食鹽水洗滌三次,有機相用無水MgSO4干燥,過濾、脫溶得到粗產物,經硅膠柱層析分離(石油醚:乙酸乙酯=20:1)得無色粘稠狀液體2a(0.85g,收率為83.66%)。
1.2.2 Baylis-Hillman溴代加成物的醚化反應(以3a為例)
在裝有溫度計、磁力攪拌的25mL三口燒瓶中分別加入溴代物2a(0.58g,4mmol)、2-萘酚(0.58g,4.1mmol)、無水碳酸鉀(0.57g,4mmol)和溶劑丙酮(4mL),加熱回流反應3h。反應完畢,過濾除去不溶固體,水洗,用無水MgSO4干燥,過濾,再減壓脫去溶劑,得到粗產物,粗產物經硅膠柱層析分離(石油醚:乙酸乙酯=20:1),提純得到白色固體3a(1.13g,收率為89.03m),熔點為53℃~55℃。
1.2.3 3,4-二氫香豆素類化合物的合成(以4a為例)
在氬氣保護下,往裝有冷凝管、溫度計和磁力攪拌的25mL三口燒瓶中分別加入3a(0.32g,1mmol),Pd(OAc)2(0.012g,5%mmol)和Cu(OTf)2(0.016g,5%mmol),無水1,2-二氯乙烷(2mL),110℃下反應15h,反應完畢,過濾除去不溶黑色固體,加入1,2-二氯乙烷(10mL)稀釋,水洗,用無水MgSO4干燥,過濾,再減壓脫去溶劑,得到粗產物,粗產物經硅膠柱層析分離提純(石油醚:乙酸乙酯=20:1)得到微黃色油狀物4a(0.23g,收率為81.11%)。
2 結果與討論
以化合物4a的合成為模板反應,對反應條件進行了優化。首先,我們考察了催化劑的種類對反應的影響,結果如表1所示。結果顯示二價鈀,如Pd(OAc)2和PdCl2均不能催化該反應,但是令我們意外的是,將Pd(OAc)2和Cu(OTf)2一起用于催化環化反應時,能以80.5%的收率預期得到產物。隨后我們進一步考察了銅鹽的種類對反應體系的影響,結果表明一價銅,如CuCl和CuI均不能與Pd(OAc)2構成有效的催化體系。因此我們設想,Pd(OAc)2和Cu(OTf)2在反應體系中是協同作用的,為了驗證這一假設,我們進一步考察了Cu(OTf)2催化該環化反應的實驗,結果表明單一Cu(OTf)2不具有催化活性。

表1 催化劑對合成香豆素類化合物的影響Table 1 the effect of catalyst
隨后我們又考察了溶劑對反應的影響,結果如表2所示。實驗表明極性溶劑乙腈等不利于反應的發生,而以1,4-二氧六環等中等極性溶劑時收率稍有提高,另一方面可能由于二氯甲烷回流溫度過低,導致反應不進行。以極性較弱的甲苯和1,2-二氯乙烷為溶劑時能夠獲得理想的效果,但是由于甲苯為溶劑時會產生副反應,所以采用1,2-二氯乙烷作為最理想的反應溶劑。
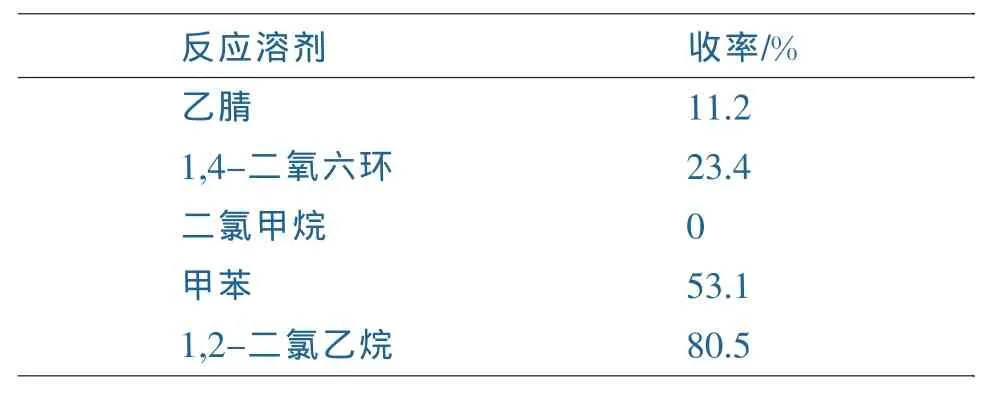
表2 反應溶劑對合成香豆素類化合物的影響Table 2 the effect of Solvent
通過對催化劑和溶劑的篩選,我們得到了較優的反應條件:以Pd(OAc)2/Cu(OTf)2為催化劑,以1,2-二氯乙烷為溶劑。接下來我們進一步考察了該反應的普適性,結果如表3所示。實驗表明該反應對原料的取代基具有很好的容忍性,不論是給電子的烷基取代基,還是吸電子的CF3,以及鹵素取代基均能得到較為理想的收率,且與無取代基下的收率相近。

表3 3,4-二氫香豆素類化合物的制備結果

表4 3,4-二氫香豆素類化合物的表征數據
3 結論
本文以Baylis-Hillman加成物為原料,經氫溴酸溴代、2-萘酚醚化,所得產物經Pd(OAc)2/Cu(OTf)2復合催化劑的催化環化,以優秀收率合成了4個3,4-二氫香豆素衍生物。
[1]Jakhar,Komal.Synthesis and antibacterial activity of 3-(coumarin-3-yl)acylthio-5H-1,2,4-triazino[5,6-b]indoles[J].Indian Journal of Heterocyclic Chemistry,2010,20:189-190.
[2]馬德強.化工百科全書[M].北京:化學工業出版社,1998:1047.
[3]黃春輝,李富友,黃巖誼.光電功能超薄膜[M].北京:北京大學出版社,2001:262.
[4]Hara K,Sayama K.A coumarin-derivative dye sensitized nanocrystalline TiO2solar cell having a high solarenergy conversion efficiency up to 5.6%[J].Chemical Communications,2001,6:569-570.
[5]Manhas Maghar S.Microwave initiated reactions:Pechman coumarin synthesis,Biginelli reaction,and acylation[J].Tetrahedron Letters,2006,47:2423-2425.
[6]Crawford I,J A M.Perkin coumarin synthesis[J].J.Chem.Soc,1953:3435-3439.
[7]Armstrong Douglas E.The Reimer-Tiemann reaction[J].J.Chem.Soc,1933:496-500.
[8]Liu Yunkui.Temperature-controlled selectivity toward[1,3]-or[3,3]-sigmatropic rearrangement:eegioselective synthesis of substituted 3,4-dihydrocoumarins[J].Synlett,2009,18:2971-2976.
[9]Yu Jinquan.Palladium(II)-catalyzed C-H activation/C-C cross-coupling reactions:Versatility and practicality[J].Angew.Chem.Int.Ed,2009,48:5094-5115.
[10]Kim S H.Regioselective synthesis of poly-substituted naphthalenes via a Pd-catalyzed cyclization of modified Baylis-Hillman adducts:selective 6-endo Heck reaction and an aerobic oxidation cascade[J].Tetrahedron Letters,2010,51:6305-6309.
[11]Kim S H,Lee H S,Kim K H,et al.Regioselective synthesis of naphthalenes from modified Baylis-Hillman adducts via a Pd-catalyzed cyclization:5-exo-carbopalladation,C(sp3)-H activation to cyclopropane,ring-opening,and aromatization cascade[J].Tetrahedron Letters,2010,51:4267-4271.
[12]Deevi B.Recent advances in the Baylis-Hillman reaction and applications[J].Chem.Rev,2003,103:811-891.

