肇慶市水硬度現狀的分析
劉燕芳
(肇慶學院 化學化工學院,廣東 肇慶 526061)
水中鈣離子和鎂離子的含量決定了水的總硬度.水硬度包括暫時硬度和永久硬度:以重碳酸鹽形成的硬度經煮沸后可以去除掉,稱為暫時硬度;以硫酸鹽等形式存在的硬度稱為永久硬度.
含較少可溶性鈣、鎂化合物的水叫做軟水.軟水不易與肥皂產生浮渣,而硬水則相反.含有大量鈣鹽和鎂鹽離子的水叫做硬水.按照世界衛生組織在《飲用水水質準則》中的建議分類標準可做如下分類[1]:總硬度(CaCO3值)在0~60 mg/L為軟水;60~120 mg/L為中等硬度水;120~180 mg/L為硬水;總硬度≥180 mg/L為高硬度水.世界衛生組織飲用水標準規定:最適宜飲用的水中鈣離子的含量為75~200 mg/L,鎂離子的含量為30~150 mg/L,鈣離子引起的鈣硬度和鎂離子引起的鎂硬度比例要適中,接近于人體內鈣、鎂離子的比例3:1,這樣的水才有利于人體的吸收,口感也較好.
水硬度的大小影響人體健康.研究表明,動脈硬化性心臟病、腦血管病、高血壓病均與高硬度水呈現負相關性,即水硬度越低的地區,這些病的死亡率越高[2].美國流行病學調查也已證實,水的硬度與心血管疾病的發病率在統計學意義上呈現顯著逆相關.有關資料顯示,這是由于硬度高的水中鈣、鎂離子含量多,它們在人體腸道中與食物中的脂肪及錫等有害元素結合后,不能被消化道吸收,被迅速排出體外,因而對心血管的危害相對較輕.肇慶是結石病高發區,這是否與水質的硬度有關目前尚無定論.
隨著人們生活水平的提高和健康意識的不斷增強,對飲用水水質的安全性也提出了更高要求.水體硬度指標是水質的一項重要指標,硬度指標的監測對于水體水質監測而言必不可少[3].目前,有關肇慶市水體硬度現狀分析的文獻報道極少[4],因此有必要對此進行深入研究.
1 實驗部分
1.1 實驗儀器與實驗試劑
實驗所用儀器為分析天平、50 mL酸式滴定管和其他常規分析儀器.實驗所用試劑如下:乙二胺四乙酸二鈉(EDTA,天津市福晨化學試劑廠,分析純);鉻黑T(EBT,廣州化學試劑廠,分析純);碳酸鈣(廣州化學試劑廠,分析純);實驗中所用的其余試劑均為分析純.
1.2 試劑配制
配制緩沖溶液(pH值=10):先將16.9 g氯化銨溶于143 mL氨水;另取0.789 g硫酸鎂和1.179 g EDTA溶于50 mL水,加入2 mL配好的氯化銨、氨水溶液和0.2 g左右鉻黑T指示劑干粉.此時溶液應呈紫紅色,如出現天藍色,應再加入極少量硫酸鎂使之變為紫紅色.之后,逐滴加入EDTA溶液,直至使溶液由紫紅轉變為天藍色為止(切勿過量).將2種溶液合并,加蒸餾水定容至250 mL.
配制EDTA溶液:將1份EDTA在80℃干燥2 h,放入干燥器中冷卻至室溫;從中稱取3.725 g溶于1 000 mL水,放在聚乙烯瓶中,定期校對其濃度.
配制鈣標準溶液(10 mmol/L):將1份碳酸鈣在150℃干燥2 h,取出后放在干燥器中冷卻至室溫,從中稱取1.001 g置于500 mL錐形瓶中,用水潤濕.逐滴加入4 mol/L鹽酸至碳酸鈣全部溶解,避免滴入過量酸.加入200 mL水,煮沸數分鐘除去二氧化碳,冷卻至室溫;加入數滴甲基紅指示劑溶液(0.1 g溶于100 mL質量分數為60%的乙醇),逐滴加入3 mol/L的氨水至溶液變為橙色.在容量瓶中定容至1 000 mL.此溶液1.00 mL中含0.400 8 mg鈣.
配制鉻黑T指示劑:將0.25 g鉻黑T與50 g氯化鈉充分混合,研磨后過篩,放在棕色瓶中,蓋上塞子.配制鈣羧酸指示劑干粉:將0.1 g羧酸鈣與50 g氯化鈉充分混合,研磨后過篩,裝在棕色瓶中,蓋上塞子.
1.3 EDTA溶液的標定
用移液管吸取20.00 mL濃度為0.010 0 mol/L的鈣標準溶液置于250 mL的錐形瓶中,加入4 mL緩沖溶液,pH值=10;加入3滴鉻黑T指示劑,用EDTA標準溶液滴定,直至溶液由酒紅色剛變為純藍色,記錄消耗EDTA溶液的體積.EDTA溶液濃度的計算公式如下:
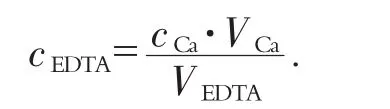
其中,EDTA濃度的單位為mol/L.
1.4 水樣的測定方法
采用標準(GB7477—87)EDTA滴定法測定水體中鈣和鎂的總量,采用(GB7476—87)EDTA滴定法進行鈣的測定[5-6].水的各種硬度計算公式如下:
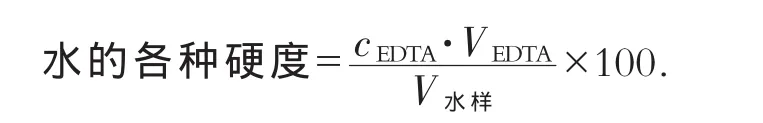
其中,水硬度的單位為mg/L.
1.4.1 鈣硬度的測定
用移液管吸取100 mL試樣置于250 mL錐形瓶中,加入2 mL質量濃度為2 mol/L的氫氧化鈉溶液和約0.2 g的羧酸鈣指示劑干粉,溶液混合后立即滴定.開始滴定時速度宜稍快,接近終止時應稍慢,最好每滴間隔2~3 s的時間,并充分振搖,至溶液由紫紅色變為亮藍色,即可終止,整個滴定過程應在5 min內完成.記錄消耗EDTA溶液的體積.
1.4.2 鈣、鎂總硬度的測定
用移液管吸取100 mL試樣置于250 mL錐形瓶中,加入4 mL緩沖溶液和3滴鉻黑T指示劑,此時溶液應呈紫紅或紫色,其pH值應為10.0士0.1.為防止產生沉淀,應立即在不斷振搖的情況下,自滴定管加入EDTA溶液.開始滴定時速度宜稍快,接近終止時應稍慢,并充分振搖,最好每滴間隔2~3 s的時間,溶液的顏色由紫紅或紫色逐漸轉為藍色.整個滴定過程應在5 min內完成.記錄消耗EDTA溶液的體積.
1.4.3 永久硬度的測定
準確移取100 mL待測樣,將其煮沸后過濾得到的濾液,置于250 mL錐形瓶內,加入4 mL緩沖溶液,控制pH值=10;加入3滴鉻黑T指示劑,用EDTA溶液滴定至水樣由酒紅色剛剛變為純藍色.記錄消耗EDTA溶液的體積.
1.4.4 暫時硬度的測定
總硬度值減去永久硬度值,即為暫時硬度值.
2 結果與討論
2.1 EDTA溶液濃度的標定
EDTA溶液濃度的標定結果見表1.

表1 EDTA溶液濃度的標定結果
表1結果表明,平行測定3次所得結果的相對平均偏差低,說明測定結果的精密度較高,該測定方法和測定過程的可信度均較高.
2.2 水樣硬度的測定
各種水樣硬度的測定結果如表2所示.
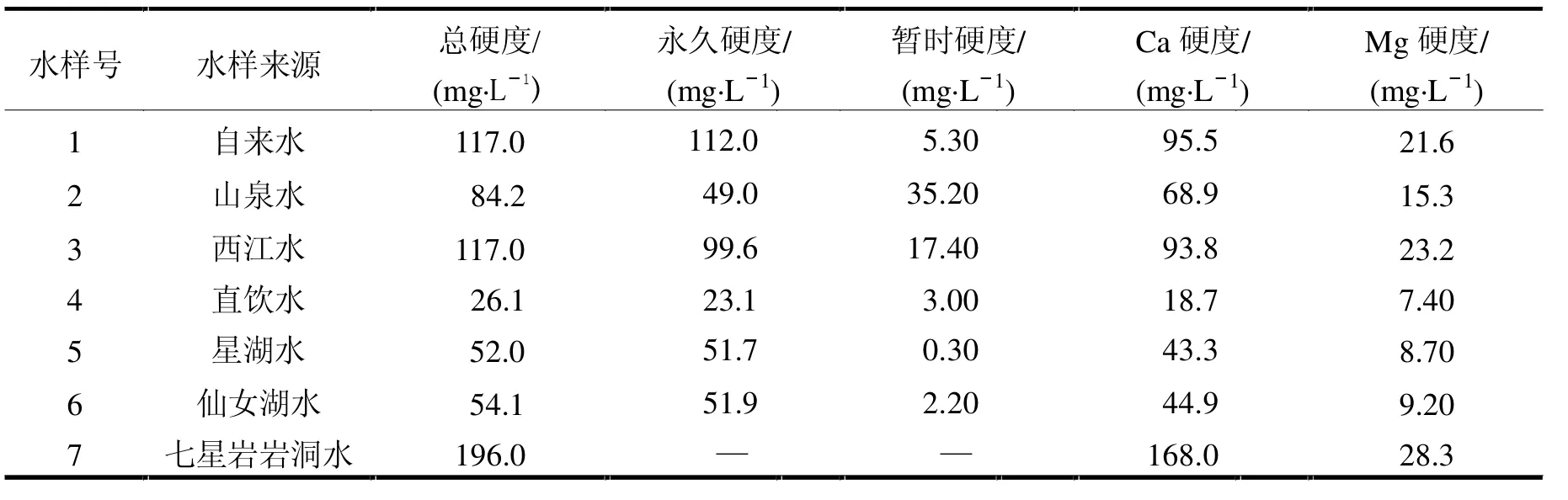
表2 各種水樣的硬度測定結果
由表2中發現,自來水、山泉水、西江水的總硬度在60~120 mg/L范圍內,按照世界衛生組織在《飲用水水質準則》中的分類,它們屬于中等硬度水.自來水、山泉水、西江水的鈣硬度在75~200 mg/L范圍內,自來水和西江水的鎂硬度在30~150 mg/L的下限左右,即30 mg/L左右,這些水源都符合世界衛生組織規定的最適宜飲用水的標準.直飲水、星湖水、仙女湖水的總硬度在0~60 mg/L范圍內,屬于軟水,鈣硬度和鎂硬度的含量均遠低于世界衛生組織規定的最適宜飲用水的標準.西江水與自來水的總硬度、鈣硬度和鎂硬度含量相當,因為自來水的水源來源于西江水,表明經自來水水廠處理后水硬度的變化微小.星湖水和仙女湖水的總硬度和其他硬度指標值接近,這是由于它們原屬于同一相連的地表水體.山泉水的暫時硬度最大,為35.2 mg/L,約占其總硬度的42%.這是由于山泉水水源多在山上或山坡下,泉水中的碳酸氫根離子含量豐富,含可分解的碳酸氫鹽較多.七星巖巖洞內水樣總硬度大于180 mg/L,屬于高硬度水.直飲水的硬度最低,為26.1 mg/L,遠低于60 mg/L.長期飲用這種礦物質含量低的直飲水,會對人體健康產生不利影響.
3 結論
采用EDTA滴定法測定肇慶部分水源中鈣、鎂離子的含量,并比較其水樣硬度.經過分析得出,按照世界衛生組織在《飲用水水質準則》中的分類:自來水、山泉水、西江水屬于中等硬度水,鈣硬度和鎂硬度的含量都接近世界衛生組織規定的最適宜飲用水的標準;巖洞內的水樣為高硬度水;直飲水、星湖水、仙女湖水屬于軟水.直飲水的硬度過低,應當引起制水單位和消費者的注意.
[1] 世界衛生組織.飲用水水質準則[S].3版.日內瓦:世界衛生組織,2004.
[2] 王瑞姝,蘇國臣.飲用水的無機成分與居民健康[J].國外醫學衛生學分冊,2002,29(1):9-11.
[3] 國家標準化管理委員會和衛生部.GB5749—2006生活飲用水衛生標準[S].北京:中國標準出版社,2006.
[4] 潘瑞華,李有堅,高端良.肇慶市區域生活飲用水總硬度的調查[J].國際醫藥衛生導報,2005(7):122.
[5] 國家環保總局.GB7477—87水質鈣和鎂總量的測定EDTA滴定法[S].北京:中國標準出版社,1986.
[6] 國家環保總局.GB7476—87水質鈣的測定EDTA滴定法[S].北京:中國標準出版社,1987.

