原發上皮性卵巢癌46例預后分析
劉建琴 胡素英 沈亞杰
近年來卵巢癌發病率逐年上升,由于卵巢位于盆腔深部,發病隱匿,早期癥狀無特異性,易被忽視,患者就診時大多是晚期,故手術滿意切除率低。同時相對于其他婦科腫瘤,卵巢癌病理類型復雜,惡性程度高,遠處轉移早,復發率高,生存率低。5年生存率仍在30%左右。我們對2003年1月至2009年12月收治的經手術病理確診的原發上皮性卵巢癌46例患者的臨床資料進行回顧性分析,以探討影響卵巢癌預后的因素。
1 資料和方法
1.1 臨床資料
選擇2003年1月至2009年12月在我院初次手術并經病理檢查確診為原發上皮性卵巢癌且術前CA125水平均高于35 U/L者46例,年齡29~73歲,平均54.9歲。組織類型:漿液性囊腺癌43例,透明細胞癌2例,混合性上皮癌1例。絕經患者31例。術前接受新輔助化療患者5例。
1.2 治療方法
所有病例均接受手術治療,基本術式:子宮全切除術+雙側附件切除術、大網膜切除術、闌尾切除術、盆腹腔轉移灶切除術、部分早期患者行盆腔淋巴結切除術。滿意腫瘤減滅術以殘留灶直徑小于2 cm為準。術前估計治療難以滿意減瘤術先行1~3次輔助化療后再手術。術后7~21天常規開始以鉑類為主的聯合化療,初次化療療程為6~8次,間隔3~4周。手術分期參照FIGO分期(2000年)。
1.3 血清CA125檢測
采用放射免疫法測定,正常值0~35 U/L,每位患者分別于術前、每次化療前采集靜脈血,初次化療療程結束后按隨診要求檢測。
1.4 隨診
采用門診定期復診或電話訪問方式確定生存期,隨診開始時間為手術日期確診時間,隨訪截止到2010年12月。總生存時間自確診時間至死亡或隨訪截至時間止。
1.5 統計學方法
利用SPSS17.0統計軟件進行統計學處理和分析,計量數據行t檢驗,累積生存率計算采用Kaplan-Meier法,生存率差異的比較采用Log-rank法,用Cox比例風險模型進行多因素分析。
2 結果
2.1 生存情況
手術病理分期Ⅰ期9例,占17.4 %,Ⅱ~Ⅳ期37例,占80.4%;術后接受2~5個療程化療28例,占60.9%,接受6~8個療程化療18例,占39.1%。
隨訪時間4~89個月,平均27.2個月。46例患者死于卵巢癌25例,中位生存時間19個月,1年生存率76.6%,3年生存率22.2%,5年生存率13.1%。
2.2 單因素分析結果
2次化療后CA125水平、術后殘留灶、手術病理分期是影響卵巢癌的預后因素,見表1。 2次化療后CA125下降至正常組31例,復發19例,無進展生存期16.3個月; CA125異常者(包括CA125值未下降至正常者,或反而上升者)15例,復發14例,無進展生存期7.8個月,2組無進展生存期比較有統計學意義(P<0.005,t=3.369)。滿意減瘤術組32例,復發21例,無進展生存期17.0個月;不滿意減瘤術組14例,復發13例,無進展生存期5.5個月,2組無進展生存期比較有統計學意義(P<0.001,t=3.922)。病例分期Ⅰ~Ⅱ組15例,復發5例,無進展生存期23.4個月;分期Ⅱ~Ⅳ組 31例,復發29例,無進展生存期11.0個月,兩組無進展生存期比較有統計學意義(P<0.01,t=2.745)。
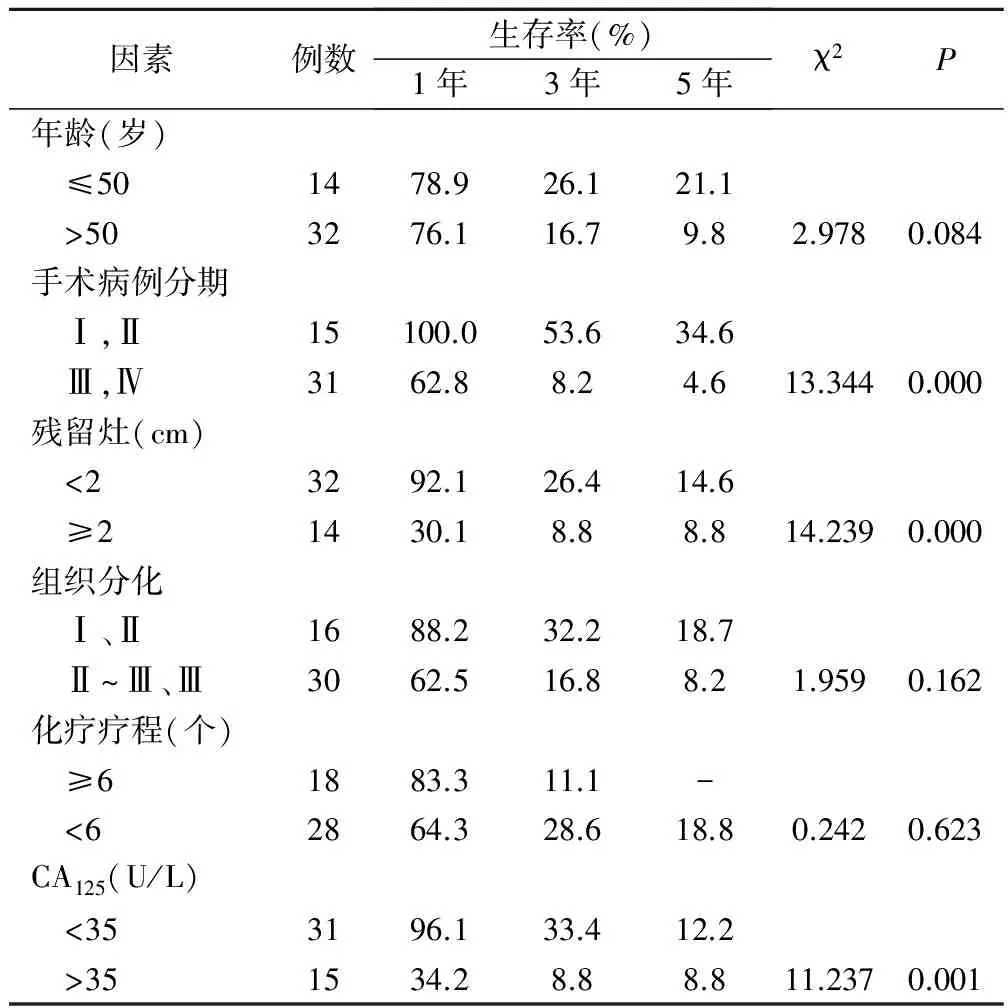
表1 46例上皮性卵巢癌患者生存資料單因素分析
2.3 多因素分析結果
用Cox比例風險模型進行分析,在0.05的檢驗水準上結果顯示手術病理分期(Wald χ2=11.946,P=0.01)、殘留灶大小(Wald χ2=4.479,P=0.034)、2次化療后CA125是否下降至正常(Wald χ2=4.534,P=0.033)是影響預后的獨立因素。
3 討論
3.1 術后化療中CA125水平變化與卵巢癌預后關系
CA125是比較公認的原發上皮性卵巢癌診斷以及判斷化療療效的檢測指標,CA125水平與腫瘤體積大小有關,CA125含量的減少與腫瘤數量的減少基本一致,這與臨床上腫瘤減瘤術后CA125與術前比較均有不同程度下降是相一致的。Redman等[1]報道Ⅱ~Ⅳ期卵巢癌患者化療2個療程后CA125下降至正常的患者,可獲得完全緩解和較長中位生存時間,其術后1年生存率為93%,而異常者1年生存率為85%,因此治療期間血清CA125水平可以反映患者體內殘留腫瘤情況。本組資料研究化療2個療程后CA125指標下降至正常的患者31例,無進展生存期16.3個月,中位生存時間 28個月,1年生存率96.1%,3年生存率33.4%,5年生存率12.2%;CA125異常組患者無進展生存期7.8個月,中位生存時間8個月,1年生存率34.2%,3年生存率8.8%,5年生存率8.8%,比較兩者間無進展生存期以及生存率,差異均有統計學意義。藍春燕等[2]經多因素分析發現3個療程化療后CA125下降至正常與否是影響卵巢癌患者預后的獨立因素,周慧梅等[3]研究發現2個療程化療后CA125下降幅度大,則手術和化療的效果較為滿意,復發時間相對較長,從而生存時間相應延長。Van等[4]研究也提示相同的結果,因此分析對于2~3個療程化療后CA125下降至正常者,提示殘留腫瘤細胞對化療藥物敏感性高,療效好,此類患者有較長無進展生存期,生存率高,反之,CA125異常的患者則對化療藥物敏感性低,療效差,無進展生存期短,生存率低。由此對于2~3個療程化療后CA125仍未下降至正常者是應該繼續原方案還是改變其他化療方案,值得進一步探討。因此治療期間定期檢測CA125水平,尤其觀察2~3個療程化療后血清CA125的變化對晚期卵巢癌患者預后做出及時、正確的判斷,進而改變治療策略,改善其預后有重大意義。
3.2 術后殘留灶大小對卵巢癌預后影響
本組資料顯示殘留灶的大小也是影響預后因素之一,術后殘留灶<2 cm者生存率明顯高于殘留灶≥2 cm者,尤其1年生存率差異顯著,提示手術治療徹底性的重要[5],理論上分析大塊切除腫瘤能明顯改善患者一般情況,增強患者對化療的耐受性。由于腫瘤體積大,大量細胞進入靜止期,以及腫瘤局部血供不足,化療藥物無法進入腫瘤細胞而起作用,因此切除大塊腫瘤可以改善腫瘤血供,促使殘留少量腫瘤細胞進入增殖周期,增強腫瘤對化療的敏感性;另外大塊腫瘤切除能增強患者免疫力,進而提高機體抗腫瘤能力。晚期卵巢癌多伴廣泛盆腹腔轉移,甚至遠處轉移,手術難度大,因此能否行滿意腫瘤減滅術對改善患者預后有重要意義。對于估計初次手術無法達到滿意減滅術者,術前可以新輔助化療1~3個療程,待腫瘤縮小或腹水有所減少后再手術。本組資料滿意減瘤術的患者3、5年生存率較文獻報道低,經隨訪發現患者多于術后1~2年復發,復發后患者多放棄繼續治療,因此卵巢癌患者對長期治療依從性也是影響預后的重要因素。
3.3 卵巢癌分期與預后的關系
本組資料單因素與多因素分析均提示早期卵巢癌患者生存預后明顯好于晚期患者,有文獻報道臨床分期在許多研究中被認為是對卵巢癌極有意義的預后因素之一[6],可見早期發現,早期診斷,早期處理是延長卵巢癌患者生存時間的重要方法。
總之,我們認為期別、腫瘤減滅術滿意與否、術后輔助化療2~3個療程后CA125是否降至正常值是原發卵巢癌獨立預后因素。卵巢癌是1種慢性疾病,需要重視患者長期治療與隨訪。本組資料分析結果提示年齡、病理分級、化療療程與卵巢癌生存預后無統計學相關性,與其他文獻報道存在差異[7,8],原因可能是與臨床資料分組、病例數、選擇病例、治療方法的差異有關。
[1] Redman CW,Blackedge GR,Kelly K,et al.Early serum CA125response and outcome in epithelial ovarian cancer 〔J〕.Eur Cancer,1990,26(5):593.
[2] 藍春燕,黃 鶴,劉繼紅.晚期卵巢上皮性癌患者初次治療過程中血清CA125水平變化與其預后的關系〔J〕.中華婦產科雜志,2008,43(10):732.
[3] 周慧梅,黃慧芳,潘凌亞,等.血清CA125值的變化對判斷上皮性卵巢癌療效及預后的臨床研究〔J〕.中國實用婦科與產科雜志,2008,24(3):204.
[4] Van Dalen A,Favier J,Baumgartner L,et al.Serum levels of CA125and TPS during treatment of ovarian cancer 〔J〕.Anticancer Res,2000,20(6D):5107.
[5] 連利娟主編.林巧稚婦科腫瘤學〔M〕.第4版.北京:人民衛生出版社,2006:551~567.
[6] Clark TG,Stewart ME,Altman DG,et al.A prognostic model for ovarian cancer 〔J〕.Br J Cancer,2001,85(7):944.
[7] 郗名榮,張 淑,楊小蕓,等.10年間卵巢上皮癌的治療與預后〔J〕.華西醫學,2002,17(3):312.
[8] Brun JL,Feyler A ,Chene G,et al.Long term results and prognostic factors in patients with epithelial ovarian cancer 〔J〕.Gynecol Oncol,2000,78(1):21.

