楠竹水預水解半纖維素溶出動力學的研究
譚麗紅 馬樂凡 劉定軍 劉繼權 曾 凱 梁宇婷
(1.長沙理工大學化學與生物工程學院,湖南長沙,410114;2.會同寶慶恒達紙業有限公司,湖南懷化,418300)
預水解可以選擇性去除生物質中的半纖維素,一般在160~180℃采用水預水解[1],或者在 120~140℃采用0.3% ~0.5%的稀硫酸水解,或者在40℃采用20% ~30%鹽酸水解[2]。水預水解過程中聚木糖主鏈上的乙酰基脫落,生成羧基,為糖苷鍵的進一步水解提供條件,水預水解最終的pH值在3~4之間。水預水解作為擠壓法水解和蒸汽爆炸法水解工藝的基礎,無論是作為單獨的工藝還是與其他工藝聯合起來利用木材原料生產生物發酵劑、液體燃料、動物飼料等,都是目前熱門的研究課題,而半纖維素在水解過程中的溶出和降解反應的動力學一直是該類研究的焦點。動力學特性的研究和動力學模型的建立,不僅可以驗證預水解過程中半纖維素的溶出機制,更重要的是,適合該過程的動力學模型可以準確預測該過程的反應時間、反應溫度下,水解原料中半纖維素的含量,這對于認識反應機理也具有一定的借鑒意義。
在建立動力學模型的過程中,不同的研究者,即使利用同一原料,其動力學模型的假設也不同[3]。如果預水解的原料種類不同,其差異會更大,因此,有必要對具體的生物質原料和具體的工藝進行專門的動力學研究。對湖南楠竹水預水解研究的目的是為了最大限度地去除楠竹中的半纖維素,水預水解后的竹片通過硫酸鹽法蒸煮來進一步脫除木素,以制取楠竹水預水解硫酸鹽漿。基于上述經驗模型,對楠竹水預水解半纖維素溶出進行動力學研究,得出140~170℃下楠竹半纖維素的動力學參數及相應的動力學方程式,同時分析楠竹水預水解的特點,為實際生產提供理論依據。
1 實驗
1.1 原料
楠竹由湖南會同縣寶慶恒達紙業有限公司提供,已切成長45 mm、寬20 mm的竹片,風干后密封貯存備用。
1.2 實驗方法
(1)原料分析 將300 g原料洗滌后干燥、粉碎,取40~60目的顆粒,平衡水分后分析原料的成分。
(2)動力學實驗 利用ZQS1-15型電熱回轉式蒸煮鍋進行水預水解,每罐加入100 g絕干原料,做2個平行樣。楠竹水預水解動力學研究的實驗條件見表1。

表1 楠竹水預水解動力學研究的實驗條件
在相應的保溫時間內取出樣品,立即在冷水中冷卻5 min,倒出試樣,洗凈后自然風干,經植物粉碎機粉碎,過40~60目的標準篩,貯存于密封塑料袋中,平衡水分,測定竹片中殘余聚戊糖的含量。
1.3 檢測方法
楠竹原料成分分析、水預水解后竹片殘余聚戊糖含量等均按國家相關標準方法進行測定[4]。
2 模型的構建
關于半纖維素在間歇蒸煮器中水解的模型,研究者做了大量工作,提出了各種模型,其中雙向模型已被用于模擬樺木、楊木、楓樹、白楊、甘蔗渣、玉米稈、柳枝、蘆葦等生物質的水解過程[5]。由于半纖維素成分復雜,要選擇一種能精確模擬各種原料半纖維素的模化物幾乎不可能。從實驗可知,半纖維素水解產物中主要成分是木糖[6],故本實驗采用聚木糖作為半纖維素的模化物,雙向模型可以被描述為:
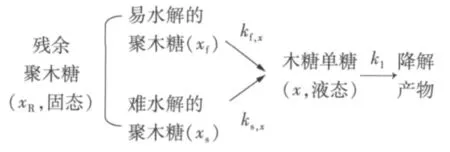
雙向模型指出,在木質纖維類生物之中,快反應和慢反應是同時發生的,并且在較低溫度下,快反應和慢反應的聚木糖是2個平行的一級反應,故本實驗采取如下模型:
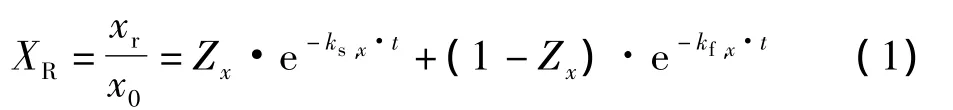
式中,Zx為慢反應的聚戊糖與原料中聚戊糖含量的比值;x0為原料中聚戊糖的含量;xr為殘余在固體物料中的聚戊糖含量;xf為殘余在固體物料中快反應的聚戊糖含量;xs為殘余在固體物料中慢反應的聚戊糖含量;kf,x,ks,x分別為快反應和慢反應的速率常數;XR為殘余在固體物料中的聚戊糖含量與原料中聚戊糖含量的比值。
3 結果與討論
3.1 楠竹的主要化學成分
楠竹原料的主要化學成分如表2所示。

表2 楠竹原料的主要化學成分 %
3.2 水預水解動力學實驗結果
水預水解過程中,水解溫度和保溫時間是影響水預水解的主要因素。控制水預水解的升溫時間不超過20 min,在水解溫度分別為140、150、160、170℃的條件下,通過研究水預水解后竹片聚戊糖含量的變化,表征楠竹半纖維素的溶出規律。表3為不同水解溫度下,楠竹水預水解后竹片的聚戊糖含量。

表3 水預水解后竹片的聚戊糖含量
以竹片殘余聚戊糖的含量與原料中聚戊糖含量的比值XR來表征水預水解過程中半纖維素的溶出程度(見圖1)。從圖1可以看出,水解溫度對聚戊糖的水解溶出影響很大;在140℃時,保溫300 min時還有74.60%的聚戊糖殘留在竹片中未被水解;而當水解溫度達到170℃時,大量半纖維素在較短時間內水解溶出,表現為殘余聚戊糖比例急劇減少,在150 min內溶出量已經超過70%。因此,在生產竹漿粕過程中,采用高溫、短時間保溫預水解工藝比較合適。
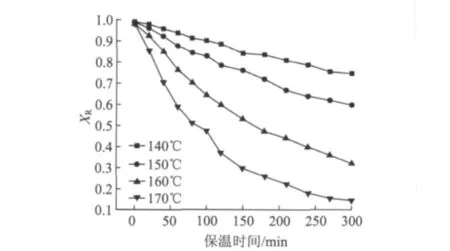
圖1 XR與水解溫度和保溫時間的關系
3.2.1 反應速率常數的確定
將圖1中XR代入式(1),利用Matlab中曲線擬合工具箱對其進行非線性高級擬合,得到水預水解中聚戊糖溶出的反應速率常數 kf,x和 ks,x,同時求出 Zx,其中,R為擬合的相關系數,結果見圖2和表4。
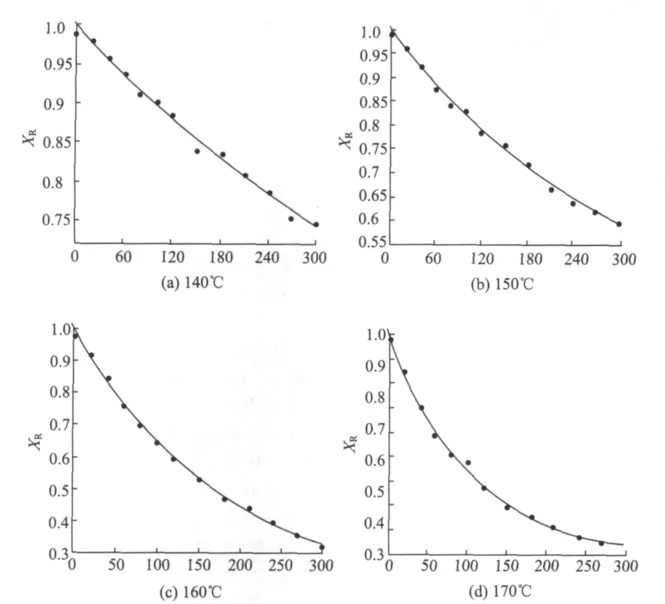
圖2 不同水解溫度下XR與保溫時間的關系
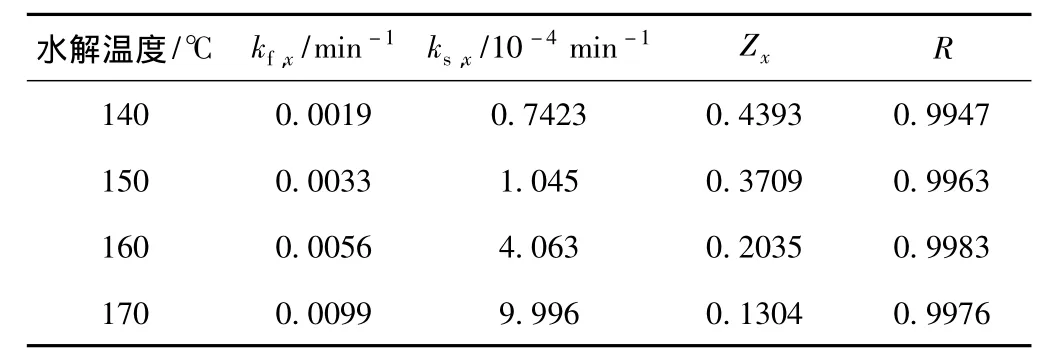
表4 水預水解聚戊糖溶出的動力學參數及擬合結果
表4數據表明,隨溫度升高,Zx隨之下降,同時,kf,x和 ks,x都有一定程度的增大,且 ks,x增大更明顯,但是兩者之間并沒有明確的關系,這可能與原料結構和擴散速率有關。H.Anthony等人[7]對南方紅橡樹進行了類似研究,發現當水解溫度升至236.9℃時,可去除很少一部分不反應的聚木糖,水預水解可以被模擬成單個反應,而部分不反應的聚木糖與木素和纖維素有著化學鍵連接。因此,Zx并不是指原料中存在不同結構類型的聚木糖,它與水解液的滲透、水解產物的及時溶出及碳水化合物有密切關系。
另外,原料和水解條件的不同也會使Zx有很大差異。楠竹在140~170℃、液比1∶10的條件下,Zx分別為 0.44 ~ 0.13;南方紅橡樹為 0.26 ~ 0.03(171.1 ~ 236.9℃,原料被水充分浸潤)[7];而柳葉桉在170℃時,分別將液比由1∶3.5減少至1∶2,發現 Zx由 0.35 增至 0.41[8]。這表明當預水解液比較大時,Zx主要受原料結構和水解溫度的影響;當液比較小時,Zx的大小主要取決于水解液和水解產物的擴散速率。
3.2.2 活化能的確定
根據阿倫尼烏斯方程
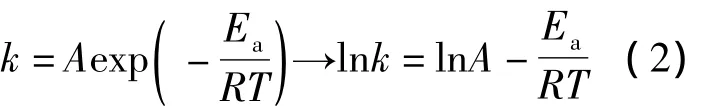
式中,A為指前因子;Ea為反應活化能,kJ/mol;R為氣體常數,標準狀態下為 8.314 kJ/(mol·K);T 為反應溫度,K。
分別對 kf,x、ks,x和1/T進行線性擬合,結果如圖3所示。由圖3可知,反應活化能為該線的斜率,由此可以得出,快反應活化能 Ef為83.29 kJ/mol,慢反應活化能 Es為 138.79 kJ/mol。
圖3表明,對楠竹水預水解而言,在140~170℃下,擬合直線斜率相差較大,即Ef和Es存在明顯差異。根據相關文獻指出,木質生物質水解的活化能主要在53 ~142 kJ/mol之間[7]。歐洲紅櫸木的Ef和 Es分別為 127.2 kJ/mol和 135.7 kJ/mol[9];柳葉桉的分別為 125.0 kJ/mol和 103.9 kJ/mol[8];美國紅橡樹的 Ef為126 kJ/mol[10]。可見,楠竹的 Ef和 Es在生物質水解活化能范圍內,與木材原料相比,楠竹的Ef相對較低,而Es卻較高,從而易水解的聚戊糖在較低溫度下便開始降解溶出,而難以反應的聚戊糖即使在較高溫度下也溶出緩慢。由于慢反應決定整個預水解的進程,所以在保證纖維素不發生大量降解以及木素縮合反應較少的情況下,提高溫度是加快水解程度最有效的方法。
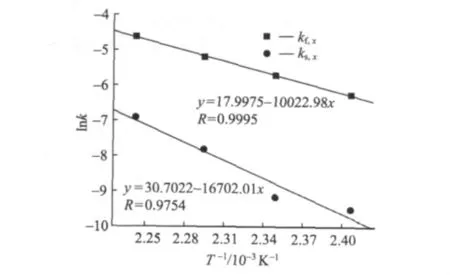
圖3 lnk與1/T的擬合曲線
因此,將擬合后所得動力學參數代入阿倫尼烏斯方程中,可得到140~170℃內相應的反應速率方程:
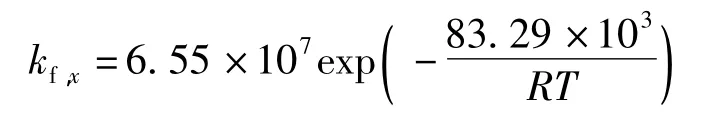
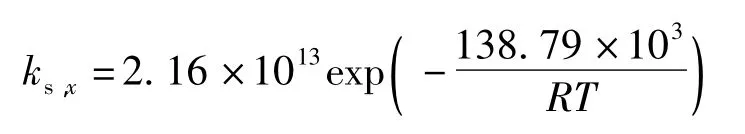
4 結論
4.1 楠竹水預水解半纖維素溶出動力學規律在140~170℃下遵循雙向反應模型,水解溫度是影響水解程度的主要因素。
4.2 在水預水解溫度為140、150、160、170℃時,快反應速率常數 kf,x分別為 0.0019、0.0033、0.0056、0.0099 min-1;慢反應速率常數 ks,x分別為 0.00007423、0.0001045、0.0004063、0.00099959 min-1。
4.3 根據阿倫尼烏斯方程得到了楠竹水預水解在140~170℃范圍內快反應和慢反應的活化能分別為83.29 kJ/mol和 138.79 kJ/mol,并得出了相應的反應速率方程。
[1]Springer E L,Harris J F.Prehydrolysis of aspen wood with water and with dilute aqueous sulfuric acid[J].Svensk Papperstidning,1982:152.
[2]Springer E L,Zoch L L.Hydrolysis of xylan in different species of hardwoods[J].Tappi,1968,51(5):214.
[3]Garrote G,Domínguez H,Parajó J C.Kinetic modeling of corncob autohydrolysis[J].Process Biochemistry,2001,36(6):571.
[4]石淑蘭,何福望.制漿造紙分析與檢測[M].北京:中國輕工業出版社,2009:22.
[5]Veeraraghavan S,Chambers R P,Myles M,et al.Kinetic modeling and reactor development for hemicellulose hydrolysis[R].Orlando(FL):AIChE National Meeting,1982.
[6]Garrote G,Falque E,Domingue H.Auto-hydrolysis of Agriculture Residues:Study of Reaction Byproduct[J].Bioresource Technology,2007,98(10):1951.
[7]Anthony H,Conner L F.Kinetic modeling of hardwood pre-hydrolysis partⅢ-water and dilute acetic acid pre-hydrolysis of southern red oak[J].Wood and Fiber Science,1986,18(2):248.
[8]Sixta H.Handbook of Paper and Board[M].Weinheim:Wiley-VCH Verlag GmbH & Co.kGaA,2006:332.
[9]Sixta H.Water prehydrolysis of beech wood[R].Austria:Research and Development of Lenzing AG,2003.
[10]Rastall R A,Gibson G R.Prebiotic oligosaccharides evaluation of biological activities and potential future developments[M].England:Wymondham,2002:107.

