α1-腎上腺素受體在缺氧性肺動脈平滑肌細胞增殖中的作用*
姚香蘭, 薛全福, 趙琪平
(中國醫學科學院基礎醫學研究所,中國協和醫科大學基礎醫學院生理和病理生理學系,北京100005)
腎上腺素α1受體(α1adrenoceptor,α1AR)激動使肺小動脈收縮,β2受體(β2adrenoceptor,β2AR)激動則引起舒張,我室以往研究表明常壓慢性缺氧(10%O2)引起大鼠肺動脈高壓時肺小動脈α1AR 增多,β2AR 受體減少[1,2]。這種受體失衡參與缺氧性肺動脈高壓的發生和發展[3]。
已有實驗表明:兒茶酚胺對主動脈平滑肌細胞的增殖有促進作用。兒茶酚胺通過α1AR 刺激主動脈平滑肌細胞引起增殖,而β2AR 的激活則抑制其增殖。缺氧引起的肺動脈平滑肌細胞(pulmonary artery smooth muscle cells,PASMCs)增生、肥大與肺血管重構和肺動脈高壓形成有關。但在PASMCs 上,腎上腺素能受體在常氧和缺氧情況下是否也有類同作用,尚少報道。
本實驗選用離體培養的PASMCs,給予缺氧處理,用[3H]-TdR 摻入法觀察缺氧對PASMCs 增殖的作用;加用各種受體激動劑或拮抗劑,激活或抑制α1AR 及激活β2AR,觀察α1AR 和β2AR 在缺氧后PASMCs 增殖中的作用;又采用RNA 分子雜交(Northern blotting)的方法檢測缺氧后PASMCs c-fos、c-myc、α1AR 和β2AR mRNA 表達的變化,在分子水平探討缺氧引起PASMCs 增殖的機制。
Ca2+與血管平滑肌細胞增殖及血管收縮有關,又是腎上腺素能受體信息傳遞的重要第二信使。缺氧后大鼠PASMCs 胞內Ca2+增高已有報道[14],但其動態變化的報道少見。本實驗用Fura-2/AM 測定了不同缺氧時間(3-24 h)PASMCs 胞內Ca2+濃度(intracellular calcium concentration,[Ca2+]i)的動態變化,并分析其與c-fos、c-myc 基因表達和細胞增殖的關系,探討其在缺氧性肺動脈高壓發病學中的意義。
材 料 和 方 法
1 材料
大鼠c-fos cDNA 和人c-myc cDNA 均為中國醫學科學院腫瘤研究所遺傳室惠贈。632 bp α1AR cDNA 探針為美國University of Arkansas for Medical Sciences,Cornett 博士惠贈。人β2AR cDNA 探針為美國Duke University Medical Center,Kobilka 博士惠贈。雞GAPDH 質粒由中國疾病預防控制中心劉秉慈教授惠贈。缺口平移試劑盒購自華美公司,[α-32P]CTP 購自北京福瑞公司。Random Primer 標記試劑盒購自Promega。
2 方法
2.1 貼塊法培養PASMCs 及細胞的鑒定 無菌取新生牛肺外及肺內1-2 級肺動脈,于超凈工作臺內,用生理鹽水洗凈血跡,縱向剖開肺動脈分離中膜,于胎牛血清中剪碎成1 mm ×1 mm ×1 mm 大小組織塊,以貼塊法均勻鋪于培養瓶底部培養PASMCs,4 周后用0.05%胰酶消化液,使從組織塊中長出的細胞脫壁后均勻分布于瓶底,繼續培養至傳代。將培養的原代和傳至6 代的PASMCs 種至載玻片上,在10%FCS 加MEM 中培養72 h,以0. 01 mol/L PBS 洗玻片,4 ℃丙酮固定10 min,自然干燥。以稀釋的小鼠抗平滑肌細胞肌動蛋白抗體(α-actin)作為Ⅰ抗,進行免疫組化染色,以鑒定PASMCs。同時以同樣方法染色人乳腺血管和人結腸血管作陽性對照,用不加Ⅰ抗的樣品作陰性對照。
2.2 PASMCs 缺氧模型的建立和分組及DNA 合成的測定 培養的PASMCs 分為缺氧實驗組和常氧對照組,缺氧組細胞置于自制的有機玻璃小室(有進、出氣孔),將此小室置于37 ℃恒溫箱內,給缺氧小室內通入95%N2+5%CO2混合氣,3 L/min 共8 min,置換出小室內空氣,以0.5 L/min 繼續通入混合氣,5 h 后,血氣分析儀測定培養基中PO2達50 mmHg(為6.6%O2,相當于給整體動物10%O2處理時肺泡和血液中氧濃度)以0.4 L/min 持續通氣,血氣監測PO2,維持PO2≈50 mmHg。常氧組細胞置于5%CO2、95% 空氣培養箱內。
培養的PASMCs 傳至3-6 代時進行實驗,將培養瓶中細胞消化后計數,以1 ×104細胞種于96 孔培養板常規培養72 h,以無血清MEM 再培養72 h,將PASMCs 分為4 組:(1)無受體藥物干預組:為對照組,不加受體激動劑或拮抗劑;(2)α1AR 激活組:加α1AR 激動劑脫羥腎上腺素(10-6mol/L),再加育亨賓(10-6mol/L)拮抗α2AR、心得安(10-6mol/L)拮抗β1AR 及β2AR,最終僅α1AR 被激活。(3)α1AR 阻斷組:加腎上腺素(10-6mol/L)激活α 和βAR,再加派唑嗪(10-6mol/L)阻斷α1AR;(4)β2AR 激活組:加β2激動劑異丙腎上腺素(10-6mol/L),再加酚妥拉明(10-6mol/L)拮抗α1AR 及α2AR,氨酰心安(10-6mol/L)拮抗β1AR,最終僅β2AR 被激活。
缺氧實驗組和常氧對照組都包括這4 組,向每孔細胞中加入1 mCi/L(37 MBq/L)[3H]-TdR,缺氧12 h、24 h、36 h 后,以常規方法收集細胞,液閃計數,得到TdR 摻入DNA 的量,反映細胞增殖程度。
2.3 PASMCs 胞內鈣濃度的測定 培養的PASMCs分為缺氧實驗組和常氧對照組,缺氧實驗組細胞置于細胞缺氧箱中,按上述方法缺氧3 h、6 h、12 h、24 h。缺氧結束后,以HBSS 洗缺氧實驗組及常氧對照組細胞各3 次,加5 mL HBSS 于培養瓶中,用橡皮刮輕輕刮下貼壁生長的細胞,臺盼藍排斥試驗檢查細胞成活率達95%以上。按文獻[5]方法,以島津RF-5000 型熒光分光光度計測定細胞內鈣濃度。
2.4 PASMCs c-fos、c-myc 表達和α1AR mRNA、β2AR mRNA 的Northen blotting 分析 缺氧及常氧組細胞總RNA 的提取均按《Molecular Cloning》第2版方法[6]進行。本實驗提取的細胞總RNA 在260 nm 和280 nm 的紫外吸光度比值均大于1.8,總RNA電泳上樣量為20 μg。
采用大鼠c-fos cDNA(用EcoR I 酶從質粒切取8.8 kb 片段)和人c-myc cDNA(用EcoR I、HindⅢ雙酶從質粒切取8.5 kb 片段)作探針,進行c-fos 和c-myc Northen blotting 分析。細胞缺氧方法同前,觀察缺氧30 min、1 h、2 h、3 h、6 h、24 h 后PASMCs c-fos 和c-myc 表達的變化。又將缺氧細胞分2 組進行藥物干預:(1)α1AR 激活組,用藥同前述;(2)α1AR 阻斷組:用藥同前述。在藥物干預的同時進行30 min、1 h 缺氧,觀察α1AR 激活或阻斷時對PASMCs c-fos 和c-myc 表達的影響。
同上述方法提取細胞總RNA。采用大鼠α1AR cDNA(由EcoR I 酶切質粒后得到632 bp 片段)和人β2AR cDNA(質粒經EcoR I 酶切后得到2.0 kb 片段)作探針,進行PASMCs α1AR mRNA 及β2AR mRNA 的Northen blotting 分析,觀察缺氧6 h、12 h、24 h后的變化。以上實驗均同時以三磷酸甘油醛脫氫酶(GAPDH)cDNA 探針作為內對照。α1AR、β2AR 及GAPDH cDNA 用Random Primer 標記試劑盒進行核素標記([α-32P]CTP 的探針標記摻入率約60%,探針放射比活度達1010counts·min-1·g-1DNA)。
3 統計學處理
結 果
1 原代和第6 代PASMCs 細胞特征
原代及傳至第6 代的PASMCs 經α-actin 單抗進行免疫組化染色,陽性對照顯示:人結腸血管壁、肌層、黏膜肌層、腺體周圍肌上皮和乳腺血管平滑肌胞漿內呈彌漫強陽性,而組織間成纖維細胞、腺上皮和血管內皮均為陰性,說明α-actin 單抗是平滑肌型actin 特異的單抗。培養的PASMCs 表面均呈棕黃色actin 強陽性,與陽性對照人結腸血管中動脈平滑肌棕黃色染色一致,表明培養的PASMCs 均為血管平滑肌細胞,且傳至6 代時仍保持原來的細胞特征。
2 缺氧后PASMCs 增殖的變化及其與α1AR 和β2AR 的關系
缺氧12 h 的PASMCs,[3H]-TdR 摻入已有增高,但與對照組比無顯著差異。缺氧24 h 和36 h后,則顯著高于對照組(P <0.01)。而α1AR 被抑制的PASMCs,[3H]-TdR 摻入顯著低于單純缺氧組(均P <0.01)。β2AR 激活的PASMCs,[3H]-TdR摻入雖比單純缺氧組低,但無顯著差異,見表1。
3 缺氧后PASMCs 胞漿游離鈣濃度的變化
缺氧3 h,PASMCs 胞漿游離鈣濃度已開始升高,但與對照組比無顯著差異。缺氧6 h、12 h 及24 h,均顯著高于對照組(P <0.01),見圖1。
4 缺氧PASMCs 的c-fos 和c-myc 表達水平變化及其與α1AR、β2AR 的關系
缺氧與對照PASMCs 的c-fos 及c-myc Northen blotting 檢測結果顯示,缺氧30 min,c-fos 和c-myc表達升至高峰。缺氧1 h、2 h 及3 h、6 h 和24 h 時,c-fos 和c-myc 表達仍顯著高于對照,但比缺氧30 min 時的值低,見圖2、3A。
PASMCs 的α1AR 被激活時,缺氧30 min 和1 h后,c-fos 和c-myc mRNA 表達增高。α1AR 被阻斷時,缺氧30 min 和1 h 后,c-fos 和c-myc 表達明顯減少,見圖3B。
表1 缺氧不同時間后PASMCs[3H]-TdR 摻入DNA 合成的變化及α1AR 和β2AR 對其的影響Table 1. Changes of incorporation of [3H]- TdR in hypoxic PASMCs and the effect of α1AR and β2 AR on the incorporation(103counts/min. ±sE.n=12)
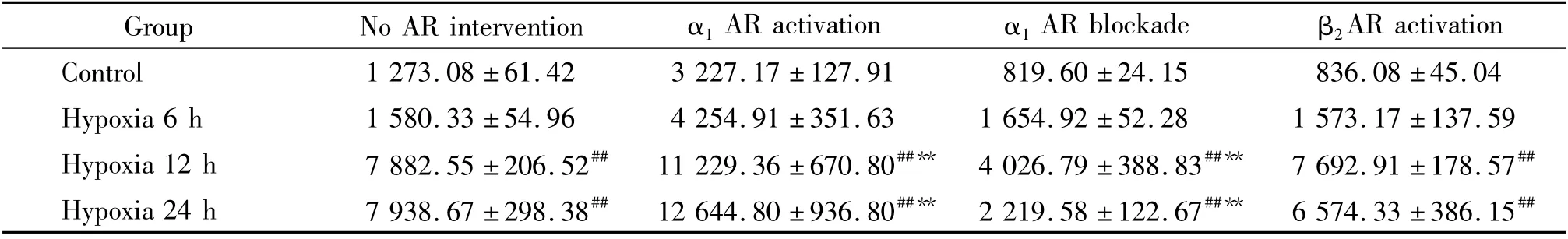
表1 缺氧不同時間后PASMCs[3H]-TdR 摻入DNA 合成的變化及α1AR 和β2AR 對其的影響Table 1. Changes of incorporation of [3H]- TdR in hypoxic PASMCs and the effect of α1AR and β2 AR on the incorporation(103counts/min. ±sE.n=12)
##P <0.01 vs control (normoxic PASMCs);**P <0.01 vs no AR intervation (hypoxic PASMCs).
Group No AR intervention α1 AR activation α1 AR blockade β2 AR activation Control 1 273.08 ±61.42 3 227.17 ±127.91 819.60 ±24.15 836.08 ±45.04 Hypoxia 6 h 1 580.33 ±54.96 4 254.91 ±351.63 1 654.92 ±52.28 1 573.17 ±137.59 Hypoxia 12 h 7 882.55 ±206.52## 11 229.36 ±670.80##** 4 026.79 ±388.83##** 7 692.91 ±178.57##Hypoxia 24 h 7 938.67 ±298.38## 12 644.80 ±936.80##** 2 219.58 ±122.67##** 6 574.33 ±386.15##
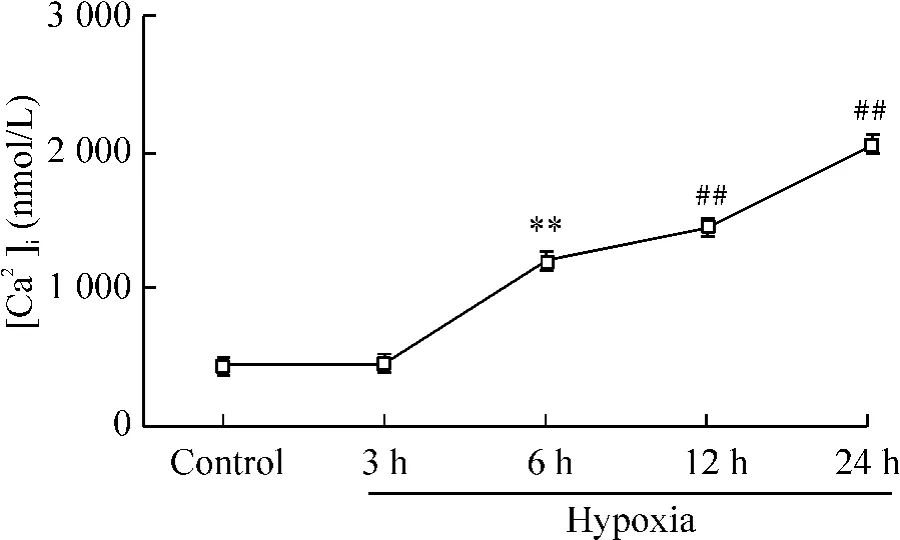
Figure 1. Change of[Ca2+]i in hypoxic PASMCs. ± sE. n =6. ##P <0.01 vs normoxic PASMCs(control);**P <0.01 vs 3 h hypoxic PAMSCs.圖1 缺氧不同時間后肺動脈平滑肌細胞[Ca2+]i的變化
5 缺氧PASMCs α1AR mRNA 和β2AR mRNA 水平變化
Northen blotting 的結果表明:缺氧6 h,PASMCs α1AR mRNA 水平與對照組比無明顯改變,缺氧12 和24 h 后,則顯著高于對照組。而PASMCs β2AR mRNA水平在缺氧6 h 和12 h 后,與對照組比無明顯差異,而在缺氧24 h 后,明顯高于對照組(均P <0.01),見圖4。
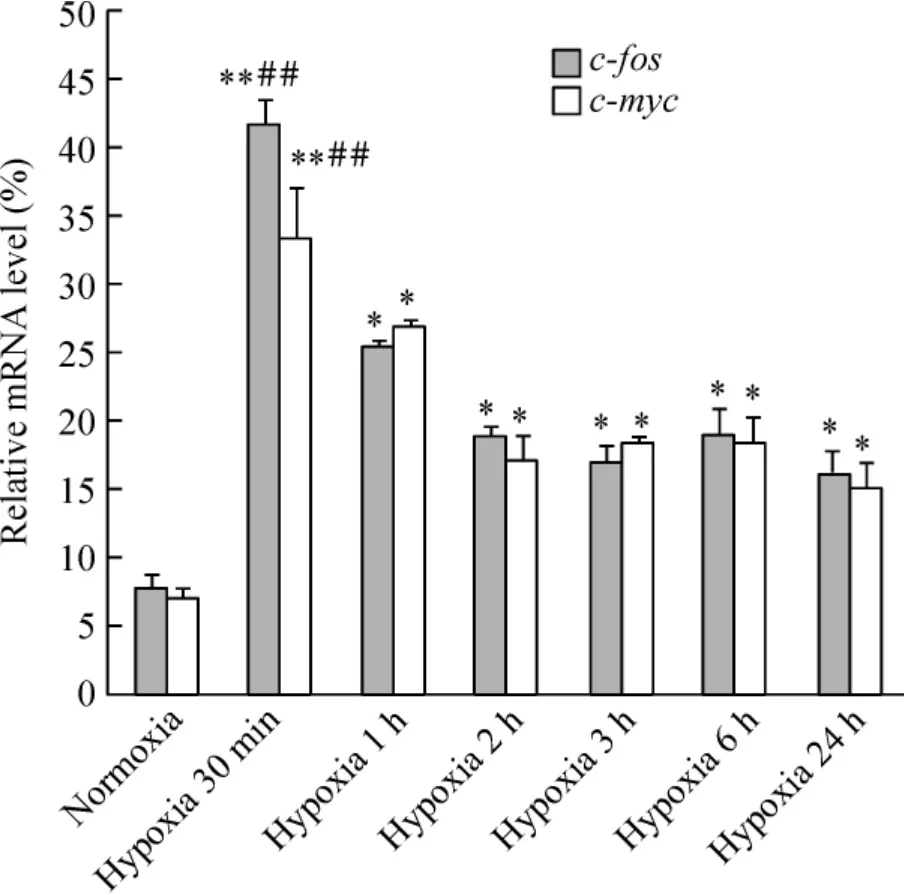
Figure 2. Scanning densitometry of Northern blotting for c-fos and c-myc mRNA in PASMCs. ±sE.n=3. * P <0.05,**P <0.01 vs normoxic PASMCs(control);##P <0.01 vs other hypoxic PASMCs.圖2 缺氧不同時間后肺動脈平滑肌細胞c-fos 及c-myc mRNA 的動態變化
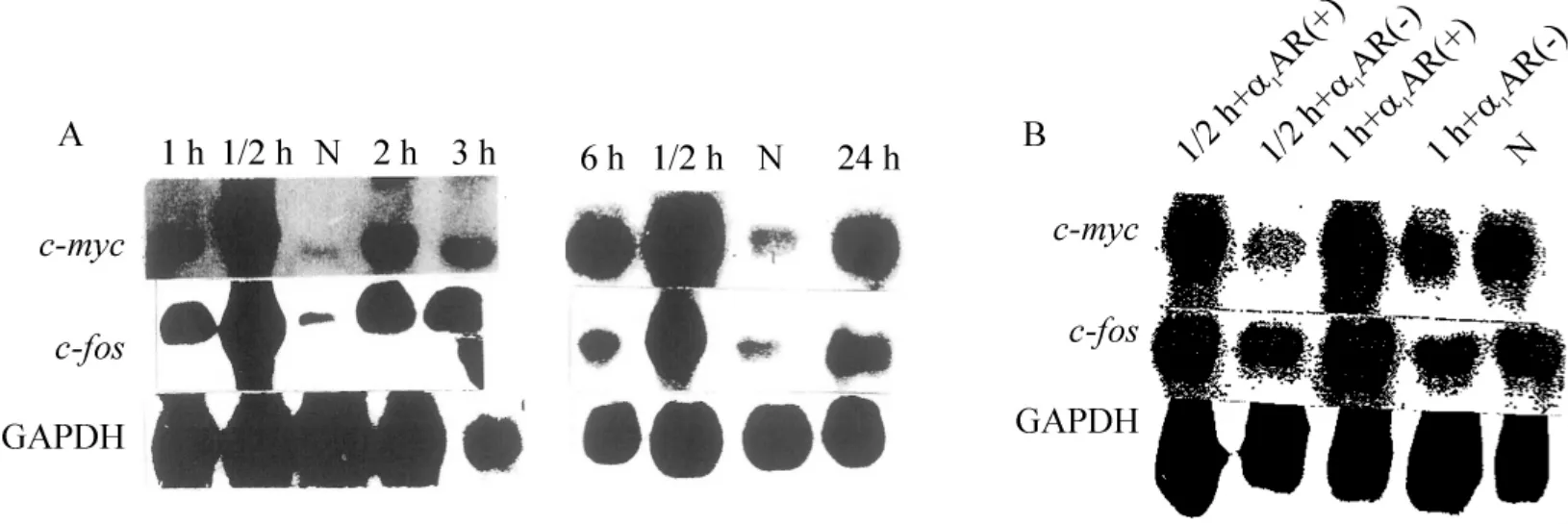
Figure 3. Changes of c-fos and c-myc mRNA after different hypoxic time in PASMCs(A)and the effect of α1AR(B).N:normoxia(control);AR(+):AR activation;AR(-):AR inhibition.圖3 Northern blotting 顯示缺氧不同時間后肺動脈平滑肌細胞c-fos 及c-myc mRNA 的變化及α1AR 對其的影響
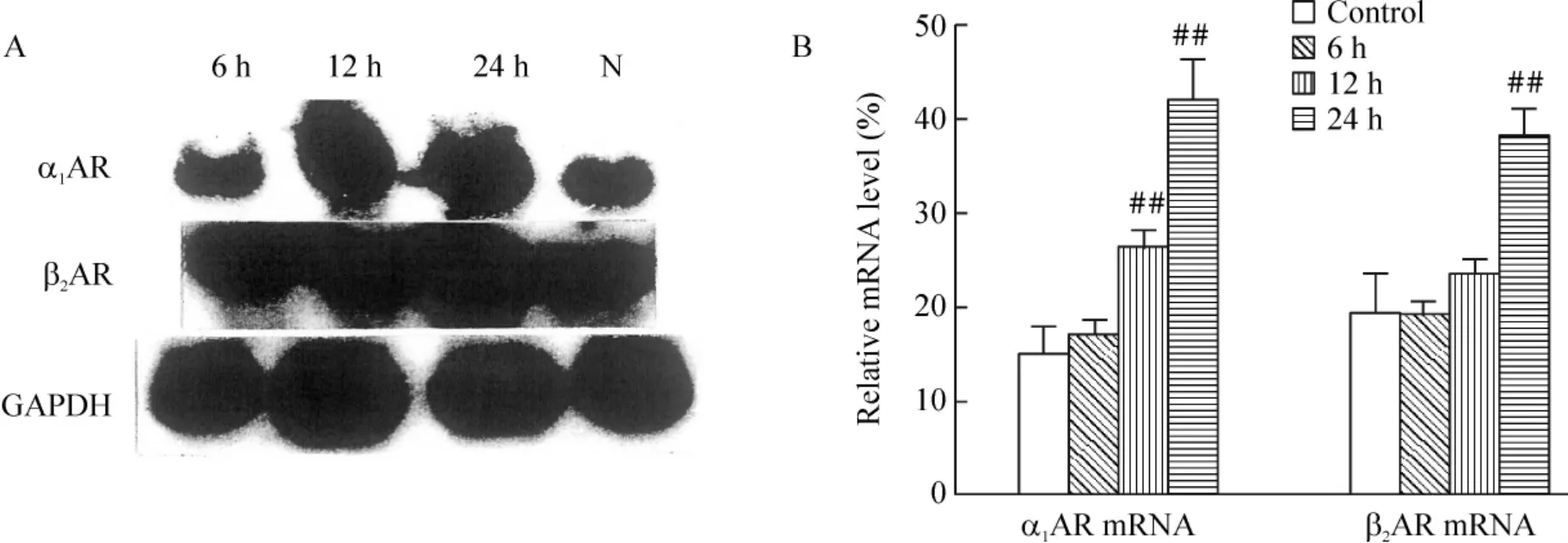
Figure 4. Expression of α1AR and β2AR mRNA in PASMCs exposed to hopoxia and normoxia.A:Northern blotting results;B:densitometry analysis. ±sE.n=3. ##P <0.01 vs control .N:normoxia(control).圖4 Northern blotting 顯示缺氧時PASMCs α1AR 及β2AR mRNA 的變化
討 論
1 缺氧后肺動脈平滑肌細胞增殖的變化及α1AR和β2AR 在其中的作用
體外實驗證明兒茶酚胺具有有絲分裂原樣作用,特異地作用于α1AR,從而刺激主動脈平滑肌細胞增殖。而β2AR 激活則抑制主動脈平滑肌細胞的這一增殖[7]。本實驗中[3H]-TdR 摻入結果表明,缺氧后PASMCs DNA 合成增加,有細胞增殖。α1AR被激活后,增殖更明顯,而α1AR 被阻斷時,缺氧引起的PASMCs 增殖明顯受抑制,與文獻中上述主動脈平滑肌細胞的結果相似。這說明缺氧也可通過α1AR 刺激PASMCs 增殖,參與缺氧肺動脈高壓的形成。PASMCs 上分布的αAR 雖然主要是α1AR。但也有少量α2AR。我室以往的研究表明大鼠缺氧性肺動脈高壓時,肺組織α1AR 增高的同時α2AR 也增高。本實驗發現α1AR 被抑制后,雖然α2AR 未被抑制,但缺氧后PASMCs 的DNA 合成仍明顯低于單純缺氧和常氧組。這提示即使α2AR 有促進PASMCs增殖的作用,也遠小于α1AR。此外β2AR 被激活時,缺氧所引起的PASMCs 增殖僅稍有降低,與對照相比無顯著變化,與主動脈的結果不完全相同,可見缺氧引起PASMCs 增殖主要是通過α1AR 實現的,β2AR 無明顯作用。常氧組實驗還表明,常氧情況下,α1AR 也有促進PASMCs 增殖的作用,β2AR 仍對增殖無明顯影響。
2 缺氧后PASMCs c-fos、c-myc、α1AR 和β2AR mRNA 表達的改變及其意義
c-fos 和c-myc 是細胞核內原癌基因,與細胞的增殖密切相關。有人已在培養的血管平滑肌細胞(VSMCs)中觀察到,VSMCs 增殖時,c-fos 和c-myc和c-myb 均處于激活狀態。而用c-myc 的反義寡聚核苷酸轉染VSMCs 后,能降低c-myc 的表達,VSMCs 增殖也明顯受到抑制[8]。本實驗觀察到缺氧30 min,PASMCs 的c-fos 和c-myc 表達達高峰,缺氧1 h 至24 h 時其表達均高于對照,與缺氧后PASMCs[3H]-TDR 摻入的變化是一致的。但缺氧后c-fos 和c-myc 的變化發生更早,說明c-fos 和c-myc 是早期生長反應性基因。c-myc 可能通過直接刺激PASMCs DNA 復制或在轉錄后水平調控促進PASMCs 增殖,而c-fos 只限于轉錄后水平調控。本實驗觀察到α1AR 激活時PASMCs 的c-fos 和c-myc 表達增加,而α1AR 抑制時,其表達減少,由此推斷在整體情況下,缺氧通過α1AR 引起c-fos 和c-myc 表達增加,導致肺動脈平滑肌層增厚使管腔狹窄,促進肺動脈高壓的形成。
缺氧后PASMCs 的α1AR mRNA 水平也明顯升高,進而PASMCs α1AR 合成也會增多。α1AR 的增多既可直接刺激PASMCs DNA 合成,又可能通過上述信號轉導通路,促進PASMCs 的增殖。
實驗中還檢測到β2AR mRNA 水平升高。如前所述,PASMCs 上主要有α1AR 和β2AR,但α1AR 是β2AR 的3 倍,即α1AR 總量遠多于β2AR。缺氧后PASMCs β2AR mRNA 水平雖增加,使β2AR 合成增多,但由于其總量遠少于α1AR,因此缺氧后PASMCs仍以α1AR 的增多為主,最終使PASMCs 增殖,肺血管發生重建。
3 缺氧后PASMCs 胞內Ca2+濃度的變化
已有表明細胞內游離Ca2+升高是VSMCs 增殖的最有效刺激。本實驗PASMCs 缺氧6 h 后胞內Ca2+濃度即明顯增高,而DNA 合成在缺氧后6 h 僅有輕度增加,缺氧12 h 后才有明顯增加,說明缺氧通過增加PASMCs 上α1AR,使PASMCs 胞內Ca2+增加,從而促進細胞增殖,12 h 后還可能通過其它信號轉導途徑加強細胞增殖。有人認為細胞內Ca2+升高還可能通過激活原癌基因(c-fos 和c-myc 等)啟動VSMCs 增殖[9]。本實驗結果表明,缺氧后PASMCs胞內Ca2+的增加晚于c-fos 和c-myc 表達的增多,提示只在晚期才通過c-fos 和c-myc 起作用。而缺氧早期PASMCs c-fos 和c-myc 表達增加有其它因素參與。
綜上所述,本實驗首次觀察到缺氧后PASMCs α1AR mRNA 和β2AR mRNA 均增多,肺動脈α1AR與β2AR 相比本來就占優勢,缺氧后α1AR mRNA 表達增多,將導致細胞合成α1AR 增多。既可使缺氧時肺血管收縮加強,又使肺血管平滑肌細胞增殖,引起血管壁增厚而發生肺血管重建。有報道α1DAR 或α1BAR 基因缺失或敲除的小鼠,經受10%低氧21 d,其肺動脈肥厚和管腔狹窄遠低于同樣缺氧的基因正常小鼠[10]。取經受10%低氧9 d 的大鼠肺動脈做器官培養,去甲腎上腺素作用7 h 后,肺動脈DNA 和蛋白含量較正常對照大鼠增加3 倍,蛋白合成增加更多,應用α1AR 拮抗劑可抑制這種增加[11]。我室曾用β2AR 激動劑舒喘靈加強肺小動脈舒張,可減輕10%低氧引起大鼠肺動脈高壓[12];又用α1AR 拮抗劑哌唑嗪抑制肺小動脈收縮,可降低大鼠肺動脈高壓[3]。本實驗結果表明α1AR 激活能使肺血管收縮,還能引起肺血管平滑肌細胞增殖,缺氧引起胞內Ca2+升高和原癌基因(c-fos 和c-myc)激活,可能參與該細胞的增殖,故可針對α1AR 致細胞增殖通路中的不同環節進行干預,為臨床進行肺動脈高壓防治提供新啟發。目前臨床也開始應用α1AR 拮抗劑哌唑嗪,而且新型選擇性節后αAR 拮抗劑烏拉地爾(urapidil)[3]、新型T-通道Ca2+拮抗劑、c-myc 的反義寡聚核苷酸等均有人應用。對肺動脈高壓患者進行預實驗,凡NO 吸入或靜脈注射依前列醇(epoprastenol)后有降肺動脈壓效應者(即mPAP 能降10 mmHg或更多者),長期應用(>1 年)Ca2+拮抗劑地爾硫卓、尼莫地平或絡活喜,確能提高肺動脈高壓患者5 年生存率[13]。總之,應用縮血管和舒血管因子及影響細胞增殖機制的研究成果,尋找和應用糾正肺血管收縮和舒張失衡及減少增殖的藥物,單藥或聯合用藥,仍是當前肺動脈高壓防治研究的動向[14]。
[1] 謝劍嗚,薛全福,王立榮. 常壓缺氧對大鼠肺組織β 和α1腎上腺素能受體數目的影響[J]. 中國病理生理雜志,1989,5(5):261-265.
[2] 王曉芳,薛全福,王立榮. 常壓缺氧性肺動脈高壓大鼠肺組織腎上腺素能受體亞型數目的動態變化[J].中國病理生理雜志,1993,9(3):342-346.
[3] 薛全福.肺血管腎上腺素受體失衡與肺動脈高壓[A].見:陸慰萱,王 辰 主編. 肺循環病學[M]. 北京:人民衛生出版社,2007.99-101.
[4] Yang Z,Zhang Z,Xu T,et al. Relationship of intracellular free Ca2+concentration and calcium-activated chloride channels of pulmonary artery smooth muscle cells in rats under hypoxia conditions[J]. J Huazhong Univ Sci Tech Med Sci,2006,26(2):172-174,191.
[5] Majesky MW,Daemen MJ,Schwartz SM,et al. α1-Adrenergic stimulation of platelet-derived grouth factor A-chain gene expression in rat aorta[J]. J Biol Chem,1990,265(2):1082-1088.
[6] Sambrook J,Fritsch EF,Maniatis T. Molecular cloning:a laboratory mannual[M]. 2nd ed. New York:Cold Spring Harbor Laboratory Press,1989.
[7] Toshio N,Nakayama M,Yamamoto S,et al. α1-Adrenergic stimulation and β2-adrenergic inhibition of DNA synthesis in vascular smooth muscle cells[J]. Mol Pharmacol,1990,37(1):30-36.
[8] Shi Y,Hutchinson HG,Hall DJ,et al. Down regulation of c-myc expression by antisense oligonucleotides inhibits proliferation of human smooth muscle cells[J]. Circulation,1993,88(3):1190-1195.
[9] Ralph RR. Cyclic AMP,calcium and control of cell growth[J]. FEBS Lett,1983,161(1):1-8.
[10] Faber JE,Szymeczek CL,Cotecchia S. α1-Adrenoceptor-dependent vascular hypertrophy and remodeling in murine hypoxic pulmonary hypertension[J]. Am J Physiol Heart Circ Physiol,2007,292 (5):H2316-H2323.
[11] Faber JE,Szymeczek CL,Salvi SS,et al.Enhanced α1-adrenergic trophic activity in pulmonary artery of hypoxic pulmonary hypertensive rats[J]. Am J Physiol Heart Circ Physiol,2006,291(5):H2272-H2281.
[12] 丁耀賢,王曉芳,薛全福,等. 舒喘靈對缺氧大鼠肺動脈高壓和肺組織腎上腺素能β2受體mRNA 表達的影響[J].中國病理生理雜志,1999,15(3)193-196.
[13] Montani D,Savale L,Natali D,et al. Long-term response to calcium-channel blockers in non-idiopathic pulmonary arterial hypertension[J]. Eur Heart J,2010,31(15):1898-1907.
[14] Anderson JR,Nawarskas JJ.Pharmacotherapeutic management of pulmonary arterial hypertension[J]. Cardiol Rev,2010,18(3):148-162.

