Th17 細胞聯合CD3 + CD8 - IL-21 + T細胞升高與宮頸癌發生發展的關系*
張 妍, 崔保霞, 馬道新, 劉 藝, 田永菊, 侯 菲, 張文靜
(山東大學齊魯醫院1 婦產科,3 血液病研究中心,山東 濟南250012;2 濰坊市人民醫院婦產科,山東 濰坊262500;4 山東省腫瘤醫院婦瘤科,山東 濟南250117)
宮頸癌是僅次于乳癌的第二位常見婦女惡性腫瘤,高危型人乳頭瘤病毒(human papillomavirus,HPV)感染是其根本病因[1,2]。但是,HPV 感染后,絕大多數患者的免疫系統可將病毒清除,只有很少一部分持續感染者的宮頸損害會經由宮頸上皮內瘤Ⅰ級(cervical intraepithelial neoplasia I,CIN I)發展為CIN III 進一步進展為侵潤癌[3]。這就意味著免疫調節在HPV 介導的致癌作用中起著很重要的作用。
Th17 細胞是近年發現的一種新型CD4+效應性T 細胞,以其特異性的分泌IL-17 而命名。Th17 細胞介導炎性反應,參與自身免疫性疾病、移植物抗宿主等疾病的發生和發展,決定疾病的轉歸和預后,備受免疫學界的關注[4,5]。而其在腫瘤免疫應答中的表達及作用的報道卻很少且存在爭議。有研究表明,前列腺癌和卵巢癌患者外周血Th17 細胞比例升高,但卻得出了升高的Th17 細胞既促進腫瘤進展又抑制腫瘤進展的結論[6,7]。而另一研究發現,卵巢癌患者與正常人的外周血Th17 細胞比例無明顯差異,但腫瘤組織中分離出的侵潤性T 細胞里Th17 比例卻顯著上升[8]。關于Th17 細胞在宮頸癌中的研究還未見報道。IL-21 是Th17 細胞高表達的一個細胞因子,是IL-2 家族的新成員,Th17 通過自分泌IL-21 的途徑調節自身的分化和功能[9]。作為Th17細胞的功能性細胞因子,IL-21 還可以放大和維持Th17 細胞的功能[10],而IL-17 則不能[4]。為了探討Th17 在宮頸癌發生發展中的作用,我們檢測了宮頸癌患者、CIN 患者以及正常對照外周血中Th17 細胞和CD3+CD8-IL-21+T 細胞的表達情況,并進一步探討它們之間的關系。
材 料 和 方 法
1 材料
1.1 主要試劑及儀器 藻紅蛋白- 花青染料5(phycoerythrin-cyanine 5,PE-Cy5)標記的抗人CD3 單抗、異硫氰酸熒光素(fluorescein isothiocyanate,FITC)標記的抗人CD8 單抗、PE 標記的抗人白細胞介素-17(interleukin-17,IL-17)單抗和PE標記的抗人IL-21 單抗均購自eBioscience;佛波醇乙酯(phorbol myristate acetate,PMA)、離子霉素(ionomycin)和莫能霉素(monensin)均購自Alexis Biochemicals。采用BD Bioscience PharMingenCalibur 流式細胞儀測定淋巴細胞各種熒光素的熒光強度。
1.2 研究對象 2009 年12 月至2010 年6 月山東大學齊魯醫院收治的宮頸癌患者37 例,年齡34-70歲,平均45 歲;CIN 患者25 例,年齡28-60 歲,平均42 歲,均經宮頸活檢或手術病理證實。對照組18例,全部為健康志愿者,年齡26-67 歲,平均42 歲,宮頸細胞學檢查陰性。3 組中年齡無顯著差異。合并糖尿病、高血壓、心血管疾病、妊娠、急慢性感染、結締組織病或既往有腫瘤病史者排除入選。分期執行國際婦產科聯盟(FIGO,2000 年)分期標準。入選患者的基本臨床特征見表1 及表2。所有入選患者均為初治,未經手術、化療及放射等任何治療。
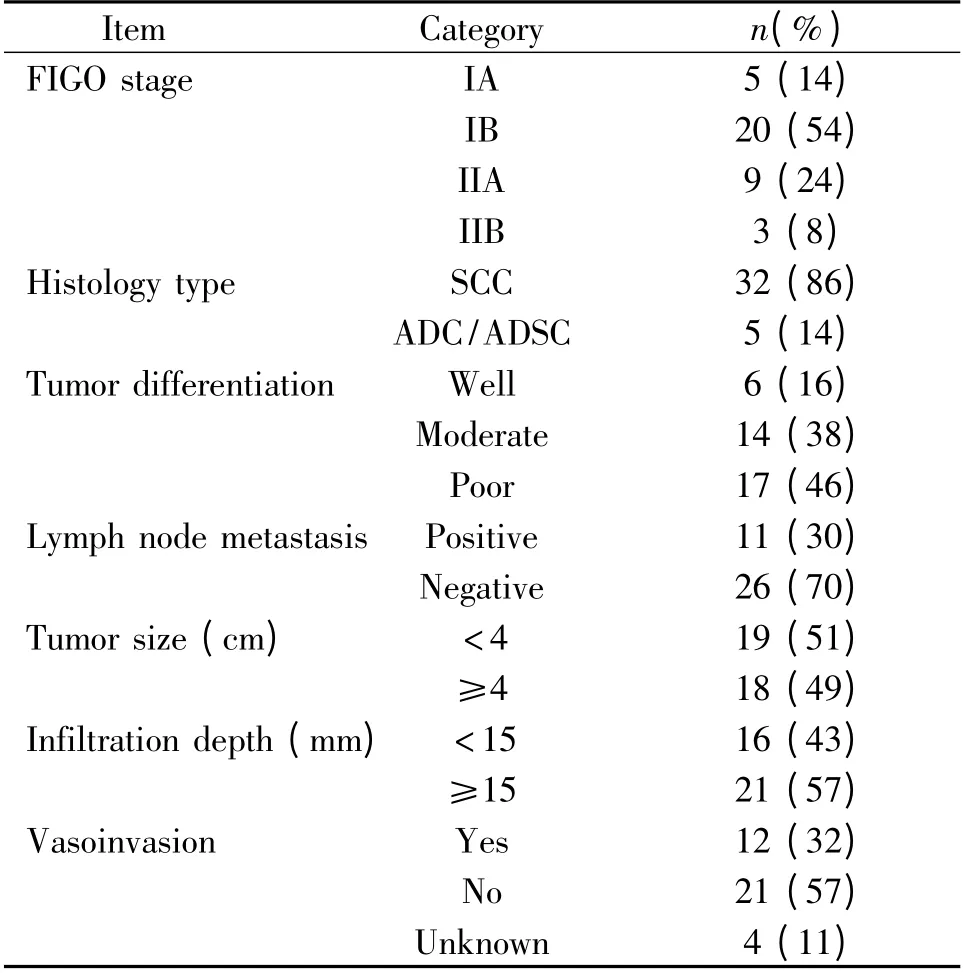
表1 宮頸癌患者的臨床特征Table 1. Clinical characteristics of cervical cancer patients(n =37)
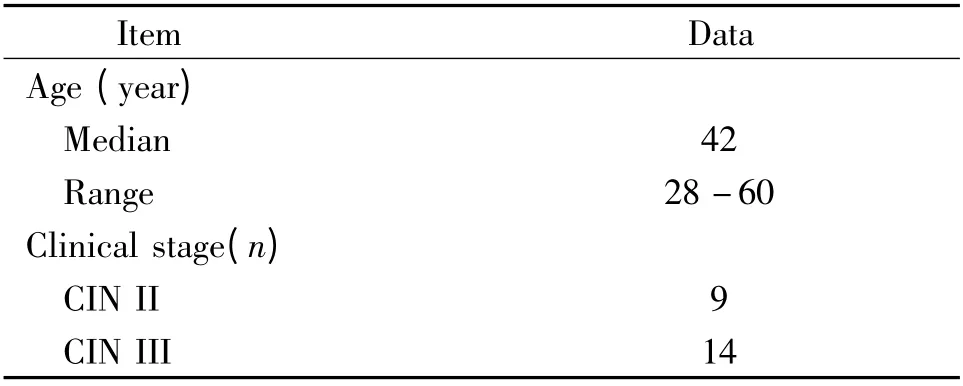
表2 CIN 患者的臨床特征Table 2. Clinical characteristics of CIN patients(n=25)
本研究獲得山東大學齊魯醫院醫學倫理委員會批準,所有參與者均知情并簽署知情同意書,然后采集晨起空腹肝素鈉抗凝靜脈血4 mL。
2 方法
2.1 Th17 細胞及CD3+CD8-IL-21+T 細胞的檢測
IL-17 和IL-21 都是胞內表達的細胞因子,通過流式技術檢測其含量來反映Th17 和CD3+CD8-IL-21+T 細胞的水平。取肝素鈉抗凝的全血200 μL,加入同體積的不含牛血清的RPMI-1640,再加入PMA (工作濃度25 μg/L)、ionomycin (工作濃度1 mg/L)和monensin (工作濃度1.7 mg/L),混勻后在37 ℃、5% CO2孵箱中孵育4 h。混勻后分別取100 μL 于3 個流式管中,標記為Th17 細胞管、CD3+CD8-IL-21+T 細胞管和同型對照管。按說明書要求加入PE-Cy5 抗人CD3 單抗和FITC 抗人CD8 單抗,室溫下避光孵育15 min,以標記CD4+T 細胞(CD3+CD8-T 細胞)。用生理鹽水洗滌,固定、破膜后,分別加入說明書推薦劑量的PE 標記抗人IL-17單抗、抗人IL-21 單抗和同型抗體,室溫下避光孵育15 min。生理鹽水洗滌后,PBS 重懸細胞,用流式細胞儀進行檢測。
3 統計學處理
應用SPSS 13.0 軟件進行統計分析。計量資料以均數±標準差(±s)表示,3 組間比較采用方差分析,2 組間的比較用t 檢驗。
結 果
1 Th17 細胞在CIN 及宮頸癌患者外周血中的比例升高
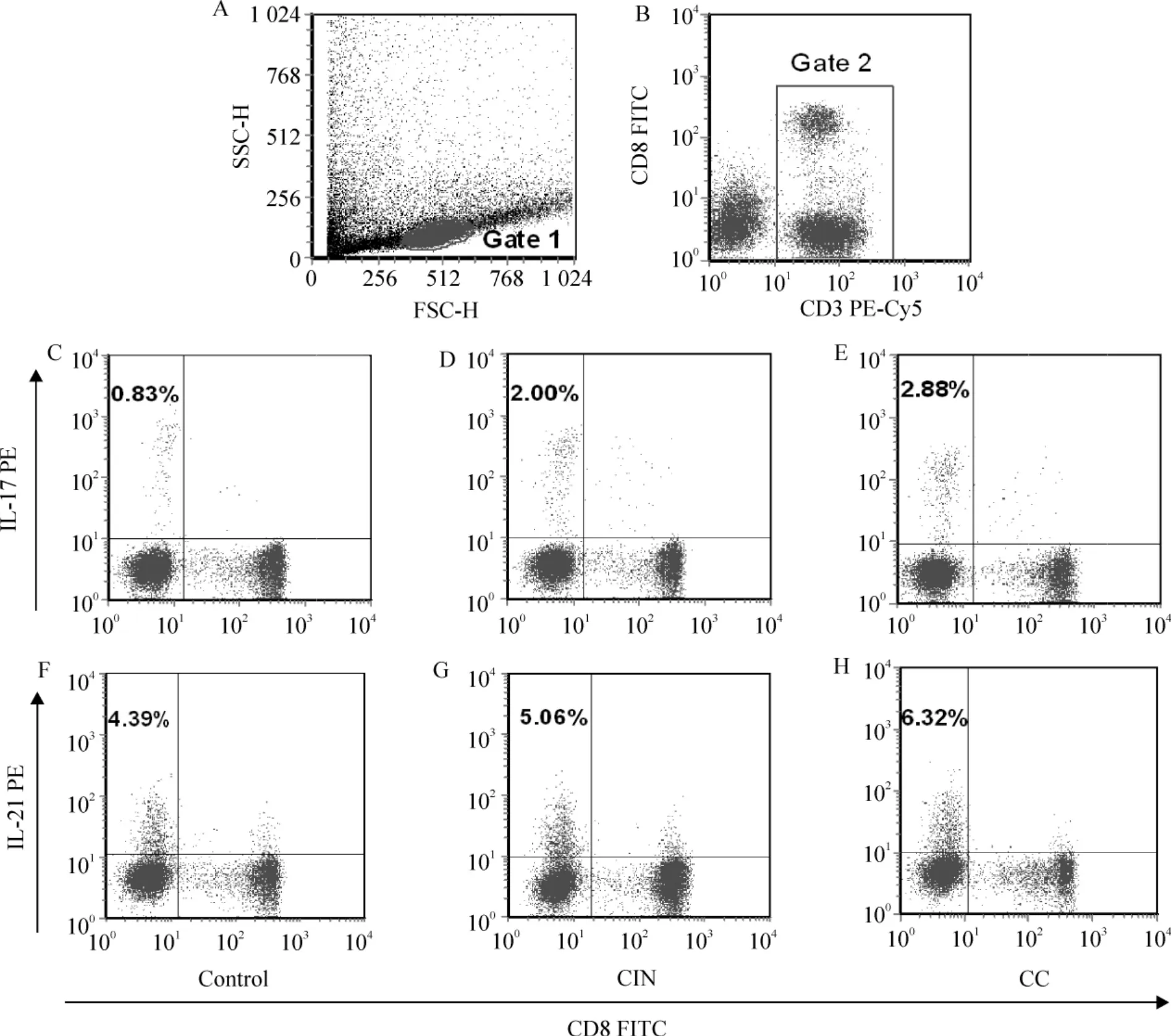
Figure 1. The levels of circulatory Th17 cells and CD3 +CD8 -IL-21 +T cells in representative cervical cancer (CC)patients,cervical intraepithelial neoplasia (CIN)patients and controls. A:lymphocytes were gated by flow cytometry.B:CD3 + T subsets were gated by flow cytometry. Plots in the internal box represented CD3 + T cells. C,D,E:the proportions of Th17 to CD3 +subsets from representative controls,CIN patients and CC patients,respectively.F,G,H:representative IL-21 expression in CD3 + subsets from controls,CIN patients and CC patients were shown,respectively. The percentages of positive cells were shown in each panel.圖1 Th17 細胞和CD3 +CD8 -IL-21 +T 細胞在宮頸癌、CIN 及正常對照組中的表達
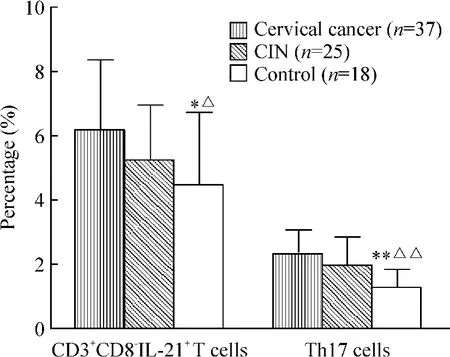
Figure 2. The proportions of CD3 + CD8 - IL-21 + T cells and Th17 cells detected by flow cytometry. ± s. * P <0.05,**P <0.01 vs cervical cancer;△P <0.05,△△P<0.01 vs CIN.圖2 CD3 +CD8 -IL-21 +T 細胞和Th17 細胞在宮頸癌、CIN和正常人中的比例
在PMA/ionomycin 短時間孵育后,Th17 細胞和CD3+CD8-IL-21+T 細胞在宮頸癌患者、CIN 患者及正常對照者外周血中的比例變化見圖1、2。與正常人[(1.30±0.51)%]相比,Th17 細胞比例在宮頸癌患者[(2.30 ±0.78)%,P <0.01]和CIN 患者[(2.05 ±0.82)%,P <0.01]明顯升高。CIN 患者與宮頸癌患者Th17 細胞的比較無顯著差異(P >0.05)。宮頸癌患者Th17 細胞比例增高的程度與臨床分期呈正相關(P <0.05),并與淋巴結轉移和脈管侵潤相關,其比例在有淋巴結轉移組[(2.97 ±0.51)% vs (2.01±0.85)%,P <0.01]和有脈管浸潤組[(3.20 ±0.45)% vs (1.74 ±0.67)%,P <0.01]明顯升高,見圖3。Th17 細胞比例與腫瘤的大小、組織學類型、分化程度及浸潤深度無顯著相關性(P >0.05)。
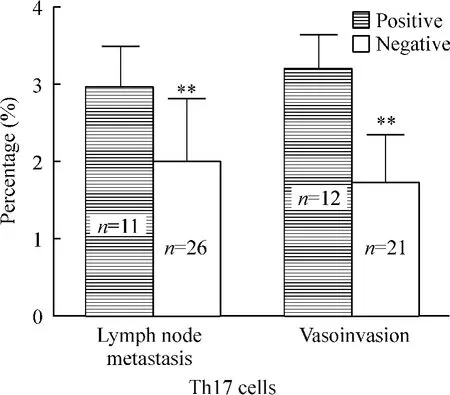
Figure 3. The proportion of Th17 cells and its correlation with lymph node metastasis or vasoinvasion in cervical cancer patients. ±s. **P <0.01 vs positive.圖3 宮頸癌患者Th17 細胞比例與淋巴結轉移及脈管轉移的關系
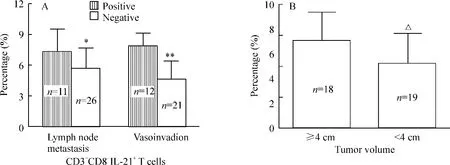
Figure 4. The correlation between CD3 +CD8 -IL-21 +T cell proportion and lymph node metastasis,vasoinvasion(A)or tumor size(B)in cervical cancer patients. ±s. * P <0.05,**P <0.01 vs positive;△P <0.05 vs ≥4 cm.圖4 宮頸癌患者CD3 +CD8 -IL-21 +T 細胞比例與淋巴結轉移、脈管轉移及腫瘤大小的關系
2 CD3+CD8-IL-21+T 細胞在CIN 及宮頸癌患者外周血中的比例升高
與正常對照組[(4.54 ±2.22)%]相比,CD3+CD8-IL-21+T 細胞比例在CIN 患者組[(5.22 ±1.74)%,P <0.05]及宮頸癌患者組[(6.17 ±2.21)%,P <0.05]都明顯升高,而CIN 組與宮頸癌組之間無顯著差異(P >0.05)。在宮頸癌組,CD3+CD8-IL-21+T 細胞比例亦與臨床分期呈正相關(P<0.05),并且淋巴結轉移組高于無淋巴結轉移組[(7.29 ±2.43)% vs (5.66 ±2.24)%,P <0.05],脈管侵潤組高于無脈管侵潤組[(7.86 ±1.43)% vs(4.63 ±1.88)%,P <0.01]。CD3+CD8-IL-21+T細胞比例還與腫瘤大小相關,與腫瘤體積<4 cm 組[(5.21 ±2.43)%]相比,腫瘤體積≥4 cm 組[(7.08±2.31)%,P <0.05]其比例明顯升高。CD3+CD8-IL-21+T 細胞比例與組織學類型、分化程度及浸潤深度無明顯相關(P >0.05)。
3 Th17 與CD3+CD8-IL-21+T 細胞的相關性
如圖5 所示Th17 細胞比例與CD3+CD8-IL-21+T 細胞比例在正常對照組(r =0.753,P <0.01)和宮頸癌組(r =0.760,P <0.01)呈顯著正相關,而在CIN 患者組則無相關性(r=0.410,P >0.05)。
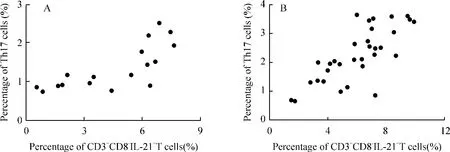
Figure 5. The correlation between Th17 cells and CD3 +CD8 -IL-21 +T cells. Positive correlation between the percentages of Th17 and CD3 +CD8 -IL-21 +T cells were found in healthy controls (A:r=0.753,P <0.01)and cervical cancer patients (B:r=0.760,P <0.01). No significant correlation was found in CIN (cervical intraepithelial neoplasia)patients (r=0.410,P >0.05). Pearson correlation test was used.圖5 Th17 細胞與CD3 +CD8 -IL-21 +T 細胞的相關性分析
討 論
Th17 細胞的發現使我們對T 細胞介導的免疫應答有了重新的認識[11,12]。在分化與調節上,Th17 細胞與具有顯著免疫抑制效應的調節性T 細胞(regulatory T cells,Treg)反向調節,關系密切[4,13]。在功能上,Th17 細胞及其細胞因子介導炎癥反應,在感染、炎癥、自身免疫性疾病及移植物抗宿主病中發揮著重要作用。而炎癥與腫瘤之間具有緊密的聯系[14]。因此Th17 細胞與腫瘤的關系已成為目前腫瘤免疫研究的熱點。
最近研究發現Th17 細胞及其相關細胞因子可能與腫瘤相關,并參與介導炎癥相關性腫瘤的免疫發病機制。但對Th17 細胞在腫瘤免疫中的性質、作用和調控機制仍不完全清楚[4,15]。在胃癌的研究中發現,Th17 細胞在胃癌患者的外周血、引流淋巴結中的比例升高,并且升高的程度與臨床分期有關,認為Th17 可能促進了胃癌的病理發展[16]。Kryczek 等[7]也報道Th17 細胞比例在前列腺癌小鼠、上皮性卵巢癌患者的外周血中升高。我們的研究結果也顯示,與健康對照組相比,Th17 細胞比例在CIN 和宮頸癌患者的外周血中升高,差異顯著。同時研究發現,外周血中的Th17 細胞可能是腫瘤侵潤Th17 細胞的主要來源[17],而腫瘤內的Th17 細胞中超過95%者不表達CD62L 和CCR7(稱之為effector memory T Tem,不能進入二級淋巴組織),表示這些細胞是組織的常駐細胞,不會進入淋巴管和外周血循環[18]。Bonnotte等[19]通過結腸腺癌大鼠模型發現原發腫瘤部位CCL20(CCR6 的受體,可誘導Th17 細胞遷徙[17,20])表達上調,并對腫瘤的生長有促進作用。這些數據表明,外周的Th17 細胞或許是腫瘤浸潤Th17 細胞的重要來源,并與腫瘤的進展有關。我們的結果顯示,宮頸癌患者組的Th17 細胞比例隨著臨床分期的進展而逐步升高,而且與沒有淋巴結轉移組或沒有脈管轉移組相比,淋巴結轉移組和脈管轉移組的Th17 細胞比例都分別增高,差異顯著。由于臨床分期、淋巴結轉移及脈管轉移狀況是評價宮頸癌預后的最重要指標,這一結果就暗示著Th17 細胞在宮頸癌的進展和導致不良預后上扮演著促進的角色。類似的結果在胃癌的研究中也得以發現[16]。我們會進行長期隨訪,以驗證這一結論。
Th17 的一個重要的效應性細胞因子是IL-21。IL-21 是Th17 細胞分泌的特征性細胞因子之一,不但以自分泌的形式通過STAT3 途徑誘導Th0 細胞向Th17 細胞分化[9,21],還能刺激CD4+Th0 細胞分泌IL-17[10]。由于IL-21 的最主要來源是Th17 細胞[4,20,22],并且具有放大和維持Th17 細胞功能的作用[10],因此我們同樣通過流式細胞分析術檢測了CD3+CD8-IL-21+T 淋巴細胞在宮頸癌、CIN 和正常人外周血中的表達。結果發現,與健康對照相比,CD3+CD8-IL-21+T 細胞比例在CIN 患者和宮頸癌患者中升高,并隨著疾病的進展逐步升高,增高的程度與宮頸癌的臨床分期呈正相關。同樣類似于Th17細胞的是,CD3+CD8-IL-21+T 細胞比例在淋巴結轉移組中高于無淋巴結轉移組,在脈管侵潤組中高于無脈管侵潤組,差異顯著。同時我們的結果也顯示Th17 細胞比例與CD3+CD8-IL-21+T 細胞比例呈正相關,這些數據從側面進一步支持了Th17 細胞在宮頸癌患者升高的結果。此外,研究發現IL-21還能誘導上皮細胞分泌MIP-3α(macrophage inflammatory protein,CCL20)[23],并 在其 趨 化 因 子 受 體CCR6 的吸引下誘導Th17 細胞進行遷徙[17,20]。因此我們推測CD3+CD8-IL-21+T 細胞在Th17 細胞促進宮頸癌的發生發展中可能起了重要的輔助調節作用。但在生理狀態下,荷瘤機體自分泌IL-21 的能力或許受到了Th17 細胞的限制,分泌的IL-21 只能在局部起作用,并不能達到高水平以發揮抗腫瘤作用,因此,如何協調Th17 細胞與IL-21 的關系或許可以成為腫瘤治療的可行性策略。
綜上所述,IL-21 伴隨著Th17 細胞在CIN 和宮頸癌患者體內表達增高,并隨著疾病進展逐步積聚,在宮頸癌的發生發展中起了重要作用。盡管IL-21具有抗腫瘤作用,但是由于其來源主要是Th17 細胞,并在Th17 細胞的分化和功能維持上起著重要作用,因此,重新認識兩者之間的關系和免疫調節機制,并加以合理利用,將會為宮頸癌的臨床治療開辟一條新的策略。
[1] Nakamura T,Shima T,Saeki A,et al. Expression of indoleamine 2,3-dioxygenase and the recruitment of Foxp3- expressing regulatory T cells in the development and progression of uterine cervical cancer[J]. Cancer Sci,2007,98(6):874-881.
[2] 廖百花,馮亦軍,肖小敏. 兔宮頸固相轉染靶向HPV16 siRNA 抑制荷宮頸癌SCID 小鼠HPV 的復制[J].中國病理生理雜志,2010,26(4):695-699.
[3] Patel S,Chiplunkar S. Host immune responses to cervical cancer[J]. Curr Opin Obstet Gynecol,2009,21(1):54-59.
[4] Korn T,Carrier Y,Gao W,et al. IL-17 and Th17 cells[J]. Annu Rev Immunol,2009,27:485-517.
[5] Dong C. TH17 cells in development:an updated view of their molecular identity and genetic programming[J]. Nat Rev Immunol,2008,8(5):337-348.
[6] Sfanos KS,Bruno TC,Maris CH,et al. Phenotypic analysis of prostate-infiltrating lymphocytes reveals TH17 and Treg skewing[J]. Clin Cancer Res,2008,14(11):3254-3261.
[7] Kryczek I,Wei S,Zou L,et al. Cutting edge:Th17 and regulatory T cell dynamics and the regulation by IL-2 in the tumor microenvironment[J]. J Immunol,2007,178(11):6730-6733.
[8] Miyahara Y,Odunsi K,Chen W,et al. Generation and regulation of human CD4+IL-17-producing T cells in ovarian cancer[J]. Proc Natl Acad Sci U S A,2008,105(40):15505-15510.
[9] Nurieva R,Yang XO,Martinez G,et al. Essential autocrine regulation by IL-21 in the generation of inflammatory T cells[J]. Nature,2007,448(7152):480-483.
[10] Wei L,Laurence A,Elias KM,et al. IL-21 is produced by Th17 cells and drives IL-17 production in a STAT3-dependent manner[J]. J Biol Chem,2007,282(48):34605-34610.
[11] Bettelli E,Carrier Y,Gao W,et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells[J]. Nature,2006,441(7090):235-238.
[12] Kryczek I,Banerjee M,Cheng P,et al. Phenotype,distribution,generation,and functional and clinical relevance of Th17 cells in the human tumor environments[J].Blood,2009,114(6):1141-1149.
[13] Mougiakakos D,Choudhury A,Lladser A,et al. Regulatory T cells in cancer[J]. Adv Cancer Res,2010,107:57-117.
[14] Coussens LM,Werb Z. Inflammation and cancer[J]. Nature,2002,420(6917):860-867.
[15] Tesmer LA,Lundy SK,Sarkar S,et al. Th17 cells in human disease[J]. Immunol Rev,2008,223(1):87-113.
[16] Zhang B,Rong G,Wei H,et al. The prevalence of Th17 cells in patients with gastric cancer[J]. Biochem Biophys Res Commun,2008,374(3):533-537.
[17] Zhang JP,Yan J,Xu J,et al. Increased intratumoral IL-17-producing cells correlate with poor survival in hepatocellular carcinoma patients[J]. J Hepatol,2009,50(5):980-989.
[18] Bromley SK,Thomas SY,Luster AD. Chemokine receptor CCR7 guides T cell exit from peripheral tissues and entry into afferent lymphatics[J]. Nat Immunol,2005,6(9):895-901.
[19] Bonnotte B,Crittenden M,Larmonier N,et al. MIP-3alpha transfection into a rodent tumor cell line increases intratumoral dendritic cell infiltration but enhances (facilitates)tumor growth and decreases immunogenicity[J]. J Immunol,2004,173(8):4929-4935.
[20] Monteleone G,Pallone F,MacDonald TT. Interleukin-21:a critical regulator of the balance between effector and regulatory T-cell responses[J]. Trends Immunol,2008,29(6):290-294.
[21] Spolski R,Leonard WJ. The Yin and Yang of interleukin-21 in allergy,autoimmunity and cancer[J]. Curr Opin Immunol,2008,20(3):295-301.
[22] Ivanov II,McKenzie BS,Zhou L,et al. The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17 + T helper cells[J].Cell,2006,126(6):1121-1133.
[23] Caruso R,Fina D,Peluso I,et al. A functional role for interleukin-21 in promoting the synthesis of the T-cell chemoattractant,MIP-3alpha,by gut epithelial cells[J]. Gastroenterology,2007,132(1):166-175.

