心衰大鼠室旁核微量注射AT1 和AT2 受體阻滯劑對腎交感神經活性的影響
潘麗華, 秦曉同, 朱健華, 桂 樂
(南通大學附屬醫院心血管內科,江蘇 南通226001)
據統計,心力衰竭(heart failure,HF)的年死亡率為10%,是導致65 歲以上的老年人入院的主要原因[1]。心衰的確切病因至今仍不十分明確,大量研究結果顯示心衰時循環內分泌激活,主要是腎素-血管緊張素(angiotensin,Ang)-醛固酮系統的激活可加速心力衰竭的惡化[2]。交感神經興奮增強是慢性心衰的重要病理特征,其可導致外周血管阻力的增加,增加心臟的后負荷,腎上腺皮質醛固酮釋放增加,水鈉潴留,從而增加心臟的前負荷。因此,降低心衰狀態下交感神經的活性可以明顯降低心衰的死亡率。據相關文獻報道,阻斷腦內血管緊張素系統的活性能導致慢性心衰交感神經興奮性顯著降低[3]。下丘腦室旁核是心血管系統功能調節的重要區域,其調節了交感神經活動的輸出,它與大腦其它神經核團存在密切聯系,包括延髓頭端腹外側區(rostral ventrolateral medulla,RVLM)、孤束核(nucleus tractus solitarius,NTS)、腦橋的藍斑核(locuscoeruleus,LC)等,這些區域對心血管系統起著重要的調節作用[4]。本研究制作大鼠心梗后心衰模型,后腹膜途徑尋找腎交感神經,利用AngⅡ-1 型(angiotensin Ⅱtype 1,AT1)和2 型(angiotensi Ⅱtype 2,AT2)受體阻滯劑微量注射于下丘腦室旁核,記錄心率、血壓和腎交感神經的活性,探討慢性心衰的中樞調控機制。
材 料 和 方 法
1 動物和儀器
選用SD 大鼠,雄性,體重180 -220 g,由南通大學實驗動物中心提供。實驗室分籠飼養,予以標準鼠糧和自來水,保持籠內通風干燥,室溫18 -22 ℃。SD 大鼠隨機分為2 大組:手術組(HF AT1組、HF AT2組、HF Veh 組)和假手術組(sham AT1組,sham AT2組、sham Veh 組)。4 周后采用Stoelting 大鼠腦立體定位儀進行定位,POWERLAB 8/30 系統采集信號(Adinstrument)系統記錄心率、血壓和腎交感神經放電信號。
2 試劑
AT1受體阻滯劑(L - 158809)和AT2受體阻滯劑(PD123319)均購自 Sigma,用生理鹽水溶解、配制為0.1 mol/L的溶液。人工腦脊液(artificial cerebrospinal fluid,ACSF)[pH 7.4,含有(mmol/L):NaCl 130,KCl 2. 99,CaCl20.98,MgCl2·6H2O 0. 80,NaHCO325,Na2HPO4·12H2O 0.039,Na2HPO4·2H2O 0.46][5],- 20 ℃凍存備用。
3 心衰模型的制作
冠脈結扎誘導慢性心衰動物模型:SD 大鼠在水合氯醛麻醉下仰位固定于手術臺,自左側3 -4 肋間開胸,暴露心臟,于肺動脈圓錐及左心房之間找出冠脈左前降支,以0 號線立即結扎冠脈,迅速關閉胸腔,并用負壓吸引吸出胸腔內血液和氣體。假手術組僅置縫線而不結扎冠脈。術后肌注青霉素。術后第4 周末對假手術組大鼠與心衰組大鼠進行實驗。
4 血流動力學檢測
使用烏拉坦麻醉各手術大鼠,行頸部切口并分離右頸總動脈,結扎遠心端,用動脈夾夾住近心端,在管壁上剪一很小的斜口,插入內徑0.5 mm、外徑1 mm 并充滿1 ×105U/L 肝素鈉生理鹽水的聚乙烯導管,經右側頸總動脈向心端緩慢插入左心室,導管另一端通過壓力換能器連接到生理記錄儀,同步采集心率(heart rate,HR)、左心室收縮壓(left ventricular systolic pressuer,LVSP)、左心室舒張末期壓(left ventricular end-diastolic pressure,LVEDP)和左心室內壓最大上升或下降速率(±dp/dtmax)。LVEDP≥15 mmHg 為心衰模型成功的標志。
5 記錄血壓、心率和腎交感神經活動
血流動力學檢測后對符合實驗標準的各手術大鼠行頸部切口并分離氣管,行氣管切開,股靜脈置管,術中使用肌松劑馳肌碘(gallamin)以25 mg·kg-1·h-1持續泵入。行頸部切口并分離右頸總動脈,導管接壓力換能器,與橋式放大器相連,POWERLAB 8/30 同步采集測動脈血壓、平均動脈壓和心率(HR);后將動物俯位固定于大鼠腦立體定位儀上,再將大鼠取側俯臥位,經腹膜后暴露左腎,在手術顯微鏡下剝離腎交感神經,將神經置于雙極鉑絲電極上,灌入配制好的溫熱液體石蠟(37 ℃),使神經與記錄電極結合處于周圍組織絕緣并濕潤和保護神經。POWERLAB 8/30 系統采集信號,記錄腎交感神經活動(renal sympathetic nerve activity,RSNA)。
6 室旁核(paraventricular nucleus,PVN)定位和微量注射
大鼠固定在腦立體定位儀上,沿矢狀縫做皮膚切口暴露顱骨,調整前囟和后囟至同一水平。PVN 定位:B=1.8 mm,L=0.4 mm,H=7.9 mm。B 表示為前囟向后,L 表示正中線左右旁開,H 表示硬腦膜下深度。電鉆顱骨鉆孔,再用微量注射器插入PVN 內。
7 定位與組織學檢測
實驗結束時,10% KCl 靜脈注入處死動物,以此時神經放電積分值作為腎交感神經放電活動的噪聲水平。室旁核內微量注射2% 滂胺天藍溶液(50 nL)。剪取頭顱,去除顱骨,將腦組織固定于10% 甲醛溶液中,2 d 后作切片,在顯微鏡下定位微量注射點位置,定位不準確者不列入統計。
8 統計學處理
結 果
1 大鼠心功能評價
1.1 血流動力學的測定 術后4 周檢測大鼠血流動力學,手術組大鼠LVEDP 較假手術組明顯增高(P <0.05),LVSP高于假手術組,但無顯著差異,見表1。
表1 手術組與假手術組血流動力學比較Table 1. Hemodynamics in rats with heart failure and shamed-operated rats (±s)
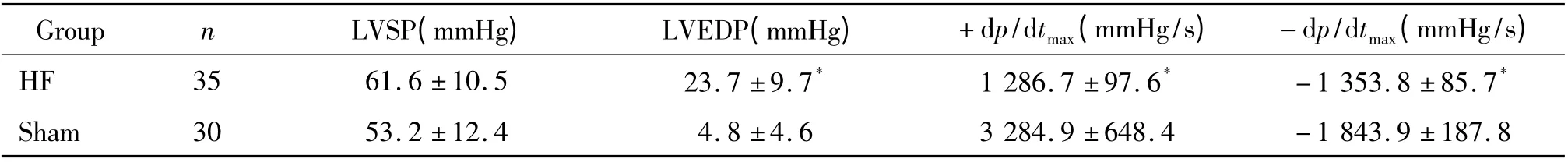
表1 手術組與假手術組血流動力學比較Table 1. Hemodynamics in rats with heart failure and shamed-operated rats (±s)
* P <0.05 vs sham group. HF:heart failure;sham:sham-operated.
Group n LVSP(mmHg) LVEDP(mmHg) +dp/dtmax(mmHg/s) -dp/dtmax(mmHg/s)HF 35 61.6 ±10.5 23.7 ±9.7* 1 286.7 ±97.6* -1 353.8 ±85.7*Sham 30 53.2 ±12.4 4.8 ±4.6 3 284.9 ±648.4 -1 843.9 ±187.8
1.2 心臟、肺組織與體重比的測量 取實驗后大鼠心臟,實驗結束后立即剪開胸壁暴露心臟與肺臟,隨即剪取心臟與肺臟,將心臟在濾紙上瀝干,稱重。同時稱取肺濕重。將心臟重與總體重相除,得到心臟/體重值,將肺濕重與總體重相除,得到肺/體重值。假手術組及心衰組大鼠的指標均來自于手術后4 周獲得的組織標本。心衰組大鼠的心臟/體重指數高于假手術組,差異顯著(P <0.01),說明心梗后慢性心衰而引起的心臟肥大;心衰組大鼠的肺/體重指數高于假手術組(P <0.01),提示有心力衰竭引起的肺水腫,見表2。
表2 心衰大鼠心、肺重與體重比及心梗占左心室面積比的變化Table 2. Changes of heart weight(HW)/body weight(BW),lung weight(LW)/BW and infarct area(IA)/left ventricular area(IA/LVA)in rats(±s)

表2 心衰大鼠心、肺重與體重比及心梗占左心室面積比的變化Table 2. Changes of heart weight(HW)/body weight(BW),lung weight(LW)/BW and infarct area(IA)/left ventricular area(IA/LVA)in rats(±s)
**P <0.01 vs sham group.
Group n HW/BW(mg/g) LW/BW(mg/g) IA/LVA(%)HF 31 5.4±1.4** 9.8±2.8** 49.5±8.5**Sham 30 2.7±0.4 6.9±0.9 0
1.3 心臟病理組織學觀察 觀察心臟病理組織學變化,并采用Image-Pro Plus 6.0 軟件面積法測定該心臟心梗面積占左室面積的比值,該比值≥30%為冠脈結扎術誘導心衰模型成功標志。見表2。
2 大鼠血壓、心率和腎交感神經活性的變化
表3 中可以看出,HF AT1組大鼠與sham AT1組比較,前者腎交感神經放電活動明顯減弱(P <0.05),HF AT2組與sham AT2組比較,腎交感神經放電無顯著變化,各組大鼠注射藥物前后HR 和MAP 均有改變,但無明顯差異。
圖1 顯示,腎交感神經的放電活動在AT1受體阻滯劑L-158809注射后,手術組和假手術組大鼠都有減弱趨勢,手術組減弱較假手術組減弱更為明顯,見圖1A、B。腎交感神經的放電活動在AT2受體阻滯劑PD123319 注射前后手術組與假手術組改變不明顯,見圖1C、D。
討 論
本研究使用SD 大鼠冠狀動脈左前降支結扎導致心梗從而誘導慢性心衰動物模型,4 周后可見,心衰組心臟/體重比與肺/體重比指數均高于假手術組,且有統計學意義;心衰組大鼠LVEDP 較假手術組明顯增高,差異有統計學意義;心臟病理組織學變化顯示梗死面積>30%(梗死面積為49.5 ±8.5),有統計學意義,表明心衰模型制作成功。
表3 各組大鼠PVN 微量注射AT1 和AT2 受體阻滯劑的效應Table 3. Averaged changes of RSNA,HR and MAP before and after microinjection into the paraventricular nucleus(PVN)of the hypothalamus (±s)
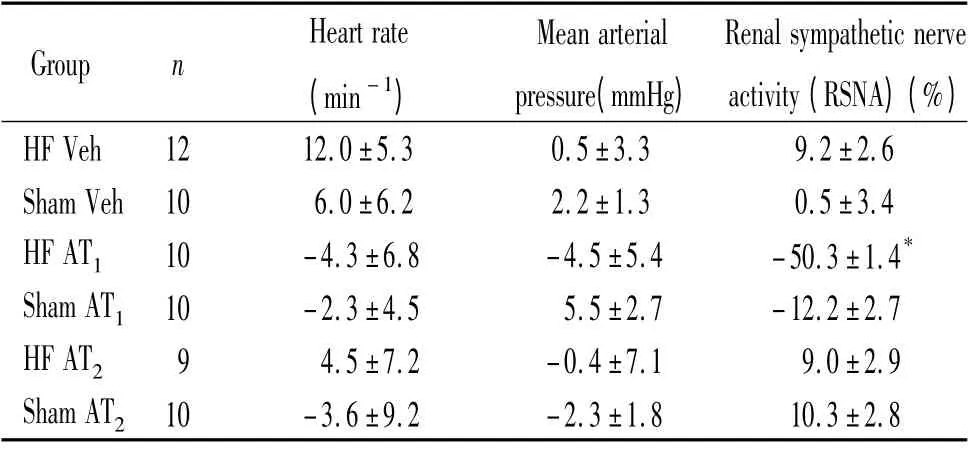
表3 各組大鼠PVN 微量注射AT1 和AT2 受體阻滯劑的效應Table 3. Averaged changes of RSNA,HR and MAP before and after microinjection into the paraventricular nucleus(PVN)of the hypothalamus (±s)
* P <0.05 vs sham AT1 group. Veh:injection into PVN with ACSF in HF rats and sham rats.AT1:injection with AT1 receptor antagonist (L -158809)into PVN of HF rats and sham rats.AT2:injection with AT2 receptor antagonist (PD123319)into PVN of HF rats and sham rats.
Group n Heart rate(min -1)Mean arterial pressure(mmHg)Renal sympathetic nerve activity(RSNA)(%)HF Veh 12 12.0±5.3 0.5±3.3 9.2±2.6 Sham Veh 10 6.0±6.2 2.2±1.3 0.5±3.4 HF AT1 10 -4.3±6.8 -4.5±5.4 -50.3±1.4*Sham AT1 10 -2.3±4.5 5.5±2.7 -12.2±2.7 HF AT2 9 4.5±7.2 -0.4±7.1 9.0±2.9 Sham AT2 10 -3.6±9.2 -2.3±1.8 10.3±2.8
據相關文獻報道,心力衰竭時循環內分泌激活,可加速心力衰竭的惡化,慢性心衰大鼠腎交感神經活性明顯高于假手術組[6],這與我們的研究結果相一致。從我們的結果中可見,手術組RSNA 在注射AT1受體阻滯劑L -158809 后比注射前明顯減弱,而假手術組減弱不明顯;手術組注射AT2受體阻滯劑PD123319 前后改變不明顯,而假手術組亦無相關改變。PVN 是自主性和內分泌性反應的重要整合中樞,在維持心血管活動的動態平衡中起著關鍵作用。心衰時PVN 中AT1受體介導的血管緊張素反應對交感神經功能的調節有重要的作用[7]。心衰大鼠PVN 內AT1受體上調,使用Ang II 可明顯引起腎交感放電的增強[7,8]。本研究中,AT1受體阻滯劑影響了Ang Ⅱ受體介導的交感信號的輸出,阻斷了相關興奮性信號的轉導,從而抑制了腎交感神經的放電。最近,Gao等[9]發現,心衰大鼠中RVLM 內AT1受體蛋白的表達明顯升高,而AT2受體蛋白表達明顯下降,AT1/AT2受體比例上升。本研究使用AT2受體阻滯劑后手術組及假手術組的RSNA神經放電改變不明顯,以此推測,心衰大鼠PVN 內AT2受體表達不升高,不排除AT2受體無AT1相關介導作用。若要明確相關機制還需進一步研究探討。
本研究就心衰SD 大鼠下丘腦室旁核對AT1和AT2受體阻滯劑微量注射后腎交感神經的反應進行了相關研究,中樞受體AT1對心衰的慢性激活有重要意義,而AT2意義不大,為慢性心衰的病理生理研究和治療提供了依據。
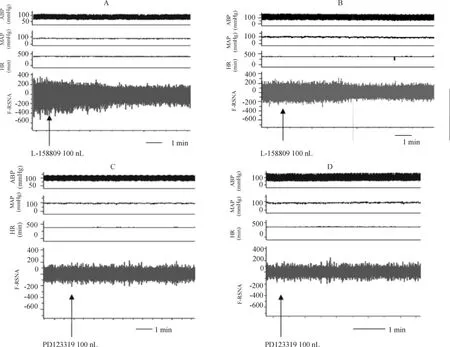
Figure 1. Changes of ABP,MAP,HR and RSNA before and after injection with AT1 receptor antagonist(L-158809)and AT2 receptor antagonist(PD123319)into PVN.ABP:ambulatory blood pressure;MAP:mean arterial pressure;HR:heart rate;RSNA:renal sympathetic nerve activity.A:injection with L-158809 into PVN in heart failure(HF)rats;B:injection of L-158809 into PVN in sham-operated (sham)rats;C:injection with PD123319 into PVN in HF rats;D:injection PD123319 into PVN in sham rats.圖1 大鼠血壓、心率及腎交感神經活動的變化
[1] Neubauer S. The failing heart-an engine out of fuel[J].N Engl J Med,2007,356 (11):1140 -1151.
[2] Atlas SA. The renin - angiotensin aldosterone system:pathophysiological role and pharmacologic inhibition[J]. J Manag Care Pharm,2007,13(8 Suppl B):9 -20.
[3] Francis J,Wei SG,Weiss RM,et al. Brain angiotensin -converting enzyme activity and autonomic regulation in heart failure[J]. Am J Physiol Heart Circ Physiol,2004,287(5):H2138 -H2146.
[4] Ferguson AV,Latchford KJ,Samson WK.The paraventricular nucleus of the hypothalamus - a potential target for integrative treatment of autonomic dysfunction[J]. Expert Opin Ther Targets,2008,12(6):717 -727.
[5] 楊世方,凌亦凌,戴鴻雁,等.八肽膽囊收縮素對正常及腦缺血大鼠大腦皮層NO 水平的調節[J].中風與神經疾病雜志,2003,20(2):103 -106.
[6] Wang RJ,Zeng QH,Wang WZ,et al. GABAAand GABABreceptor-mediated inhibition of sympathetic outflow in the paraventricular nucleus is blunted in chronic heart failure[J]. Clin Exp Pharmacol Physiol,2009,36(5 -6):516 - 522.
[7] Zhu GQ,Gao L,Li Y,et al.AT1receptor mRNA antisense normalizes enhanced cardiac sympathetic afferent reflex in rats with chronic heart failure[J].Am J Physiol Heart Circ Physiol,2003,287(4):H1828 -H1835.
[8] Zheng H,Li YF,Wang W,et al. Enhanced angiotensin -mediated excitation of renal sympathetic nerve activity within the paraventricular nucleus of anesthetized rats with heart failure[J].Am J Physiol Regul Integr Comp Physiol,2009,297(5):R1364 -R1374.
[9] Gao L,Wang WZ,Wang W,et al.Imbalance of angiotensin type 1 receptor and angiotensin II type 2 receptor in the rostral ventrolateral medulla[J]. Hypertension,2008,52(4):708 -714.

