對強堿弱酸鹽溶液酸堿性的探究
王光榮
(蚌埠學院應用化學與環境工程系,安徽 蚌埠 233030)
對強堿弱酸鹽溶液酸堿性的探究
王光榮
(蚌埠學院應用化學與環境工程系,安徽 蚌埠 233030)
為了解強堿弱酸鹽溶液的酸堿性,運用酸堿質子理論進行理論分析,并使用pH計對該類鹽溶液的pH值進行驗證。結果表明,強堿弱酸鹽溶液濃度C=0.10mol/L時,一元強堿與一元弱酸生成的正鹽溶液均呈堿性;一元強堿與多元弱酸生成的酸式鹽中,偏向于給予質子(H+)的強堿弱酸酸式鹽溶液呈酸性,偏向于接受質子(H+)的強堿弱酸酸式鹽溶液呈堿性;一元強堿與多元弱酸生成的正鹽水溶液均呈堿性。
強堿弱酸鹽;酸堿性;探究
強堿弱酸鹽是強堿和弱酸反應生成的鹽,關于強堿弱酸鹽水溶液的酸堿性,在我國全日制高中化學教材中是這樣闡述的:“在一般情況下,強堿弱酸鹽的水溶液呈堿性……”[1],這里所說的“一般情況下”是指什么情況?該類鹽的水溶液是否都呈堿性?針對該問題,筆者運用酸堿質子理論對強堿弱酸鹽水溶液的酸堿性進行理論分析,并使用pH計對這類鹽溶液的pH值進行驗證。
1 強堿弱酸鹽水溶液pH值計算
1.1一元強堿與一元弱酸完全中和生成正鹽水溶液
該類鹽在溶液中只能接受質子(H+),例如,NaAc、HCOONa、C6H5COONa、NaF等。現以濃度C=0.10mol/L的NaAc溶液為例,對該類正鹽溶液的酸堿性進行分析。
已知,HAc的解離常數為KHAc=10-4.74,NaAc水解反應式為:


式中,Kb為Ac-的解離常數;Kw為水的離子積。
由于:


同理可以算出其他一元強堿與一元弱酸完全中和生成正鹽的水溶液的pH值,運用歸納法可以得出一個普遍性結論,即一元強堿與一元弱酸完全中和生成正鹽水溶液均呈堿性。
1.2一元強堿與多元弱酸生成的鹽水溶液
1)強堿弱酸酸式鹽 該類鹽在溶液中既能給予質子(H+)又可以接受質子(H+),屬于兩性物質,具體包括2類鹽:①偏向于給予質子(H+)的強堿弱酸酸式鹽。②偏向于接受質子(H+)的強堿弱酸酸式鹽。
以0.10mol/L NaH2PO4溶液的pH值計算為例,對①類酸式鹽溶液的酸堿性進行分析。已知H3PO4的解離常數Ka1=10-2.12,Ka2=10-7.20,Ka3=10-12.36,NaH2PO4為兩性物質,其給質子(H+)能力強于接受質子(H+)的能力。
由于:


圖1 磷酸溶液中各種存在形式的分布系數與溶液pH的關系曲線
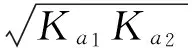
以0.10mol/L Na2HPO4水溶液pH值計算為例,對②類酸式鹽溶液的酸堿性進行分析。Na2HPO4也是兩性物質,但是其受質子(H+)能力強于給質子(H+)的能力。由于:

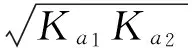
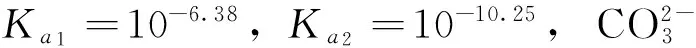

由于Kb1?Kb2,可按一元弱堿計算。
又由于:


2 強堿弱酸生成的鹽的水溶液pH值的測定
分別配制0.10mol/L的各種強堿弱酸鹽溶液100.00ml,使用pHS-2C型酸度計對其pH值進行測定,并將測定結果與計算值進行比較,結果如表1所示。

表1 各種強堿弱酸鹽溶液pH值計算值與測定值比較
由表1可知,一元強堿與一元弱酸完全中和生成正鹽水溶液呈堿性;一元強堿與多元弱酸生成的酸式鹽中,偏向于給予質子(H+)的強堿弱酸酸式鹽溶液呈酸性,偏向于接受質子(H+)的強堿弱酸酸式鹽溶液呈堿性,對于一元強堿與多元弱酸生成的正鹽水溶液呈堿性。
[1]人民教育出版社化學室.全日制普通高級中學化學教科書[M].北京:人民教育出版社,2005.
[2] 華東理工大學分析化學教研組.分析化學[M].北京:高等教育出版社,2010.
[編輯] 李啟棟
10.3969/j.issn.1673-1409.2011.11.017
N4
A
1673-1409(2011)11-0052-03

