一個具有大Stokes位移的苯并噻唑類pH熒光探針
劉 超 孫 輝 楊曉亮 何衛江
(南京大學化學化工學院,南京 210093)
一個具有大Stokes位移的苯并噻唑類pH熒光探針
劉 超 孫 輝 楊曉亮 何衛江*
(南京大學化學化工學院,南京 210093)
本文通過乙烯基將作為熒光團的苯并噻唑與作為H+受體的4-吡啶基橋聯構筑了一個基于分子內電荷轉移機制的pH熒光探針BTP2。研究表明該探針的Stokes位移為237 nm,遠大于相應2-吡啶基類似物BTP1。滴定實驗表明該探針的熒光在pH 3.80至5.50之間隨pH值增大而增強,且不受其他金屬離子的干擾,具有檢測胞內酸性細胞器pH的良好前景。探針pKa為4.72,略高于BTP1。4-吡啶基連接導致的更大的Stokes位移表明調節吡啶連接位置可以實現對該類探針分子Stokes位移的調控。
苯并噻唑;pH;Stokes位移;熒光探針
pH值不僅對物質的物化性質及其反應性能有明顯的影響,而且在生命體系中也有重要功能。一方面細胞內pH值在細胞增殖和凋亡[1-2]、離子運輸[3-4]、內吞[1]和肌肉收縮[5-6]等生理過程中都起著重要的作用。另一方面,pH值的變化同樣會通過間隙連接和信號通路等影響突觸傳遞、神經細胞興奮性和細胞間耦合等神經系統活動[7-8]。細胞內pH值與細胞功能的密切關系意味著對細胞內pH值的精確測量可以為研究小至單個細胞器的生理學和病理學過程提供關鍵信息[9]。所以,監測細胞內pH值的動態變化對于理解細胞內許多生理功能的機制有著重要的作用[10]。
自Robert Boyle發現石蕊試液具有隨pH值變化發生顏色變化的特性以來,各種酸堿指示劑如酚酞、甲基橙以及相關pH試紙得到了廣泛的應用。這種比色檢測pH值的方法便捷有效,也有較高靈敏度,因此時至今日仍有許多新型pH比色指示劑的報道[11-13]。但是比色法也存在著明顯的缺點,無法應用到生命體系進行活體細胞造影。另外,比色法的靈敏度較低,而生命體系要求能檢測到微小的pH變化,比如細胞中0.10~0.20個單位pH的擾動就會造成心肺和神經方面的疾病如阿爾茨海默綜合癥[14-16]以及其他致命的變異[17]。由于熒光探針法具有快速實時響應、對細胞無損傷以及對pH響應靈敏性高等優點,利用熒光探針法對細胞內pH變化進行檢測已引起人們的廣泛興趣[18-19]。目前報道的許多pH熒光探針的Stokes位移較小[20-21],在造影時容易受到激發光的干擾。因此,具有較大Stokes位移的pH熒光探針在生物和化學等方面都具有極大的潛在應用價值。
Stokes位移是分子探針的重要參數,較大的Stokes位移有利于克服激發在熒光造影中的干擾。多種機制可能使分子具有大的Stokes位移,如pH熒光探針1的Stokes位移為118 nm[22],主要是由于激子發射導致了較大的Stokes位移。分子內電荷轉移(intramolecular charge transfer,ICT)效應也可以增大熒光分子的Stokes位移。許多文獻報道了利用ICT效應獲得具有大Stokes位移的離子熒光探針[23-27],一般Stokes位移都大于100 nm,其中探針2的Stokes位移更是達到200 nm左右[27]。這一報道顯示了ICT熒光團在構建大Stokes位移探針分子方面的優勢。我們課題組利用乙烯基橋聯熒光團苯并噻唑和作為質子受體吡啶來構建了pH熒光探針BTP1[22]。該分子中在苯并噻唑熒光團上的N,N-二甲基結構作為電子給體,噻唑/吡啶作為電子受體,使 BTP1 具有 D(donor,給體)-π-A(acceptor,受體)的結構特點,其ICT效應使得分子具有較大的Stokes位移(199 nm)[22],有利于減少造影過程中激發光的干擾。這里我們用4-吡啶結構作為H+受體替代了原來的2-吡啶結構構建了新的pH探針BTP2,希望4-吡啶結構導致的分子極性方向變化可以有效改變分子的D-π-A效應,實現Stokes位移的調控,更好地克服激發光的干擾。這一研究有利于發現通過改變D/A推拉電子能力而調節Stokes位移策略之外的新途徑。

1 實驗部分
1.1 試劑與儀器
常用藥品與試劑均為國產分析純試劑,使用前未做進一步純化。光譜性質測試中所用溶劑如甲醇等為光譜純試劑,購自Aldrich公司。水為MILLIPORE系統處理過的超純水。電噴霧質譜用LCQ Fleet電噴霧質譜儀 (ESI-MS,Thermo Finnigan)測定,并用ISOPRO 3.0程序模擬其同位素分布模式。1H-,13C-NMR在Bruker DRX 500型超導核磁共振儀上用標準脈沖序列測定 (298 K)。紫外光譜用UV3600型紫外-紅外分光光度計測定。熒光光譜在FS_LS55發光光譜儀上測定。pH值用PHS-3精密pH計記錄。
1.2 探針的合成和表征
探針BTP2的合成路線如式1所示。6-N,N-二甲基氨基-2-甲基苯并噻唑根據文獻方法[22]合成得到。分別稱取一定量的6-N,N-二甲基-氨基-2-甲基苯并噻唑(0.259 g,1.35 mmol)和 4-吡啶甲醛(0.159 g,1.48 mmol)到 50 mL 圓底燒瓶中,加入 6 mL DMF后攪拌溶解。加入 KOH 固體粉末 (0.378 g,6.75 mmol)后室溫攪拌反應24 h。TLC跟蹤確認完全反應后向反應液中加入H2O(5 mL),混合溶液用CH2Cl2萃取(10 mL×3)。合并的有機相經無水硫酸鎂干燥后,減壓脫溶獲得紅色固體。硅膠柱層析分離(V乙酸乙酯/V二氯甲烷=1/10)后得橙紅色固體產物 0.12 g,收率32%。

1.3 BTP2的光譜性質測試
BTP2用光譜純MeOH配成5 mmol·L-1儲備液放置于4℃冰箱中備用。取BTP2儲備液用光譜純MeOH 和 HEPES 緩沖溶液(50 mmol·L-1,100 mmol·L-1KNO3,pH=7.20)稀釋成 5 μmol·L-1的溶液(VMeOH/VHEPES=1/9),然后分別測定熒光光譜和紫外-可見吸收光譜。以硫酸奎寧作為基準物[28],測量BTP2的量子產率。測定所用溶液濃度以使對應熒光激發波長處吸光度小于0.05為準。硫酸奎寧以0.05 mol·L-1硫酸溶解稀釋,BTP2則在 MeOH/HEPES體系(VMeOH/VHEPES=1/9,50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH=7.20)中測量。硫酸奎寧的熒光發射光譜在358 nm波長激發下測定,BTP2則以378 nm波長的激發光激發。分別測量得到兩個溶液的紫外-可見吸收光譜與熒光光譜后,將數據代入如下公式進行計算[29]:

公式中下標R與S分別代表基準物與樣品,Фf表示量子產率,F表示化合物溶液熒光發射光譜的積分面積,A表示相應激發波長處的吸光度,n為樣品溶液的折射系數。
BTP2的pH滴定實驗在MeOH/H2O體系(VMeOH/VH2O=1/9)中進行。儲備液用光譜純MeOH和MILLIPORE處理過的H2O稀釋,加入不同體積的HCl和NaOH水溶液調節pH,最后混合溶液濃度都為5 μmol·L-1。每次加完充分混合后先用pH計測量溶液pH,再進行熒光光譜測試或紫外-可見吸收光譜測試 (參比溶液為空白的MeOH/H2O溶液,VMeOH/VH2O=1/9)。
金屬離子干擾實驗在MeOH/HEPES體系(VMeOH/VHEPES=1/9,50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH=7.20)中進行。實驗中探針最終濃度為5 μmol·L-1,堿金屬、堿土金屬濃度為化合物濃度的1000倍,其余金屬離子濃度與化合物濃度相等。充分混勻后進行光譜測試。
2 結果與討論
2.1 BTP2的吸收和發射光譜
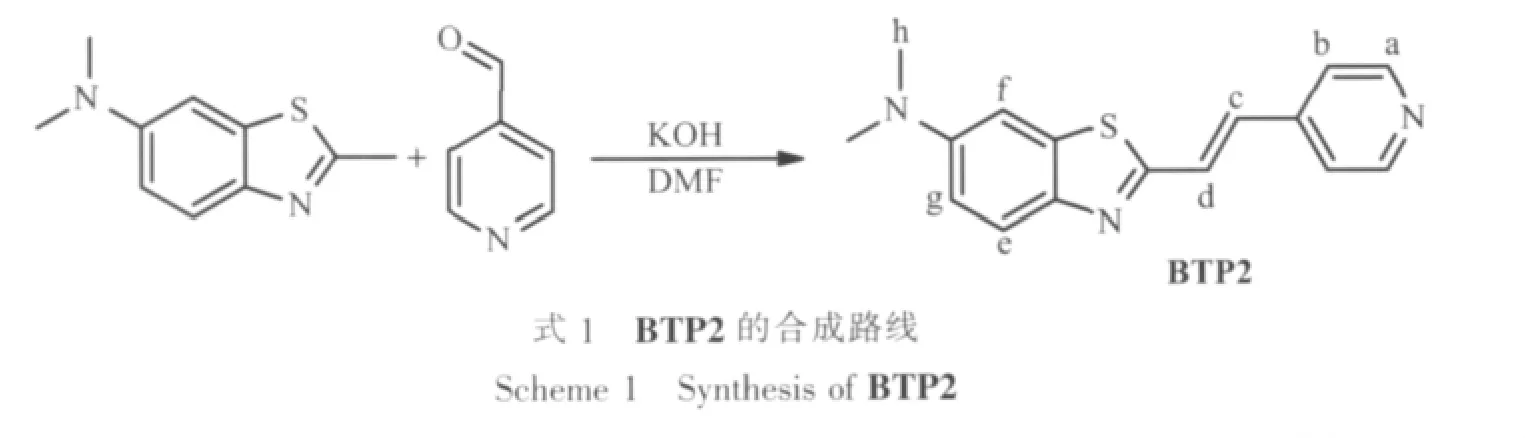
首先在MeOH/HEPES(VMeOH/VHEPES=1/9,50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH=7.20)溶液中研究了 BTP2(5 μmol·L-1)的光譜性質。紫外-可見光譜研究表明BTP2在中性條件下的最大吸收峰為388 nm左右,該吸收峰應該是由于苯并噻唑的π-π*躍遷引起的。熒光光譜測試結果表明BTP2在中性條件下的最大發射波長和最大激發波長分別為615 nm和378 nm左右,Stokes位移達到237 nm,遠大于BTP1中的199 nm,也大于大部分探針分子的Stokes位移,有利于熒光探針在細胞造影中的實際應用。顯然4-吡啶結構的引入,有效地調整了分子極性方向,有利于熒光增大分子內的電荷轉移效應,增大了Stokes位移。這說明分子極性方向同分子電荷轉移方向的一致能進一步穩定激發態分子,增大Stokes位移,這顯然為該類分子通過調節吡啶連接位置調控Stokes位移克服激發干擾提供了新思路。另一方面,利用硫酸奎寧作為基準物質,測量得到BTP2的量子產率為0.062。
2.2 BTP2的pH熒光滴定與紫外-可見光滴定
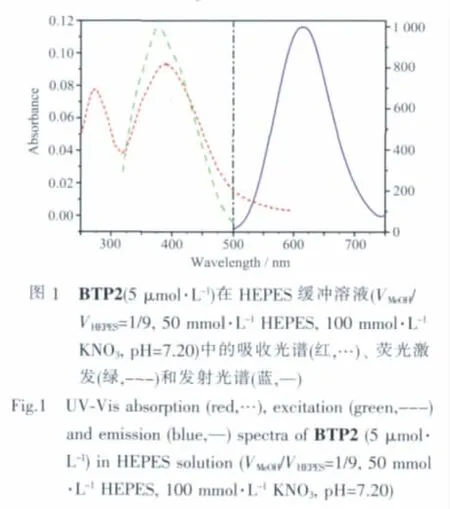
BTP2的熒光pH滴定在含有10%(V/V)甲醇的水溶液中進行,使用的激發波長為378 nm。從圖2b所示結果可以看出,當pH值高于3以上時,熒光強度逐漸增強。更高的pH值導致熒光迅速增強,但pH<3.80 時 BTP2 的熒光強度仍然較弱。在 pH>5.50時熒光增加已較小,如從pH 5.50升至pH 5.70,熒光增強僅有~6%左右。在pH>6.0時,熒光強度已沒有明顯變化。取pH分別為3.07和5.50時在615 nm處的熒光強度做比較,增強倍數超過100倍,即使以pH分別為3.77和5.50時615 nm處的熒光強度做比較,增強倍數仍超過30倍。在整個pH滴定過程中,最大激發波長和最大發射波長并未發生移動。利用615 nm處的熒光強度對pH作圖,并用Henderson-Hasselbach方程進行曲線擬 合[30],得到BTP2的pKa值為4.72,與溶酶體等酸性細胞器的pH值接近,說明BTP2具有檢測溶酶體內pH變化的潛在應用前景。

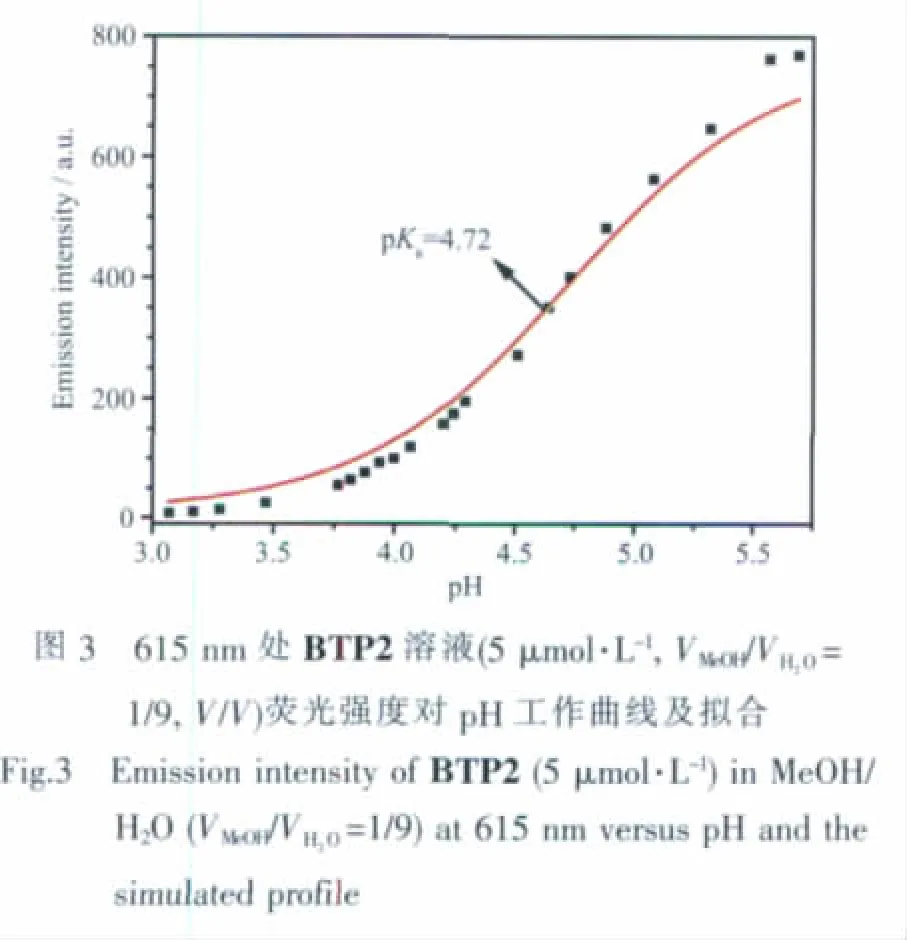
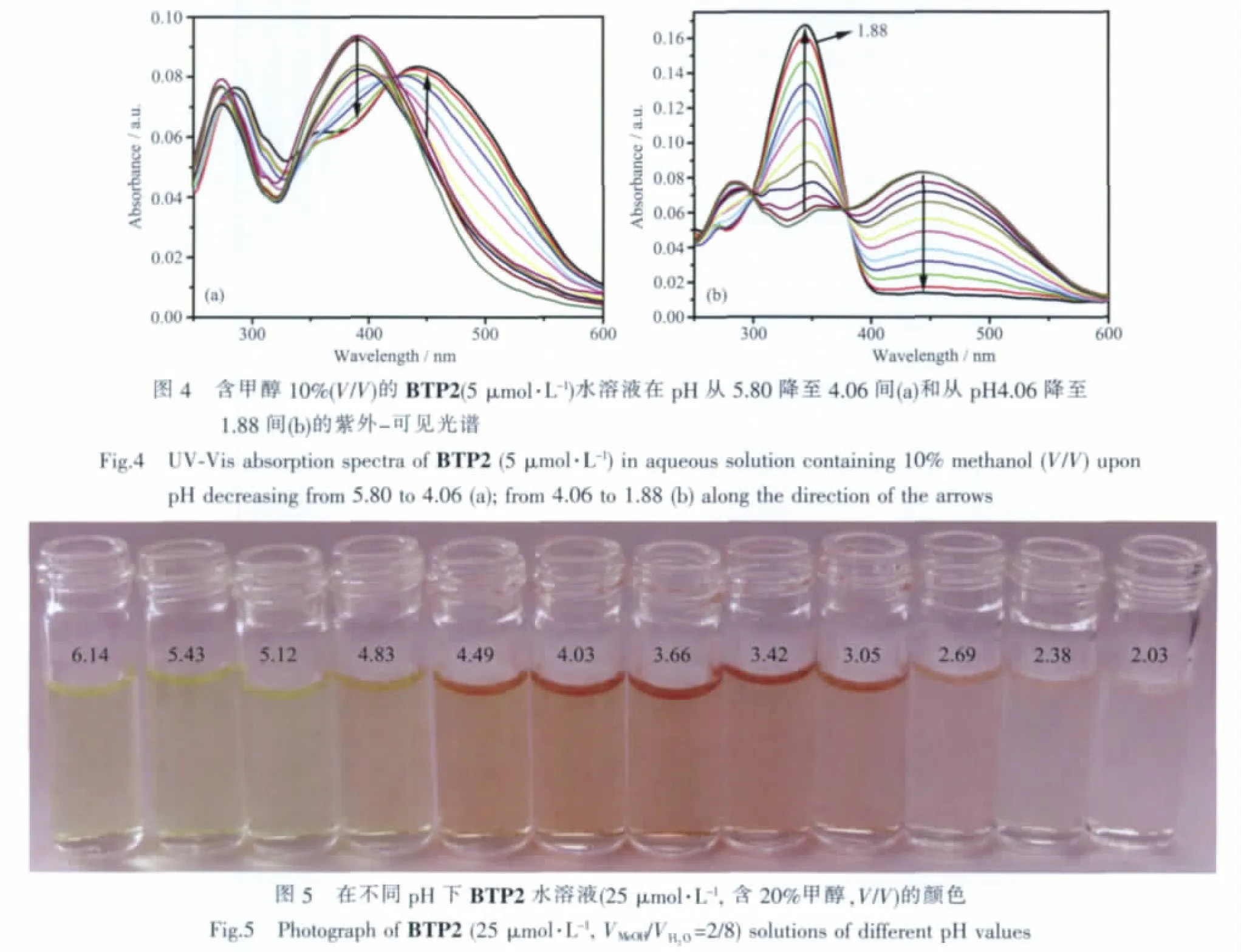
BTP2的紫外-可見吸收光譜受pH變化影響相對比較復雜(圖 4)。在 pH>5.5時,紫外-可見吸收峰略有增強,在pH 6.00以上則基本不變,這種pH效應類似于其熒光在該pH范圍內的變化趨勢。當pH 逐漸從 5.5 減小到 4.06 時,388 nm 處的 π-π*躍遷峰吸收強度逐漸減弱,而443 nm處的吸收峰逐漸出現并升高。在此過程的等色點表明了1個質子化過程。pH值繼續降低時443 nm處的吸收峰逐漸減弱,并在345 nm處出現1個新的吸收峰,pH降到1.88左右,443 nm處吸收峰完全消失。在這一過程中,在300 nm和380 nm處出現2個等消光點,表明在這一階段的pH變化過程中,也只有1個質子化反應發生。伴隨著BTP2復雜的紫外-可見光譜變化的是溶液隨pH變化的溶液顏色。由圖5所示BTP2溶液變化可以看出,在近中性條件下,BTP2溶液為黃色,pH降至5.12左右,溶液顏色一直無明顯變化,pH進一步降低,溶液顏色開始變紅,直至pH為4.03左右時,溶液顏色達到最深,然后隨著pH的繼續降低,溶液顏色變淡,直至無色。這一變化過程與紫外-可見吸收光譜體現的2個接近相反的變化過程是一致的。這顯示BTP2還有一定的pH比色傳感的能力。根據BTP1的質子化過程,對于BTP2我們可以推測存在2個質子化過程:首先是pH 5.5到pH 4.06間的吡啶氮質子化過程,該過程增強了分子拉電子區域的拉電子效應,使得ICT吸收帶明顯紅移。在pH 4.06到pH 1.88這一過程中,N,N-二甲基被質子化,導致該基團的給電子能力急劇下降,ICT帶接近消失,而芳香環本身的 π-π* 吸收帶逐漸明顯。 從 pH 5.5~7.4 之間熒光和紫外光譜變化來看,BTP2的量子產率在此區間變化不大。另一方面,在探針pH響應范圍pH 3.8~5.5之間量子產率隨 pH明顯上升,通過測定pH 5.5 和 pH 7.2 紫外和熒光光譜進行計算,pH 5.5時的量子產率為0.044。
2.3 BTP2與H+結合方式
為了進一步研究BTP2與H+的作用方式,我們對BTP2在不同的pH(pH=pD-0.4)[31]下進行了核磁滴定實驗。BTP2用CD3OD與D2O的混合溶劑溶解,以DCl與NaOD調節pH。圖6所示BTP2的核磁滴定圖中,氫質子信號相應歸屬已據式1直接標注其上。可以看出BTP2的所有質子在pH高于5.01時位移無明顯變化,當 pH 從 5.01降到 3.91時,吡啶質子Ha和Hb以及近吡啶烯鍵質子Hc信號均向低場發生了明顯的移動,Ha從 8.56移動到8.60 ppm,Hb從 7.66(信號與雙鍵 Hc重合)左右移動到7.77 ppm。Hc的核磁信號也從7.66左右移動到了7.72 ppm,其他氫質子信號皆無明顯變化。這一結果說明在此pH變化過程中僅吡啶環上的N原子發生了質子化。這也與紫外滴定過程是一致的。pH從3.91繼續下降到2.49,所有的氫質子信號都開始向低場移動,Ha從8.60移動到8.72 ppm,Hb從7.77移動到8.17 ppm,Hc從7.72移動到7.95 ppm,Hd從7.41移動到7.54 ppm,He從7.81移動到7.87 ppm,Hf從 7.21移動到 7.29 ppm,Hg從 7.07移動到7.14 ppm,Hh從3.06移動到3.10 ppm。在這一個pH變化過程中雖然吡啶環以及橋聯雙鍵上的氫質子信號變化仍然較大,不同的是N,N-二甲氨基上的氫質子信號也發生了明顯變化。我們推測是N,N-二甲氨基發生質子化,一方面使得直接相連的鄰位甲基質子化學位移向低場移動,同時由于N,N-二甲氨基上由給電子基經質子化轉為拉電子基,使得整個共軛體系的電子云密度下降,因此吡啶和乙烯基上的質子信號同樣向低場移動。結合熒光光譜對pH的變化可知,在pH從5.50降至3.77時過程中主要是吡啶N原子的質子化導致了熒光隨pH降低而逐漸淬滅,這與文獻報道過的情況相一致[32]。pH繼續下降則導致N,N-二甲氨基徹底質子化,整個分子不再具有D-π-A結構,不再具有分子內電荷轉移效應,因此熒光幾近于消失。
2.4 BTP2對H+的選擇性響應研究
一個具有良好響應性能的pH探針在實際應用到細胞或環境中,應該不受體系其他因素的干擾,比如不受金屬離子的干擾。對此,我們在MeOH/HEPES 體系 (VMeOH/VHEPES=1/9,50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH=7.20) 的混合溶液中 ,對BTP2與各種金屬離子響應性能進行了研究。實驗結果顯示 (圖7),溶液中與BTP2等濃度的Ag+、Cd2+、Co2+、Cu2+、Fe2+、Fe3+、Mn2+、Ni2+、Pb2+和 Zn2+等過渡金屬離子的存在不會對BTP2的熒光產生明顯的影響,因此不會對其pH熒光響應性能產生干擾。另外細胞中具有較高濃度的 K+、Na+、Ca2+和 Mg2+等堿金屬和堿土金屬離子即使在過量1000倍的濃度情況下,也不會對BTP2的熒光產生明顯的改變。因此細胞中的這些高濃度離子同樣不會對BTP2的pH響應能力產生干擾。顯然BTP2和BTP1一樣具有良好的pH響應專一性,符合應用到細胞內檢測pH變化的要求。

3 結 論
利用乙烯基將苯并噻唑熒光團與4-吡啶環橋聯,得到了一個具有D-π-A結構的熒光探針BTP2。該探針的pKa為4.72,熒光在pH 3.8到5.5的變化范圍內隨pH增大而增強,并且常見金屬離子的存在不會對其pH響應性能造成干擾,適用于胞內酸性環境如溶酶體等的pH檢測。該探針具有比相應2-吡啶類似物BTP1更大的Stokes位移,可以更好地克服激發光的干擾,同時也表明該類探針分子可以通過調節橋聯吡啶連接位置來調節其Stokes位移。探針的量子產率雖然不高,但利用當前日臻成熟的造影設備已經可以輕松實現細胞造影。本研究同時表明利用ICT熒光團構建各類熒光探針時必須考慮推拉電子基團的位置,以獲得較大的分子極性,促進光致電荷轉移,獲得較大的Stokes位移,降低激發在造影中的干擾。
[1]Gottlieb R A,Nordberg J,Skowronski E,et al.Proc.Natl.Acad.Sci.U.S.A.,1996,93(2):654-658
[2]Gottlieb R A,Dosanjh A.Proc.Natl.Acad.Sci.U.S.A.,1996,93(8):3587-3591
[3]Montrose M H,Friedrich T,Murer H J.J.Membr.Biol.,1987,97(1):63-78
[4]Liang E,Liu P C,Dinh S.Int.J.Pharm.,2007,338(1/2):104-109
[5]Bullock A J,Duquette R A,Buttell N,et al.Pfluegers Arch.,1998,435(4):575-577
[6]Chin E R,Allen D G.J.Physiol.,1998,512(3):831-840
[7]Yuli I,Oplatka A.Science,1987,235(4786):340-342
[8]Chesler M.Phys.Rev.,2003,83(4):1183-1221
[9]Han J Y,Burgess K.Chem.Rec.,2010,110(5):2709-2728
[10]Srivastava J,Barber D L,Jacobson M P.Physiology,2007,22:30-39
[11]Wong K M C,Tang W S,Lu X X,et al.Inorg.Chem.,2005,44(5):1492-1498
[12]Capel-Cuevas S,Cuellar M P,de Orbe-Paya I,et al.Microchem.J.,2011,97(2):225-233
[13]Lee H Y,Tiwari K R,Raghavan S R.Soft Matter,2011,7(7):3273-3276
[14]Davies T A,Fine R E,Johnson R J.Biochem.Biophys.Res.Commun.,1993,194(1):537-543
[15]Mogensen H S,Beatty D M,Morris S J,et al.Neuroreport,1998,9(7):1553-1558
[16]Lagadic-Gossmann D,Rissel M,Galisteo M,et al.Br.J.Pharmacol.,1999,128(8):1673-1682
[17]Cogan M G.Fluid and Electrolytes.Norwalk,CT:Appleton and Lange-Prentice Hall Publishers,1991.
[18]Thomas J A,Buchsbaum R N,Zimniak A,et al.Biochemistry,1979,18(11):2210-2218
[19]Tang B,Yu F,Li P,et al.J.Am.Chem.Soc.,2009,131(8):3016-3023
[20]Zheng M H,Jin J Y,Sun W,et al.New J.Chem.,2006,30(8):1192-1196
[21]Urano Y,Asanuma D,Hama Y,et al.Nat.Med.,2009,15(1):104-109
[22]Shiraishi Y,Tokitoh Y,Nishimura G,et al.Org.Lett.,2005,7(13):2611-2614
[23]Liu Z P,Zhang C L,He W J,et al.New J.Chem.,2010,34(4):656-660
[24]Kim T,Kang H J,Han G,et al.Chem.Commun.,2009(39):5895-5897
[25]Nguyen D M,Frazer A,Rodriguez L,et al.Chem.Mater.,2010,22(11):3472-3481
[26]Kovalchuk A,Bricks J L,Reck G,et al.Chem.Commun.,2004(17):1946-1947
[27]Yao S,Schafer-Hales K J,Belfield K D.Org.Lett.,2007,9(26):5645-5648
[28]Parker C A,Rees W T.Analyst,1960,85(1013):587-600
[29]Lakowicz J R.Principle of Fluorescence Spectroscopy.New York:Klumer Academic,1999:52-53
[30]Zhang Z,Achilefu S.Chem.Commun.,2005:5887-5889
[31]Covington A K,Paabo M,Robinson R A,et al.Anal.Chem.,1968,40(4):700-706
[32]Kim J M,Chang T E,Kang J H,et al.Angew.Chem.Int.Ed.,2000,39(10):1780-1782
A New Benzothiazole-Derived pH Fluorescent Sensor of Large Stokes Shift
LIU Chao SUN HuiYANG Xiao-Liang HE Wei-Jiang*
(State Key Laboratory of Coordination Chemistry,School of Chemistry and Chemical Engineering,Nanjing University,Nanjing 210093,China)
A new intramolecular charge transfer pH fluorescent sensor BTP2 was constructed by vinyl bridging benzothiazole fluorophore with the H+acceptor,4-pyridyl group via a vinyl group.Emission spectroscopic study disclosed that this new compound has a Stokes shift of 237 nm,which is much larger than that of its analogue BTP1 of 2-pyridyl group.Titration experiment indicated that the emission of BTP2 increases with pH in the pH range from 3.80 to 5.50.Moreover,this pH sensing ability is not interfered by the coexisting metal cations,which provides BTP2 the potential for intracellular pH imaging of acidic organelles.Its pKais around 4.72,slightly larger than that of BTP1.The 4-pyridyl group induced larger Stokes shift implies that altering the bridging site of pyridyl group might be an effective means to regulate the Stokes shift of these pH probe.
benzothiazole;pH;Stokes shift;fluorescent sensor
O
A
1001-4861(2011)11-2121-07
2011-00-00。收修改稿日期:2011-00-00。
國家自然科學基金(No.20871066、10979019、21021062)、國家重大基礎研究發展計劃項目(No.2011CB935800)、江蘇省自然科學基金(No.BK2009227)和中央高校基本科研業務費專項資金資助項目。
*通訊聯系人。 E-mail:heweij69@nju.edu.cn

