含鉍配合物與奈瑟氏菌鐵結合蛋白的反應性質研究
曾 旭 葉丹榮 林德昌 江海龍 李 敏 羅 俊 仲維清
(第二軍醫大學藥學院,上海 200433)
含鉍配合物與奈瑟氏菌鐵結合蛋白的反應性質研究
曾 旭 葉丹榮 林德昌 江海龍 李 敏 羅 俊*仲維清*
(第二軍醫大學藥學院,上海 200433)
鐵結合蛋白(Fbp)是致病菌獲取Fe3+的關鍵蛋白。本文采用氨三乙酸(H3NTA)和硝酸鉍反應制備BiNTA·2H2O,并運用元素分析、NMR等手段進行表征。通過在大腸桿菌中克隆表達和分離純化出奈瑟氏淋病雙球菌的Fbp,測定不同計量比nBiNTA/napo-Fbp下反應的紫外可見光譜,確定BiNTA與apo-Fbp的反應為一級反應,反應速率常數約為(0.175±0.064)min-1(10 mmol·L-1Hepes/HPO42-pH 7.4緩沖溶液,310 K)。NH4BiCit與apo-Fbp的反應也為一級反應,反應速率與BiNTA相近。Bi3+與apo-Fbp的飽和結合計量比為 1∶1,形成三元配合物 Fbp-Bi-NTA 的結合常數(lgK)為(21.43±0.20),形成 Fbp-Bi-Cit的結合常數(lgK)為(16.03±0.03)。 實驗結果表明,致病菌中運輸Fe3+的蛋白鐵結合蛋白可作為含鉍抗菌藥物的潛在靶分子。
鐵結合蛋白;鉍配合物;反應速率常數;結合常數
0 引 言
Bi3+是人體非必需元素,但Bi3+的化合物由于其毒性較低而廣泛應用于各種微生物的感染性臨床治療,如檸檬酸鉍鉀是麗珠得樂、雷尼替丁麗珠得樂的有效成分,它和膠體次檸檬酸鉍等含鉍化合物是治療胃潰瘍等疾病的首選藥物,能有效殺滅幽門螺旋桿菌[1-2],此外Bi3+還具有抗癌及抗病毒的作用[3-5]。研究表明,在使用順鉑治療癌癥前服用鉍制劑,可降低順鉑的毒副作用而不影響其療效[6]。Bi3+能與血清傳鐵蛋白(serum transferrin,Tf)牢固而可逆地結合,在影響其生理功能方面具有重要作用[7],但鉍化合物的抗菌、抗腫瘤機制仍不清楚,還有待進一步研究。
鐵結合蛋白(ferric-ion binding protein,Fbp)是革蘭氏陰性奈瑟氏等菌屬表達的并在細胞周質中傳遞Fe3+的蛋白[8-9]。致病菌細胞外膜上的傳鐵蛋白受體(TfbA/B)結合宿主 Tf或 Lf(lactoferrin,乳傳鐵蛋白)后,Fbp(即 FbpA)從 Tf或 Lf獲取 Fe3+并載著 Fe3+通過細胞周質,在質膜FbpB和FbpC的協同作用下將Fe3+透過細胞質膜傳運到胞液中[10]。所以,Fbp與致病菌獲取鐵、繁殖和毒性作用密切相關,是整個鐵傳遞體系的樞紐。不同菌屬(如奈瑟氏菌屬、放線桿菌菌屬、嗜熱桿菌菌屬等)的Fbp的氨基酸序列和結構具有高度保守性。奈瑟氏菌屬 (如Neisseria gonorrhoeae)的Fbp含309個氨基酸,分子量約34 kDa,每個 Fbp 分子分別通過 His9、Glu57、Tyr195 和Tyr196與一個Fe3+結合,另有一個磷酸根作為協同陰離子以及一個水分子作為第六配體[8]。Fe3+與Fbp的結合常數約為 2.4×1018L·mol-1(0.35 mmol·L-1pH 6.5 磷酸鹽緩沖液,298 K)[11],但 Fe3+的結合位點也可被其它金屬離子所占據,從而使Fbp成為其它金屬類抗菌藥物的潛在靶分子[12-13]。
本文重點考察了氨三乙酸根合鉍、檸檬酸鉍銨與脫鐵鐵結合蛋白(apo-Fbp)的反應動力學性質和結合常數,為確定含Bi3+配合物與Fbp的作用機制及抗菌機理積累實驗依據。
1 實驗部分
1.1 試劑及主要儀器
檸檬酸、氨三乙酸(nitrilotriacetic acid,H3NTA)、檸檬酸鉍銨 (NH4BiCit)、Hepes(4-(2-hydroxyethyl)-1-piperazineethane-sulfonate acid)、鉍原子吸收標準溶液(980 μg Bi/mL,5%wt HNO3)、cocktail蛋白酶抑制劑、溴化十六烷基三甲基銨 (CTAB),購自Sigma-Aldrich,其它都為市售分析純。
臺式pH計(ORION 828型),電子天平(FA2104S型),Z323K 超速冷凍離心機(HERMLE),EC-13超級恒 溫 儀 (Julabo), 超 濾 離 心 管 (YM-10,Amicon),Lambda25紫外分光光度計(Perkin-Elmer),精密移液器 (Gilson),AKTA FPLC快速蛋白液相色譜系統(Pharmacia)。
1.2 實驗方法
1.2.1 脫金屬鐵結合蛋白(apo-Fbp)的制備
鐵結合蛋白(holo-Fbp)的表達、純化參考文獻方法[11-14]。用質粒PTRC99A/FBP/Ng(由英國Edinburgh大學Dr.Campopiano惠贈)轉染E.Coli Top10感受態細胞,挑取單克隆菌株在含100 g·mL-1氨芐青霉素的LB培養液(胰蛋白胨10 g,酵母抽提物5 g,氯化鈉10 g,溶解于1 L蒸餾水,高壓滅菌)中310 K下振蕩培養。277 K下離心收集菌體,253 K溫度下保存備用。解凍菌體,取約6 g菌體,在100 mL 0.5 mol·L-1pH 8.0 Tris-Cl緩沖溶液/1%CTAB 溶液(含1 mL cocktail蛋白酶抑制劑)中破菌,277 K下12000 r·min-1離心,取上清液,用蒸餾水稀釋到1 L。0.22 μm膜過濾后在FPLC系統上經CM23陽離子交換柱用 0~1 mol·L-1NaCl/10 mmol·L-1Tris-Cl緩沖溶液(pH 8.0)梯度洗脫,經SDS-PAGE檢驗后,收集洗脫液中的目標蛋白組分,用10 mmol·L-1pH 8.0 Tris-Cl緩沖液透析除鹽,超濾濃縮后,用Tris-Cl緩沖液經G-75凝膠柱進一步純化,并用SDS-PAGE檢驗,收集純目標蛋白組分,凍干備用。
稱取20 mg holo-Fbp凍干粉,用pH 4.5檸檬酸鈉溶液除去Fe3+(離心超濾法[12-13]),并用10 mmol·L-1Hepes緩沖液(pH 7.4)置換檸檬酸鈉溶液,得 apo-Fbp儲備液。
1.2.2 氨三乙酸根合鉍的制備
氨三乙酸根合鉍(BiNTA)的制備按照文獻的方法[15],精確稱取 0.956 5 g(5 mmol)氨三乙酸(H3NTA)加水 300 mL,加熱至沸,在攪拌下加入 2.4254 g(5.1 mmol)Bi(NO3)3,用NaOH調pH值至4~5,加熱蒸發,過濾得粗品,用水重結晶制得BiNTA·2H2O。
1.2.3 ICP-AES
鉍含量由復旦大學分析測試中心Z-5000電感耦合等離子體原子發射光譜儀(ICP-AES)測定。
1.2.4 apo-Fbp 與 BiNTA 反應動力學研究
向 0.45 mL 10 mmol·L-1Hepes緩沖液 (pH 7.4)中加入20 μL apo-Fbp,以同體積的Hepes緩沖液為參比,于310 K在Lambda25紫外可見分光光度計上測蛋白200~500 nm的光譜,根據其在280 nm的吸收值確定其濃度(ε280=44200 L·mol-1·cm-1)[11]。
向上述測量池中(capo-Fbp=14.8 μmol·L-1)加入磷酸鹽緩沖液(磷酸鹽最終濃度為10 mmol·L-1),再加入 30 μL 4 mmol·L-1BiNTA 溶于 Hepes緩沖溶液的反應液(nBiNTA∶napo-Fbp=20∶1),以含相同濃度的磷酸鹽及BiNTA的Hepes緩沖溶液為參比,310 K恒溫條件下間隔5 min循環掃譜2 h。
以同樣的方法, 測定 nBiNTA∶napo-Fbp為 40∶1、60∶1、100∶1反應液在310 K恒溫條件下的紫外可見光譜。
1.2.5 apo-Fbp與NH4BiCit反應動力學研究
以NH4BiCit代替BiNTA,用相同的方法測定NH4BiCit與 apo-Fbp 的反應動力學,nNH4BiCit∶napo-Fbp=20∶1。
1.2.6 BiNTA、NH4BiCit與Apo-Fbp的滴定反應
每次向測量池和參比池按 nBiNTA∶napo-Fbp=2∶1加入BiNTA溶液,反應平衡后掃譜,至nBiNTA∶napo-Fbp=40∶1后 按 nBiNTA∶napo-Fbp=10∶1 的 量 加 入 BiNTA 溶 液 ,至nBiNTA∶napo-Fbp達到 100∶1。
以NH4BiCit代替BiNTA,采用同樣的方法,測定NH4BiCit與apo-Fbp滴定反應的UV-Vis光譜。
2 結果與討論
2.1 holo-Fbp和 Bi(NTA)2·H2O 純度分析
按上述實驗方法中所表達的holo-Fbp,經CM32陽離子交換柱分離、G75凝膠柱純化后,經SDS-PAGE檢驗,所收集的為純蛋白組分,分子量約為34 kDa,其紫外-可見光譜在280 nm和481 nm出現2個特征峰,分別歸屬于蛋白質中的芳香族的氨基酸色氨酸、酪氨酸和苯丙氨酸存在的π-π*電子躍遷吸收峰和蛋白中酪氨酸結合Fe3+的金屬-配體電荷躍遷 (metal-to-1igand charge transfer,MLCT)吸收峰[16](圖譜略去),與文獻[11-13]報道的一致。所獲得的apo-Fbp僅在280 nm處出現特征吸收峰,表明Fe3+已除去[17]。
所制得的 BiNTA·2H2O,CHN元素分析、ICPAES和 NMR結果顯示為純物質:BiC6H10NO8,Calcd.:C 16.63% ,H 2.31% ,N 3.23% ,Bi 48.27% ;Found:C 16.62%,H 2.33%,N 3.33%,Bi 45.6%;1H NMR:單峰4.43 ppm(自由NTA在3.80 ppm出現單峰)。
2.2 BiNTA、NH4BiCit與apo-Fbp的反應動力學
恒溫310 K條件下,在10 mmol·L-1Hepes/10 mmol·L-1磷酸鹽 pH 7.4 的緩沖液中,按 nBiNTA∶napo-Fbp=20∶1 的比例,向 apo-Fbp(capo-Fbp=14.8 μmol·L-1)中加入BiNTA后,從其紫外-可見光譜中(圖1)發現,開始時紫外區的吸收峰強度隨時間而增強,30 min后吸收值變化較小,反應至60 min左右達平衡。
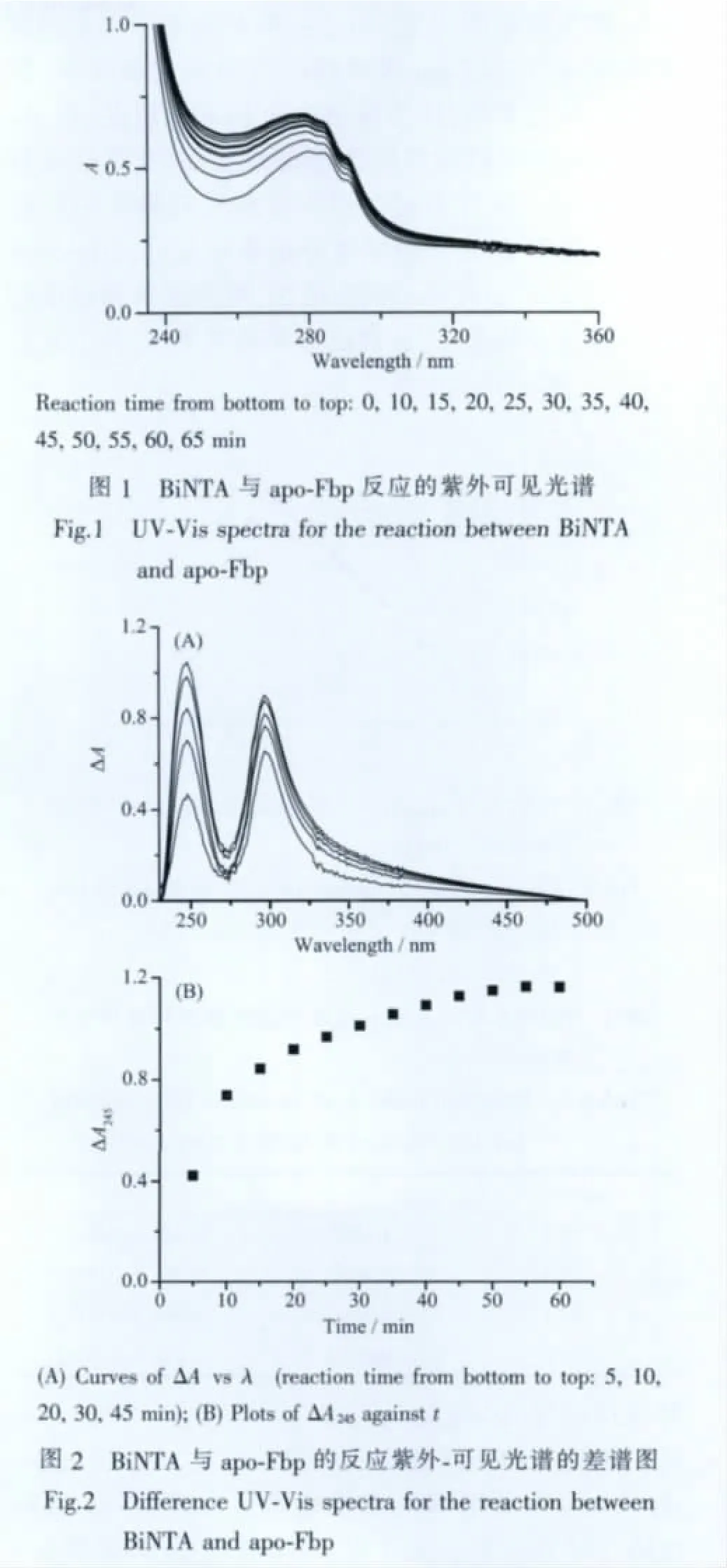
310 K恒溫條件下,BiNTA與apo-Fbp反應的紫外-可見光譜的差譜圖 (反應混合物的光譜減去apo-Fbp 的光譜)如圖 2 所示(capo-Fbp=26.7 μmol·L-1,nBiNTA∶napo-Fbp=100∶1)。 圖中在 245 nm、約 290 nm 附近有一正吸收峰,與 Fe3+、Zr(Ⅵ)、Hf(Ⅵ)、Nb(Ⅴ)等金屬離子鍵合于apo-Fbp的現象相似[11,13,18],也與Bi3+鍵合于Fbp在哺乳動物中的同功能蛋白運鐵蛋白(Tf)的圖譜類似[15]。這兩組特征峰為金屬離子鍵合運鐵蛋白家族蛋白(Fbp、Tf等)中的酪氨酸酚基氧后,產生的配體-金屬電荷遷移譜,顯示Bi3+能鍵合于apo-Fbp中Fe3+的鍵合位點酪氨酸。
在不同濃度比nBiNTA∶napo-Fbp的差譜中,取不同測量時間點在245 nm吸收峰附近的最大吸收值,除以蛋白吸光系數,作為所形成的Bi-Fbp濃度。以Bi-Fbp的濃度對時間作圖,使用Origin 7.5軟件進行曲線擬合,以各個時間點對應曲線的斜率為此時的反應速率dc/dt。根據微分法原理ln(dc/dt)=nlnc+lnk,由 ln(dc/dt)對 lnc作圖(圖 3),可分別求得該濃度比下的反應級數n、表觀反應速率常數k(表1)及初始反應速率dc0/dt。
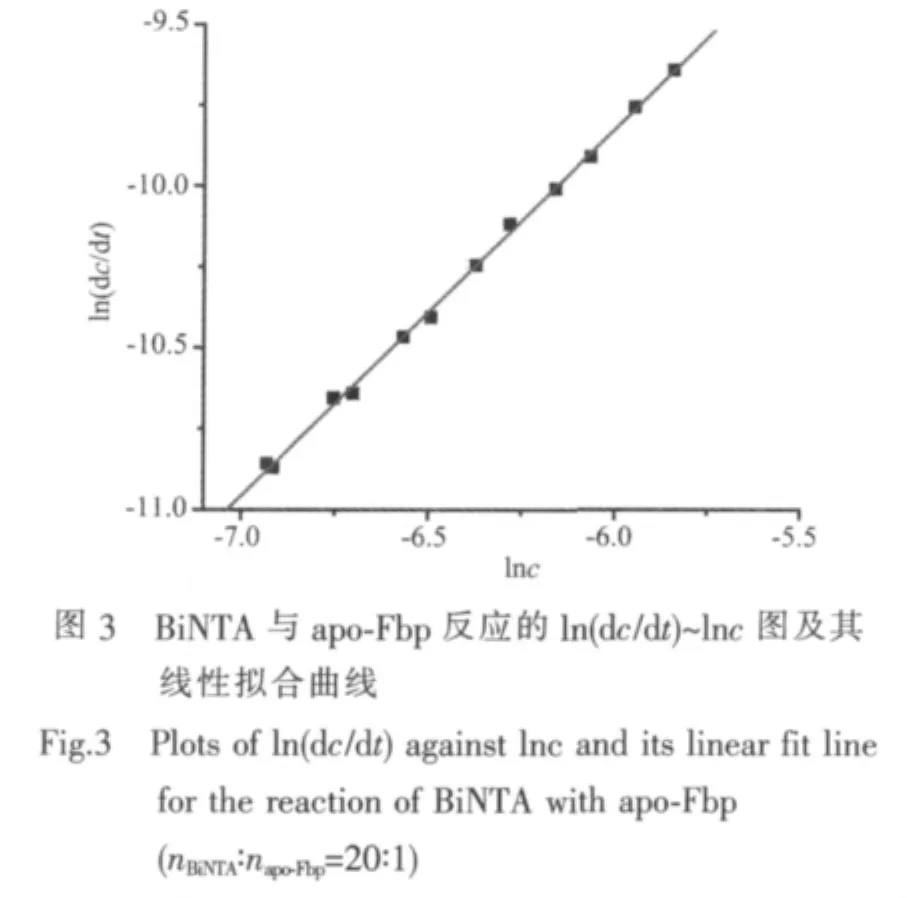

表1 BiNTA與apo-Fbp反應的反應級數和表觀速率常數Table 1 Reaction order and apparent rate constant for the reaction of BiNTA with apo-Fbp
根據初速率法確定反應級數的原理,以ln(dc0/dt)對 lnc0作圖(圖略),求得初始反應級數 n0=1.38±0.10(即為一級反應)和初始反應速率常數k0=(0.175±0.064)min-1。
文獻報道,Nb(NTA)2-和 Cp2Nb(OH)Cl2與 apo-Fbp的反應也遵循一級反應機理,10 mmol·L-1Hepes pH 7.4的緩沖溶液310 K時表觀反應速率常數分別為(3.03±0.01)h-1(約 0.050 5 min-1)和(1.24±0.03)h-1(約 0.0207 min-1)[18],與我們的結果相近,顯示BiNTA和apo-Fbp反應的機制與Nb(NTA)2-和apo-Fbp反應的機制類似。具體反應機制有待進一步探索。
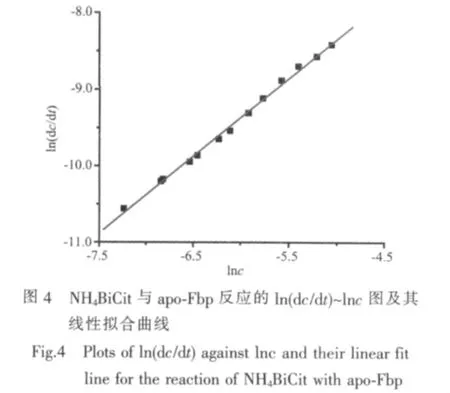
NH4BiCit與apo-Fbp的反應動力學跟BiNTA相似,實驗測得在相同條件下20倍的NH4BiCit與apo-Fbp 反應的級數 n=1.01±0.02,表觀反應速率常數 k=(0.0375±0.0045)min-1(圖 4)。
2.3 BiNTA、NH4BiCit與apo-Fbp的反應熱力學
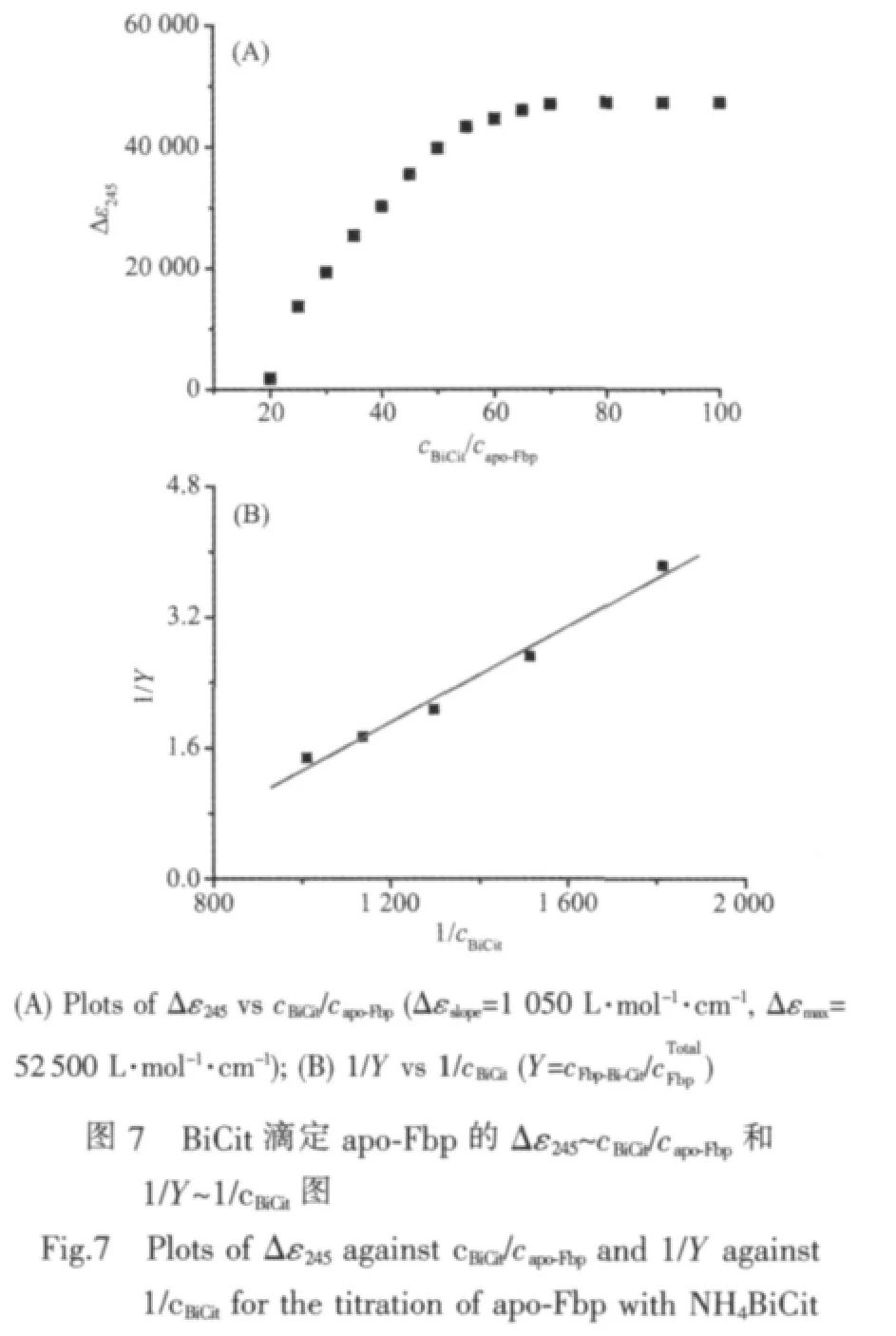
310 K 恒溫條件下,10 mmol·L-1Hepes pH 7.4的緩沖液中,BiNTA 滴定 apo-Fbp(capo-Fbp=22.3 μmol·L-1)的紫外可見光譜(差譜)見圖5,在滴定的初始階段(nBiNTA∶napo-Fbp<20∶1),隨著 BiNTA 的加入,245 nm 吸收峰的吸收值近似線性增加,說明越來越多的鉍離子結合于 apo-Fbp 中,當 nBiNTA∶napo-Fbp>60∶1 時,吸收值增加很小,表明其結合已近飽和。
在圖5(B)中,對前部呈線性變化的滴定數據進行線性擬合,得擬合直線的斜率Δεslope約為1 358 L·mol-1·cm-1(相關系數 R=0.997),即為每結合一份BiNTA所引起的吸光系數的變化值。
可根據下列關系式(略去電荷),計算Bi-Fbp的結合常數K:

根據Hill-plot的方法計算Kobs[19]:
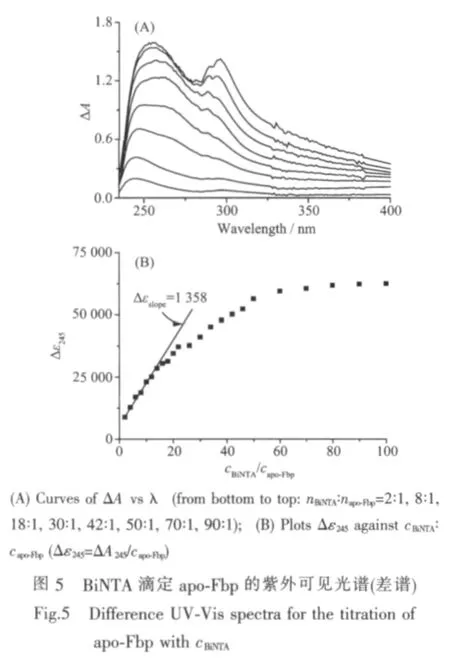
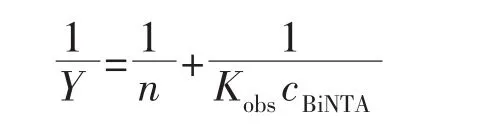
由 1/Y~1/cBiNTA作圖, 得截距 1/n=1.25±0.10,即n=0.80,表明每分子apo-Fbp結合1個BiNTA。由斜率 1/Kobs=(2.11±0.11)×10-4得 Kobs=(4.74±0.26)×103。根據BiNTA 的結合常數 lgKBi(NTA)=17.75[20],得 Bi3+與 apo-Fbp形成 Fbp-Bi-NTA的結合常數為 lgK=21.43±0.20。

同法測得NH4BiCit與apo-Fbp的表觀結合常數為 Kobs=(3.40±0.20)×102(圖 7,capo-Fbp=25 μmol·L-1),根據 BiCit的結合常數 lgKBiCit=13.5[20], 可得 Bi3+與apo-Fbp形成的Fbp-Bi-Cit的結合常數 lgK=16.03±0.03。
Sun等測得 310 K時在 10 mmol·L-1Hepes/5 mmol·L-1HCO3-pH 7.4 緩沖液中,Bi3+與血清傳鐵蛋白 N-lobe(hTf/2N)的結合常數為 lgK=19.15[19],我們測得Bi3+與apo-Fbp形成Fbp-Bi-NTA和Fbp-Bi-Cit三元配合物的結合常數(lgK)分別為(21.43±0.20)和(16.03±0.03),表明當以 NTA 為協同陰離子時 Bi3+對奈瑟氏菌屬Fbp的親和力大于血清Tf,也大于Fe3+對奈瑟氏菌屬Fbp的親和力(lgK=18.38[11])。但當以Cit為協同陰離子時,其結合常數小于以NTA為協同陰離子時的結合常數,可能的原因是由于BiCit的穩定常數小于BiNTA,在溶液中易形成多核聚合物[21],從而影響其作為Bi3+給予體的能力。不同配體的鉍配合物與apo-Fbp的結合能力不同,這對研究鉍化合物的抗菌能力和機制、設計新型抗菌藥物可能具有重要意義。從實驗結果可以推測,鐵結合蛋白Fbp可能是某些鉍抗菌藥物的作用靶分子,這為設計抗相關致病菌的含鉍抗菌藥物提供了實驗依據。
3 結 論
致病菌鐵結合蛋白能緊密結合具有抗菌活性的鉍離子。在10 mmol·L-1Hepes/HPO42-pH 7.4緩沖溶液中,310 K溫度下,apo-Fbp與 BiNTA和NH4BiCit按飽和結合計量比1∶1形成三元配合物Fbp-Bi-NTA、Fbp-Bi-Cit,反應遵循一級反應動力學。結合常數(lgK)分別為 21.43±0.20 和 16.03±0.03,可將鐵結合蛋白作為潛在靶分子設計含鉍抗菌藥物。
[1]Sun Q J,Liang X,Zheng Q,et al.Helicobacter,2010,15:233-238
[2]Gao X Z,Qiao X L,Song W C,et al.World J.Gastroenterol.,2010,16(34):4357-4362
[3]ZHANG Zhi-Peng(張志朋),ZHONG Guo-Qing(鐘國清),JIANG Qi-Ying(蔣琪英).Prog.Chem.(Huaxue Jinzhan),2008,20(9):1315-1323
[4]Huang J D,Sun H Z,Tanner J A,et al.Hong Kong Med J.,2009,6:15-16
[5]Yang N,Sun H Z.Coord.Chem.Rev.,2007,251:2354-2366
[6]YANG Nan(楊楠),SUN Hong-Zhe(孫紅哲).Prog.Chem.(Huaxue Jinzhan),2009,21(5):856-865
[7]Ge R,Sun H.Acc.Chem.Res.,2007,40(4):267-74
[8]Taboy C H,Bruns C M,Williams P A,et al.Nature Struct.Biol.,1996,6:912-927
[9]Bruns C M,Nowalk A J,Arvai A S,et al.Nature Struc.Biol.,1997,4:919-924
[10]Meitzner T A,Tencza S B,Adhikari P,et al.Curr.Top.Microbiol.Immun.,1998,225:113-135
[11]Guo M L,Harvey I,Yang W P,et al.J.Biol.Chem.,2003,278(4):2490-2502
[12]Alexeev D,Zhu H Z,Guo M L,et al.Nature Struct.Biol.,2003,10:297-302
[13]Zhong W Q,Alexeev D,Harvey I,et al.Angew.Chem.Int.Edit.,2004,43:5914-5918
[14]Berish S A,Chen C Y,Mietzner T A,et al.Mol.Microbiol.,1992,6:607-2615
[15]Summers S P,Abboud K A,Farrah S R,et al.Inorg.Chem.,1994,33:88-92
[16]Schlabach M R,Bates G W.J.Biol.Chem.,1975,250:2182-2188
[17]CHEN Wei-Jing(陳維敬).Thesis for the Master of Second Military Medical University(第二軍醫大學碩士論文).2010.
[18]Shi Y B,Harvey I,Campopiano D,et al.Bioinorg.Chem.Appl.,2010,doi:10.1155/2010/307578(11pages)
[19]Sun H Z,Li H,Mason A B,et al.Biochem J.,1999,337:105-111
[20]Pettit G,Pettit L D.IUPAC Stability Constants Database,IUPAC and Academic Software,Otley,U.K.,1993.
[21]JIANG Qi-Ying(蔣琪英),SHUN Juan(沈娟),ZHONG Guo-Qing(鐘國清).Prog.Chem.(Huaxue Jinzhan),2006,18(12):1634-1645
Binding Properties of Bismuth Coordination Compounds to the Ferric-Ion Binding Protein from Neisseria gonorrhoeae
ZENG Xu YE Dan-Rong LIN De-Chang JIANG Hai-Long LI Min LUO Jun*ZHONG Wei-Qing*
(School of Pharmacy,Second Military Medical University,Shanghai 200433,China)
Ferric-ion binding protein (Fbp)plays a key role for capturing Fe3+in pathogenic bacteria.Here,BiNTA·2H2O was syntheisized by reacting nitrilotriacetatic acid(H3NTA)with Bi(NO3)3and characterized by element analysis and NMR spectroscopy.Fbp of Neisseria gonorrhoeae was expressed in E.coli,and isolated and purified.The dynamics of the reaction of BiNTA with apo-Fbp was determined by UV-Vis spectroscopy at different ratio of nBiNTA/napo-Fbp.The reaction follows first-order mechanism and the rate constant is (0.175±0.064)min-1(in 10 mmol·L-1Hepes/HPO42-buffer at pH 7.4 and 310 K).The similar kinetics and rate constant were observed for the reaction of NH4BiCit with apo-Fbp.Bi3+can bind to apo-Fbp at 1∶1 molar ratio,and the binding constant lgK is(21.43±0.20)for Fbp-Bi-NTA and(16.03±0.03)for Fbp-Bi-Cit,respectively.These results indicate that the Fe3+transfer protein Fbp in pathogens could be the potential target for the bismuth antibacterial drugs.
ferric-ion binding protein;bismuth coordination compounds;reaction rate constant;binding constant
O614.81+1;O614.53+2
A
1001-4861(2011)11-2179-06
2011-07-04。收修改稿日期:2011-07-19。
國家自然科學基金(No.20371050)資助項目。
*通訊聯系人。 E-mail:wqzhong2002@sohu.com,junluo30@263.net

