HIF-1α在結外鼻型NK/T細胞淋巴瘤血管生成中的作用及意義
唐瓊蘭, 陳 瑞, 劉衛平, 李海剛, 林敏玲, 何欣欣
(中山大學孫逸仙紀念醫院 1病理科,2呼吸內科, 廣東 廣州 510120; 3四川大學華西醫院病理科,四川 成都 610041)
HIF-1α在結外鼻型NK/T細胞淋巴瘤血管生成中的作用及意義
唐瓊蘭1,3, 陳 瑞2△, 劉衛平3, 李海剛1, 林敏玲1, 何欣欣1
(中山大學孫逸仙紀念醫院1病理科,2呼吸內科, 廣東 廣州 510120;3四川大學華西醫院病理科,四川 成都 610041)
目的研究缺氧誘導因子-1α(HIF-1α)在結外鼻型NK/T細胞淋巴瘤血管生成中的作用及意義。方法采用免疫組化法檢測50例人結外鼻型NK/T細胞淋巴瘤中HIF-1α、血管內皮生長因子(VEGF)和血管內皮生長因子受體2(VEGFR2)的表達情況,用CD34單克隆抗體標記血管內皮細胞,并計算腫瘤微血管密度(MVD),用SPSS 13.0軟件分析HIF-1α與VEGF、VEGFR2及腫瘤MVD的相關性。結果(1)50例中有39例(78%)腫瘤細胞HIF-1α陽性,27例(54%)VEGFR2陽性,與淋巴結反應性增生組織中淋巴細胞的表達情況比較均有顯著差異(P<0.05);(2)HIF-1α蛋白陽性表達組VEGF和VEGFR2的陽性表達率分別為72%和64%,明顯高于HIF-1α蛋白陰性表達組(P<0.05);(3)HIF-1α、VEGFR和VEGFR2蛋白表達與腫瘤MVD相關(P<0.01);(4)15例伴有血管中心性浸潤的結外鼻型NK/T細胞淋巴瘤病例均表達HIF-1α。結論HIF-1α可促進結外鼻型NK/T細胞淋巴瘤腫瘤血管生成,其作用機制可能與VEGF/VEGFR2通路有關。
淋巴瘤; 自然殺傷/T細胞; 缺氧誘導因子 1α; 血管生成
結外鼻型NK/T細胞淋巴瘤(extranodal nasal-type NK/T-cell lymphoma)是一類具有特殊形態、免疫表型和生物學行為的侵襲性淋巴瘤,該腫瘤細胞常表達T細胞分化抗原及自然殺傷(natural killer, NK)細胞相關抗原,故得此名[1,2]。結外鼻型NK/T細胞淋巴瘤在亞洲尤其在中國發病率較高,歐洲和北美地區少見[1,2],多發生于結外器官或組織,具有血管破壞性和血管中心性浸潤的特點,但其發生機制尚不清楚。課題組研究發現血管內皮生長因子(vascular endothelial growth factor, VEGF)在結外鼻型NK/T細胞淋巴瘤腫瘤細胞中表達上調,可能與該腫瘤血管生成及預后有關[3]。國內外研究發現,缺氧誘導因子-1α( hypoxia inducible factor 1α, HIF-1α)可調控VEGF的轉錄活性,與多種淋巴瘤血管生成有關[4-6]。目前尚未見有關HIF-1α與結外鼻型NK/T細胞淋巴瘤血管生成的報道。因此,本研究采用免疫組化法檢測50例人結外鼻型NK/T細胞淋巴瘤病例HIF-1α、VEGF和血管內皮生長因子受體2(vascular endothelial growth factor receptor 2, VEGFR2)的表達,分析HIF-1α與VEGF、VEGFR2及腫瘤微血管密度(microvessel density, MVD)的相關性,初步探討HIF-1α在結外鼻型NK/T細胞淋巴瘤血管生成中的作用及臨床意義。
材 料 和 方 法
1病例資料
收集中山大學孫逸仙紀念醫院2000年1月-2010年1月外檢診斷的結外鼻型NK/T細胞淋巴瘤病例60例。診斷標準參照新版WHO關于淋巴造血組織腫瘤分類(2008)[1]進行,排除病變組織太少者10例,其余50例被納入本研究。本組病例年齡16-67歲,中位年齡38歲;男性30例,女性20例。首發部位以鼻腔最多見(23/50,46%),其次為咽(12/50,24%)、硬腭(3/50,6%)、軟腭(3/50,6%)及上頜竇、扁桃體、會厭、頜下、肺、胃、小腸、結腸和睪丸(各1例,18%)。15例可見血管中心性浸潤。
2材料與試劑
HIF-1α鼠抗人單克隆抗體(SC-53546)和VEGFR2鼠抗人單克隆抗體(SC-6251)均購自Santa Cruz Biotech;VEGF(ZM-0265)和鏈親和素-過氧化物酶( streptavidin-biotin immunoperoxidase, SP)試劑盒購自北京中杉金橋生物技術有限公司;CD34(GM716510)購自基因有限公司。
3方法
采用SP法。HIF-1α、VEGF、VEGFR2和CD34抗體的工作稀釋度分別為1∶50、1∶100、1∶80和1∶50。抗原修復方法參照試劑說明書進行。以乳腺浸潤性導管癌組織為陽性對照,以PBS代替Ⅰ抗作為空白對照。
以同期10例淋巴結反應性增生標本為對照比較淋巴造血組織良、惡性病變中HIF-1α、VEGF和VEGFR2表達情況。
4結果判定
HIF-1α、VEGF和VEGFR2結果判定方法: HIF-1α以細胞核或細胞核及部分胞質呈淡黃色或棕黃色為陽性,VEGF和VEGFR2均以胞質呈淡黃色或棕黃色為陽性;隨機選擇5個高倍(×400)視野,合并計算所分析的5個不同視野染色細胞百分數及染色強度,根據陽性細胞的百分率及顯色深淺計分:(1)陽性細胞的百分率:陽性細胞率0-5%計0分;6%-25%計1分;26%-50%計2分;≥51%計3分。(2)顯色深淺:不顯色或顯色不清楚計0分;淡黃色計1分;棕黃色計2分;深褐色計3分。以陽性細胞的百分率及顯色深淺評分之和3-6分為陽性。
CD34以血管內皮細胞的細胞膜棕黃色為陽性。參照文獻[7]介紹方法對CD34染色切片進行觀察,計算MVD。
5統計學處理
結 果
1HIF-1α、VEGF及VEGFR2在腫瘤細胞及正常淋巴細胞中的表達
實驗組50例結外鼻型NK/T細胞淋巴瘤病例中,39例(78%)腫瘤細胞表達HIF-1α(圖1A),3例(3/10,30%)淋巴結反應性增生組織呈陽性表達(淋巴濾泡生發中心少數B細胞和漿細胞呈弱陽性表達),兩組比較,2= 9.143,P<0.01,差異顯著。32例(64%)腫瘤細胞表達VEGF(圖1B),與淋巴結反應性增生組織中淋巴細胞的表達情況比較,2= 0.057,P>0.05,無顯著差異。27例(54%)結外鼻型NK/T細胞淋巴瘤病例腫瘤細胞表達VEGFR2(圖1C),淋巴結內正常淋巴細胞VEGFR2呈陰性或極少數細胞表達,2=6.482,P<0.05,見表1。
表1HIF-1α、VEGF及VEGFR2在腫瘤細胞及正常淋巴細胞中的表達
Table 1. The expression of HIF-1α, VEGF and VEGFR2 in tumor cells of extranodal nasal type NK/T-cell lymphomas and normal lymphocytes of lymph nodes
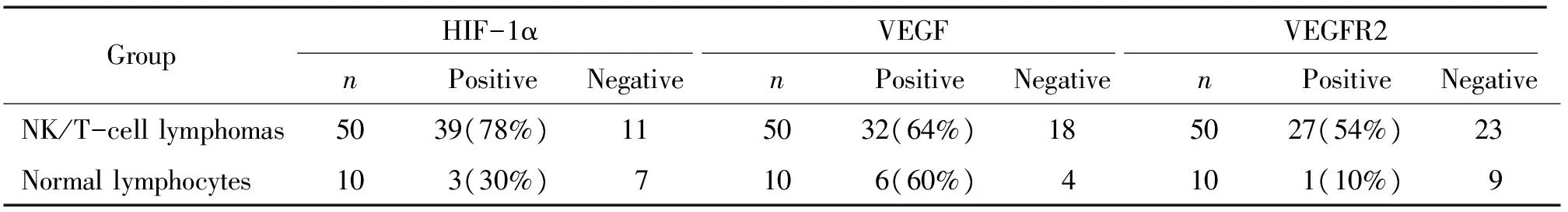
GroupHIF-1αVEGFVEGFR2nPositiveNegativenPositiveNegativenPositiveNegativeNK/T-celllymphomas5039(78%)115032(64%)185027(54%)23Normallymphocytes103(30%)7106(60%)4101(10%)9
2HIF-1α表達與VEGF、VEGFR2的關系
在人結外鼻型NK/T細胞淋巴瘤病例腫瘤細胞中, HIF-1α蛋白陽性表達組VEGF和VEGFR2的陽性表達率分別為72%和64%,與HIF-1α蛋白陰性表達組比較,2= 4.675,P<0.05及2= 7.284,P<0.01,差異顯著。VEGF蛋白陽性表達組VEGFR2的陽性表達率為75%,與VEGF蛋白陰性表達組比較,2= 15.781,P<0.01,差異顯著,見表2。
表2HIF-1α與VEGF、VEGFR2及腫瘤MVD的相關性
Table 2. The correlative analysis between the expression of HIF-1α and VEGF, VEGFR2 and MVD in human extranodal nasal type NK/T-cell lymphomas
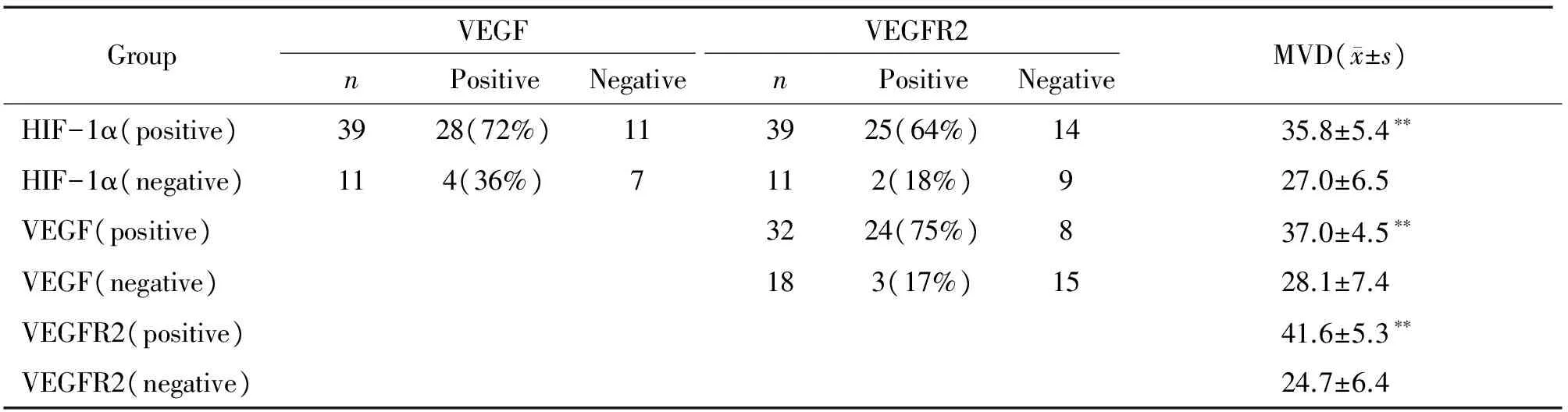
GroupVEGFVEGFR2MVD(x±s)nPositiveNegativenPositiveNegativeHIF-1α(positive)3928(72%)113925(64%)1435.8±5.4??HIF-1α(negative)114(36%)7112(18%)927.0±6.5VEGF(positive)3224(75%)837.0±4.5??VEGF(negative)183(17%)1528.1±7.4VEGFR2(positive)41.6±5.3??VEGFR2(negative)24.7±6.4
**P<0.01vscorresponding negative group.
3HIF-1α、VEGF和VEGFR2表達與腫瘤MVD的關系
HIF-1α蛋白陽性表達組MVD最低為11.3,最高為55.8,平均為35.8,HIF-1α蛋白陰性表達組MVD最低為5.6,最高為34.2,平均為27.0,兩組比較,差異顯著(P<0.01),說明HIF-1α蛋白表達水平高者MVD大,HIF-1α蛋白表達與結外鼻型NK/T細胞淋巴瘤腫瘤血管形成有關,見表2。
VEGF蛋白陽性表達組MVD最低為5.6,最高為55.8,平均為37.0,與VEGF蛋白陰性表達組比較,差異顯著(P<0.01);VEGFR2蛋白陽性表達組MVD最低為9.5,最高為55.8,平均為41.6,與VEGFR2蛋白陰性表達組比較,差異顯著(P<0.01),說明VEGF和VEGFR2可能具有促進結外鼻型NK/T細胞淋巴瘤腫瘤血管形成的作用。
4HIF-1α、VEGF和VEGFR2表達與血管中心性浸潤的關系
15例伴有血管中心性浸潤的結外鼻型NK/T細胞淋巴瘤病例均表達HIF-1α,無血管浸潤者HIF-1α陽性率為69%,兩組比較,差異顯著。13例表達VEGF和12例表達VEGFR2,與無血管中心性侵潤病例比較,P<0.05,差異顯著。結果說明,HIF-1α、VEGF和VEGFR2蛋白表達與結外鼻型NK/T細胞淋巴瘤血管中心性浸潤有關。

表3 HIF-1α、VEGF及VEGFR2與血管中心性浸潤的關系
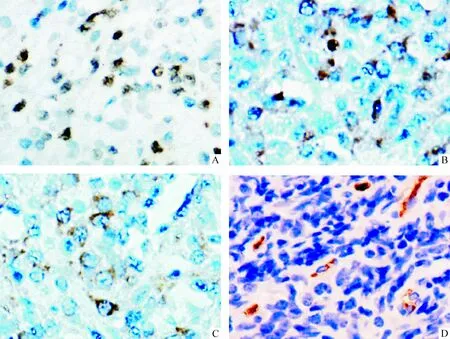
Figure 1. HIF-1α, VEGF, VEGFR2 and CD34 expression in the tumor tissues of human extranodal nasal-type NK/T-cell lymphoma (SP, ×200 ).A: HIF-1α; B: VEGF; C: VEGFR2; D: CD34.
圖1結外鼻型NK/T細胞淋巴瘤中HIF-1α、VEGF、VEGFR2及CD34的表達
討 論
結外鼻型NK/T細胞淋巴瘤在亞洲及南美洲地區多見,據不完全統計,在不同地區,該腫瘤在所診斷的淋巴瘤中占的比例分別為:西方國家0.17%,北京7%,香港13%,廣州7%,成都18%,該類腫瘤可謂是中國的“特產”之一[2,8]。近年來其發病率呈上升趨勢,嚴重威脅著我國青壯年人口的生命。因此,加強結外鼻型NK/T細胞淋巴瘤的發病機制研究,積極尋求針對該類疾病的特異性治療方案是目前防治該類腫瘤的當務之急。
缺氧是實體腫瘤的普遍特征,腫瘤缺氧促進了腫瘤細胞的侵襲生長和對化、放療的抵抗作用。缺氧誘導因子HIF-1α是應答缺氧的關鍵調控基因,它的活性與腫瘤血管生成密切相關[9]。HIF-1α還能增強其下游靶基因的表達,其中VEGF及其受體編碼基因是HIF-1α最主要的靶基因。VEGF是目前已知專屬性最強的血管生成因子,通過與其受體VEGFR2結合激活多種信號轉導通路,刺激血管內皮細胞增殖和遷移,促進血管生成,并增加血管通透性,在腫瘤的生長和轉移中起著重要作用[9,10]。Skinner等[11]發現VEGF的轉錄活性可由HIF-1α、HDM2 和p70S6K1在PI3K/Akt信號中調節的, HIF-1α的表達通過活化PI3K/Akt信號通路在轉錄水平介導VEGF蛋白的表達,而HDM2和p70S6K1是Akt下游的兩個生長因子,能增強VEGF的轉錄活性和HIF-1α的表達。
研究發現HIF-1α和VEGF及其受體VEGFR2在多種淋巴瘤中廣泛表達[3-7,10],并與多種淋巴瘤預后有關。Evens等[12]研究發現:高度惡性非霍奇金淋巴瘤中HIF-1α陽性表達率明顯高于低度惡性非霍奇金淋巴瘤,這可能與腫瘤的生長速度及血管形成有關,腫瘤的生長速度越快,缺氧越嚴重,缺氧引起腫瘤細胞內 HIF-1α 蛋白的積聚和核轉位,結合于 VEGF的啟動子區域的低氧反應元件(HRE)從而激活 VEGF的轉錄,激活VGEF/VEGFR2信號通路,促進腫瘤血管形成及微血管密度增加,VEGF和VEGFR2結合并激活后將細胞膜/細胞質激酶級聯反應信號傳遞到細胞核內,進而引起內皮細胞的一系列變化,包括內皮細胞黏附、遷移、增殖、存活,最終導致新生血管形成[9,10]。本實驗結果發現,結外鼻型NK/T細胞淋巴瘤中HIF-1α陽性率為78%,而反應性增生淋巴組織中僅有少數正常淋巴細胞呈弱陽性表達。研究結果提示:HIF-1α表達上調可能是淋巴瘤發生的重要分子事件。
本研究在對50例結外鼻型NK/T細胞淋巴瘤的研究中發現:結外鼻型NK/T細胞淋巴瘤病例腫瘤細胞HIF-1α、VEGF和VEGFR2陽性表達率高,而淋巴結反應性增生患者的淋巴結內淋巴細胞HIF-1α和VEGFR2呈陰性或極少數細胞表達。HIF-1α蛋白陽性表達組VEGF和VEGFR2的陽性表達率分別為72%和64%。HIF-1α與VEGF/VEGFR2有關。15例伴有血管中心性浸潤的結外鼻型NK/T細胞淋巴瘤病例均表達HIF-1α,而且HIF-1α、VEGF和VEGFR2蛋白表達與結外鼻型NK/T細胞淋巴瘤血管中心性浸潤有關。同時研究發現,HIF-1α、VEGF和VEGFR2蛋白陽性表達組微血管密度較對照組高,差異顯著。上述結果顯示:HIF-1α與結外鼻型NK/T細胞淋巴瘤獨特的生物學行為有關,可促進結外鼻型NK/T細胞淋巴瘤腫瘤血管生成,其作用機制可能與VEGF/VEGFR2通路有關。
缺氧是淋巴瘤的基本特征,在其乏氧應答過程中,HIF-1α的活化處于中心地位,故通過調節人結外鼻型NK/T細胞淋巴瘤HIF-1α的活性,可以降低VEGF的轉錄水平而抑制腫瘤細胞生長和轉移;同時通過抑制乏氧細胞來提高淋巴瘤腫瘤細胞對放、化療的敏感性。因此,深入研究HIF-1α在人結外鼻型NK/T細胞淋巴瘤的調節機制有助于開拓新的腫瘤治療思路。
[1] Swerdlow SH, Campo E, Harris NL, et al. WHO classification of tumors of haematopoietic and lymphoid tissues[M]. 4th ed.IARC press: Lyon, 2008.285-288.
[2] Zhao S, Tang QL, He MX, et al. A novel nude mice model of human extranodal nasal type NK/T-cell lymphoma[J]. Leukemia, 2008,22(1):170-178.
[3] 唐瓊蘭,劉衛平,張文燕,等.CYR61和血管內皮生長因子在結外鼻型NK/T細胞淋巴瘤中的表達及其意義[J].中華血液學雜志,2006,27(10):661-665.
[4] Evens AM, Sehn LH, Farinha P, et al. Hypoxia-inducible factor-1α expression predicts superior survival in patients with diffuse large B-cell lymphoma treated with R-CHOP[J].J Clin Oncol,2010,28(6):1017-1024.
[5] Passam FH, Alexandrakis MG, Kafousi M, et al. Histological expression of angiogenic factors: VEGF, PDGFRα, and HIF-1α in Hodgkin lymphoma[J].Pathol Res Pract,2009,205(1):11-20.
[6] 姚軍萍,周 玨,徐又海,等.COX-2和HIF-1α在非霍奇金淋巴瘤組織中的表達[J].皖南醫學院學報,2010,29(4):255-258.
[7] 唐瓊蘭,蔣學風,楊開選,等. 血管內皮細胞生長因子在女性生殖系統原發性彌漫性大B細胞淋巴瘤中的表達及意義[J].四川大學學報(醫學版),2009,40(1):48-51.
[8] 劉衛平,李甘地,劉永惠,等. 鼻NK/T細胞淋巴瘤-15年研究報道[J].臨床與實驗病理學雜志,2000, 16(2):89-92.
[9] 江從慶,樊利芳,刁路明,等.低氧及一氧化氮對SW480細胞缺氧誘導因子-1α、VEGF及iNOS表達的初步研究[J].中國病理生理雜志,2005,21(4):722-726.
[10]Giatromanolaki A, Koukourakis MI, Pezzella F, et al. Phosphorylated VEGFR2/KDR receptors are widely expressed in B-cell non-Hodgkin’s lymphomas and correlate with hypoxia inducible factor activation[J]. Hematol Oncol,2008,26(4):219-224.
[11]Skinner HD, Zheng JZ, Fang J, et al. Vascular endothelial growth factor transcriptional activation is mediated by hypoxia inducible factor 1α, HDM2, and p70S6K1 in response to phosphatidylionsitol 3-kinase/AKT signaling[J]. J Biol Chem, 2004, 279 (44):45643-45651.
[12]Evens AM, Schumacker PT, Helenowski IB, et al. Hypoxia inducible factor-alpha activation in lymphoma and relationship to the thioredoxin family[J]. Br J Haematol,2008,141(5):676-680.
AngiogeniceffectofHIF-1αonextranodalnasal-typeNK/T-celllymphoma
TANG Qiong-lan1,3, CHEN Rui2, LIU Wei-ping3, LI Hai-gang1, LIN Min-ling1, HE Xin-xin1
(1DepartmentofPathology,2DepartmentofRespiratoryDiseases,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China;3DepartmentofPathology,WestChinaHospital,SichuanUniversity,Chengdu610041,China.E-mail:gzchenrui@163.com)
AIM: To study the angiogenic effect of hypoxia inducible factor 1α(HIF-1α) and its significance on human extranodal nasal-type NK/T-cell lymphoma.METHODSThe protein levels of HIF-1α, vascular endothelial growth factor(VEGF) and VEGF receptor 2(VEGFR2) in human extranodal nasal-type NK/T-cell lymphoma were detected by immunohistochemistry. Microvessel density (MVD) of the tumor tissues was determined by labeling of microvessel endothelium with CD34 antibody. The correlation between the expression of HIF-1α, VEGF and VEGFR2 and MVD was analyzed with SPSS 13.0 statistical software.RESULTSThe positive expression of HIF-1α was observed in 39 cases (39/50, 78%) and the positive expression of VEGFR2 was 27 cases (27/50, 54%) of human extranodal nasal-type NK/T-cell lymphoma. A statistical difference of HIF-1α and VEGFR2 expression between tumor tissues and normal lymphocytes in lymph node was observed (P<0.05). In the tumor tissues, the co-expression of VEGF or VEGFR2 with HIF-1α was 72% and 64%, respectively, significantly higher than that without HIF-1α co-expression (P<0.05). The expression of HIF-1α, VEGFR and VEGFR2 was positively correlated with MVD of the tumor tissues (P<0.01). HIF-1α was expressed in all 15 cases of extranodal nasal-type NK/T-cell lymphoma with angiocentric infiltration.CONCLUSIONHIF-1α may promote angiogenesis of extranodal nasal-type NK/T-cell lymphoma through VEGF/VEGFR2 signaling pathway.
Lymphoma; Natural killer/T-cell; Hypoxia inducible factor 1α; Angiogenesis
R736.1
A
1000-4718(2011)03-0518-05
2010-08-27
2011-01-17
△ 通訊作者Tel: 020-81332590; E-mail: gzchenrui@163.com
10.3969/j.issn.1000-4718.2011.03.019

