一次性免疫傳感器快速檢測阪崎腸桿菌的研究*
趙廣英,張 曉,竇文超,張 冕,唐維潞,王文華
(浙江工商大學食品與生物工程學院,浙江省食品安全重點實驗室,杭州 310035)
阪崎腸桿菌(Enterobacter Sakazakii,E Sakazakii)曾名為黃色陰溝腸桿菌。該菌是寄生在人和動物腸道內的條件致病菌,對成人危害不明顯,但對嬰幼兒危害非常嚴重,能引起新生兒腦膜炎、致死性小腸炎以及菌血癥,死亡率高達50%以上[1]。E Sakazakii引起的腦膜炎常可致腦梗塞、腦膿腫、囊腫的形成和腦室炎等并發癥,并可引起神經系統后遺癥或迅速死亡[2]。現已明確,嬰幼兒配方奶粉是嬰幼兒感染E Sakazakii的主要途徑。對于免疫機能尚不健全且以嬰幼兒配方奶粉為主要母乳代用品和營養食品的嬰幼兒而言,該菌的危害是非常大的。2002年,國際食品微生物標準委員會(International Commission for Microbiological Specifications for Foods,ICMSF) 將E Sakazakii列為“嚴重危害特定人群,危害生命或慢性實質性后遺癥或長期影響”的致病菌[3]。2004年,FAO/WHO在制定嬰幼兒配方奶粉標準時,經過風險評估,認為E Sakazakii與單核細胞李斯特菌(Listeria Monocytogenes)、肉毒梭菌(Clostridium Botalinum)的A型毒素和B型毒素有同等的危害[4]。2005年,我國發布了檢測E Sakazakii的行業標準和國家標準[5-7],并于 2008 年和 2010 年進行了改進[8-9]。雖然標準規定的檢測方法準確性較高,但實驗步驟繁瑣,檢測時間長達6 d~7 d,可操作性差。對該菌的快速檢測方法也有些報道,如分子生物學方法[10]、顯色培養基[11]等。開發更良好的快速檢測方法對該菌的及時監測、監管、質控、感染的預防和感染后的及時確診的有效實施都是非常重要的。
離子液體(Ionic Liquids,ILs)是只含陰離子和陽離子且在室溫下呈液態的熔融鹽。因其具有離子導電率高、溶解性好、電化學窗口寬、相穩定性好、低毒等獨特的物理化學性質,ILs被應用于萃取分離[12]、色譜[13-14]、質譜[15]、光譜[16]、毛細管電泳[17]等分析化學領域。1992年,Wiikes等[18]合成了對水和空氣穩定的ILs,這使得ILs成為酶促反應溶劑的又一良好選擇。Fuller等[19]證明部分ILs是有較好生物相容性的介質。在含陰離子 BF-4、PF-6、Tf2N-的 ILs 中酶的活性好[20],這可能是 BF-4、PF-6、Tf2N-較小的氫鍵力減少了溶劑與酶內部的氫鍵作用,減小了溶劑與酶結構中正電荷區的作用使酶構象不易改變,從而延長酶的保存時間。Mori等[21]研究證明在離子液體1-丁基-3-甲基咪唑六氟磷酸鹽(1-Butyl- 3 - Methylimidazolium Hexafluorophosphate,[BMIM]PF6)中多種酶表現出較好的活性。近幾年,用ILs構建酶傳感器的研究報道較多,對傳感器多方面的改進效果明顯[22-23],但尚未見有將ILs用于改善免疫傳感器的報道。
MWCNT主要是由石墨的碳原子層卷曲成數層到數十層的同軸圓管,表現出小尺寸效應、表面與界面效應和量子尺寸效應[24-25]既具有金屬的性質又具有半導體特性[26],有優良的導電性和催化活性,能促進生物分子的電子傳遞[27-28]。基于這些特點,MWCNT成為生物傳感器制作的良好材料[29-30]。但MWCNT幾乎不溶于所有溶劑,這極大地限制了其在修飾電極方面的應用。Nafion對MWCNT有較好的分散能力,有效的解除了MWCNT應用的限制,而且 Nafion也具有良好的生物相容性[31-32],國內外已大量應用Nafion制作高靈敏度葡萄糖傳感器的報道[35-36]。用 MWCNT/Nafion 構建的生物傳感器雖然在多方面的性能已有明顯的改進,但尚存在電化學信號的穩定性,循環伏安(CV)峰的峰形還不夠理想[37-38]、傳感器儲存時間不夠長[39]等不足。本研究將MWCNT分散于Nafion溶液中制備了具有很好穩定性的懸浮液。
絲網印刷電極作為支持電極,相比于固體電極制作的免疫傳感器,減少了電極每次使用后都要進行物理或化學處理帶來的實驗誤差和麻煩,提高了檢測的準確性和簡便性;絲網印刷電極的價格非常便宜,一次性使用,可實現批量化生產。
本研究嘗試用Nafion、多壁碳納米管(Multi-Wall Carbon Nanotube,MWCNT)結合離子液體[BMIM]PF6對絲網印刷電極進行修飾,研制了一種新型的電化學免疫傳感器,用于快速檢測阪崎腸桿菌。
1 實驗部分
1.1 儀器與試劑
CHI 1030A電化學工作站、CHI 760C電化學工作站(上海辰華儀器公司);SPM-9500J3原子力顯微鏡(日本島津);絲網印刷碳電極(SPCE,本研究團隊與嶸斌生物科技有限公司共同開發研制);阪崎腸桿菌(E Sakazakii,ATCC 29544); 大 腸 桿 菌(Escherichia coli,E coli,ATCC 8739)、金黃色葡萄 球 菌 (Staphylococcus aureus,S Aureus,ATCC 27217)、副溶血性弧菌(Vibrio Parahaemolyticus,VP,VP 17802)、蠟樣芽胞桿菌(Bacillus Cereus,B Cereus,ATCC 7064)(購于中國工業微生物菌種保藏中心,CICC);純化MWCNT(中國科學院成都有機化學有限公司);[BMIM]PF6(中國科學院蘭州化學物理研究所)、Nafion117(5%,Fluka)、HRP-Anti-E Sakazakii(北京賽馳生物科技有限公司)、牛血清蛋白(BSA,杭州昊天生物技術有限公司)、硫堇(Thionine,Thi,分析純,國藥集團化學試劑有限公司)、磷酸鹽緩沖溶液(PBS,0.01 mol/L,pH 7.4)、H2O2、NaCl、冰醋酸、無水乙酸鈉等試劑均為分析純,實驗用水為二次蒸餾水。電化學測量前,支持電解質均充N220 min除氧。
1.2 免疫電極的制備
取適量5%Nafion,用乙醇/水混合物(V乙醇∶V水=1∶2)分別稀釋至 0.5%和 0.1%。準確稱量 1.0 mg已純化的MWCNT溶于1.5 mL 0.5%Nafion溶液中,超聲處理30 min。將MWCNT懸浮液室溫過夜,除去沉淀。用0.1%Nafion配制13%[BMIM]PF6溶液。
酶免疫電極按照如下步驟制備:①用微量移液器吸取3 μL MWCNT/Nafion溶液均勻滴涂于SPCE的工作電極表面,室溫晾干;②將13%[BMIM]PF6溶液與 HRP-Anti-E Sakazakii(6 μg/mL)等體積混合,在混勻器上震蕩均勻,4℃保存;③吸取3 μL[BMIM]PF6/Nafion/HRP-Anti-E Sakazakii混合液均勻滴涂到步驟①修飾的工作電極上,室溫晾干;④制得的免疫電極4℃保存備用。

圖1 免疫電極制備及工作原理示意圖
1.3 實驗方法
將不同修飾電極于SPM-9500J3型AFM進行成像觀察,掃描方式為輕敲模式,所用探針為商用OMCL-AC240TS-C2 型(日本Olympus公司),所有圖像均通過自動平滑處理以消除慢掃方向的低頻噪音。
電化學實驗采用三電極體系:免疫電極為工作電極,碳電極為對電極,Ag/AgCl電極為參比電極。采用循環伏安法(CV,應用CHI 1030A電化學工作站)和交流阻抗法(EIS,應用CHI 760C電化學工作站)對免疫電極電化學表征,用CV檢測E Sakazakii。測試底液為含1.0 mmol/L Thi的0.3 mmol/L H2O2HAc-NaAc(0.1 mol/L,pH 6.5)緩沖溶液。用生理鹽水制備的各濃度梯度的E Sakazakii懸液,在每個免疫電極上滴加3 μL菌懸液,于無菌密閉容器中30±0.5℃孵育20 min,用雙蒸水仔細沖洗干凈,晾干。用CV法檢測免疫電極還原峰電流值的變化值(ΔIpc)來測定樣品中的 E Sakazakii,ΔIpc=Ipc1-Ipc2,其中Ipc1為免疫電極在測試底液中的還原峰電流值,Ipc2為免疫電極孵育抗原后在測試底液中的還原峰電流值。
2 結果與討論
2.1 電極表征
2.1.1 AFM 表征
通過AFM對修飾電極做了形態表征,如圖2所示。由圖1a可見MWCNT露出部分的形態,這表明Nafion成功地將 MWCNT修飾到了電極上。[BMIM]PF6/Nafion包埋的酶標抗體明顯地固定在MWCNT/Nafion修飾的電極上(圖2b)。免疫電極孵育后(圖2c),E Sakazakii覆蓋了抗體層(圖2c),這表明HRP-Anti-E Sakazakii與E Sakazakii發生了特異性結合。

圖2 電極修飾的AFM表征
2.1.2 電極修飾過程的循環伏安表征
采用CV研究不同修飾物對電極電化學特性的影響(圖3)。
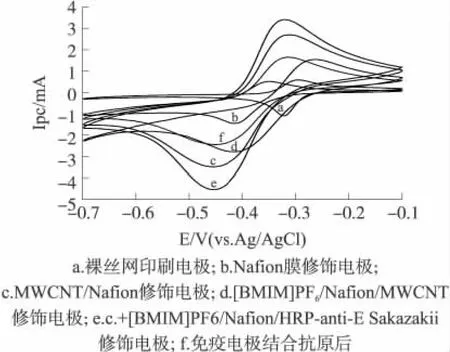
圖3 不同電極在測試底液中的CV圖
由圖3可知,裸絲網印刷碳電極(SPCE)在底液中出現一對可逆的Thi(硫堇)氧化還原峰(曲線a);當電極修飾Nafion后,氧化峰電流值基本不變,還原峰電流值增大(曲線b),這是由于Nafion側鏈上的-HSO-3離子束的靜電作用,可以使得Nafion膜通過離子交換固定測試底液中的電活性物質Thi,這促進了電子從電極向Thi的傳遞從而導致了還原峰電流增大;當MWCNT/Nafion修飾到電極表面后,氧化還原峰電流明顯增大(曲線 c),這是因為MWCNT具有大比表面積能有效地改變電極表面特性,MWCNT管端類似于高度有序石墨電極有較快的電子傳遞能力,MWCNT的獨特電化學特性使得電極CV時信號明顯放大;用[BMIM]PF6/Nafion修飾電極后,氧化還原峰降低(曲線 d),這是由于[BMIM]PF6/Nafion阻礙了Thi和H2O2向電極修飾層內部的擴散,雖然減弱了底物與MWCNT間的電子傳遞,在一定程度上降低了電極的電流響應,卻使得免疫電極孵育前后的電流變化值ΔIpc中所占的比例提高,使得檢測結果更準確。當HRP-anti-E Sakazakii固定后,電極氧化還原電流峰電流顯著增大(曲線e),這表明酶標抗體已成功地包埋在[BMIM]PF6/Nafion復合膜中。免疫反應后,免疫電極氧化還原峰電流值大幅減小(曲線f),表明抗原-抗體免疫反應后生成的免疫復合物在部分空間上阻礙了媒介體和底物向HRP活性中心和電極內部的擴散,電子傳遞受到阻礙,從而導致了氧化還原電流峰值的大幅降低。
2.1.3 免疫傳感器的交流阻抗法(EIS)表征
以Thi為探針對免疫電極進行交流阻抗法表征。如圖4所示,裸電極的阻抗圖譜近似一條直線(曲線a),這表明電極過程只受擴散控制;電極上修飾Nafion/MWCNT后,電極的阻抗值明顯增大(曲線b)。修飾離子液體[BMIM]PF6/Nafion/HRP-anti-E Sakazakii后電極在動力學上變慢(曲線c),這是因為酶標抗體是生物大分子,固定于電極后使得電極表面電子傳遞受到較大阻力。免疫電極經免疫反應后阻抗值明顯增大(曲線d),這表明修飾在電極上的抗體保持了很好的活性,成功的結合了抗原。

圖4 不同電極在測試底液中的Nyquist圖
2.2 實驗條件的優化
2.2.1 測試底液中H2O2濃度確定
H2O2濃度對HRP催化反應影響較大。如圖5所示,在H2O2濃度為0~0.1 mmol/L時,免疫電極還原峰電流值急劇增大;在0.1 mmol/L~1 mmol/L間,隨著H2O2濃度的增加,免疫電極還原峰電流值增加平緩。考慮到檢測的靈敏度、酶催化活性以及CV峰形,選取0.3 mmol/L濃度的H2O2。

圖5 測試底液中H2O2濃度與免疫電極還原峰電流的關系
2.2.2 pH 的確定
底液pH值對免疫電極氧化還原峰電流響應的影響如圖6所示。在含1.0 mmol/L Thi和0.3 mmol/L H2O2的底物溶液中,pH 4.0 ~8.0 范圍內,免疫電極在pH 5.0時氧化峰電流值最大,之后逐漸降低;還原峰電流值隨pH的增加而增大。在pH 6.5時,免疫電極峰形最為良好,因此實驗選擇測試底液pH為6.5。

圖6 測試底液pH與免疫電極氧化峰電流(a)和還原峰電流(b)的關系
2.2.3 孵育條件的選擇
孵育溫度和時間對免疫反應有顯著影響。圖7(a)顯示,在(30±0.5)℃溫度下,免疫反應前后免疫電極還原峰電流值減少量ΔIpc最大。在這一溫度下,免疫反應10 min后,還原峰電流值變化平緩;孵育50 min時ΔIpc出現較大波動(圖7(b)),這是由稀釋抗原的生理鹽水中NaCl形成結晶難以被洗脫而導致的現象。考慮到免疫反應的充分性和檢測周期,實驗中選擇孵育時間為20 min。

圖7 孵育溫度和孵育時間與還原峰電流的關系
2.3 免疫電極對E Sakazakii的響應
在以上優化的實驗條件下進行E Sakazakii的電化學免疫測定,采用CV法檢測免疫前后還原峰電流的變化值 ΔIpc。圖8表明E Sakazakii濃度在103cfu/mL~109cfu/mL之間變化時,ΔIpc與細菌濃度的對數成良好的線性關系,線性方程為ΔIpc(μA)=0.2580lg[C/(cfu·mL-1)]-0.6469,相關系數為0.9987。檢出限為3.4×102cfu/mL(S/N=3)。

圖8 免疫電極還原峰電流變化值對E Sakazakii濃度對數值的標準曲線
2.4 特異性
特異性是衡量免疫電極性能好壞的一個重要指標。實驗中選取 PBS空白液和 VP、E coli、S flexneri、S Aureus、B Cereus(濃度與 E Sakazakii相同,均為109cfu/mL)這些食品中常見致病微生物進行特異性實驗。圖9顯示免疫電極檢測E Sakazakii時,電流變化遠大于其他致病菌和PBS引起的電流變化(ΔIpc均小于0.3 μA),這表明該免疫電極具有較好的特異性。
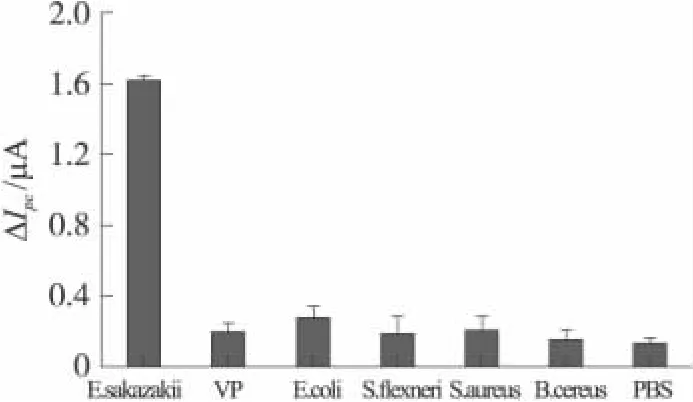
圖9 免疫電極的特異性
2.5 重現性、穩定性、準確性
2.5.1 重現性、穩定性
分別取不同批次制備的免疫電極對E Sakazakii進行測定,測定結果RSD<6%(n=7),這表明該免疫電極具有良好的重現性。將免疫電極于4℃下放置30 d,每隔5 d對電極測試并記錄其電流響應,并與只用Nafion包埋酶標抗體制作的免疫電極對照。圖10顯示,由 Nafion/[BMIM]PF6/HRP-anti-E Sakazakii制備免疫電極的響應信號為初始信號的95.50%(n=6),而對照組信號降至初始信號的88.10%。這說明離子液體[BMIM]PF6能有效地延長 HRP-anti-E Sakazakii的半衰期而保持其活性,使得免疫電極有較長的儲存周期。

圖10 免疫電極的儲存穩定性
2.5.2 準確性
根據免疫電極特異性實驗,當免疫電極檢測實際樣品的電流變化值ΔIpc≥0.3 μA時,將樣品定為陽性樣品,ΔIpc<0.3 μA 時定為陰性樣品。采用免疫電極檢測十種嬰幼兒配方奶粉,平行測3份,并與國標法比較。結果見表1,十種樣品均為陰性,兩種檢測方法結果一致。由于免疫電極檢測確定陰性樣品的判據是還原峰電流值變化 ΔIpc<0.3 μA,所以檢測結果存在假陰性的可能。本團隊利用感官評價中的三點檢驗法進一步檢測結果的準確性。實驗分為樣品制備和免疫電極檢測兩部分,由兩組人員獨立完成。樣品準備人員隨機選取三種無E Sakazakii檢出的奶粉,在其中兩種奶粉中接種E Sakazakii。經處理,制備六組試樣用于檢測,每組試樣包含3份,分別由3種奶粉制備。由作者用免疫傳感器對試樣檢測。表2顯示,免疫電極準確地鑒別出17份試樣是否被E Sakazakii污染,出現1例假陰性,出現假陰性的概率為5.56%。在清除電極表面NaCl和未免疫結合抗原過程中,沖洗強度過大是出現假陰性的主要原因,選擇更合適的試劑分散E Sakazakii是降低沖洗強度的有效方法。

表1 免疫電極準確性實驗結果(n=30)
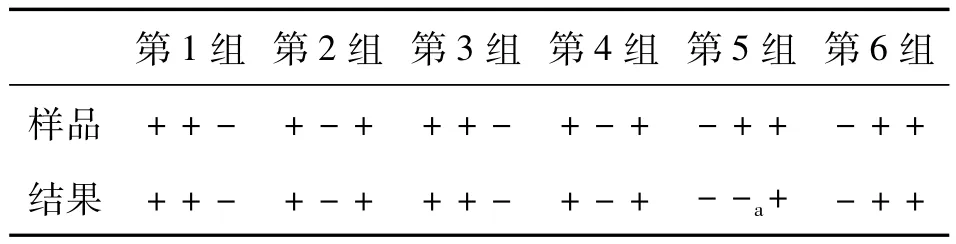
表2 免疫電極三點檢驗法準確性檢測的結果
3 結論
本文采用[BMIM]PF6/Nafion基質將HRP-anti-E Sakazakii固定于Nafion/MWCNT修飾的絲網印刷碳電極上,制成檢測E Sakazakii的免疫電極。該免疫電極具有較好的電化學信號、選擇性、重現性(RSD<6%)、準確性(出現假陰性的概率為5.56%)和儲存穩定性(4℃放置30 d后電流響應值問為初始值的 95.50%)。該方法檢測的線性范圍為>103cfu/mL~109cfu/mL。此免疫電極制作簡便、成本低廉,利用其檢測目標抗原簡單易行,有望成為快速檢測微生物的一種新方法。
[1]Joshoa B G,Jeffrey L K,Larry R B.Enterobacter Sakazakii:A coliform of Increased Concern to Infant Health[J].Food Microboil,2005,104(1):1-34.
[2]裴曉燕,劉秀梅.阪崎腸桿菌的生物學性狀與健康危害[J].中國食品衛生雜志,2004,16(1):550-555.
[3]ICMSF.Microorganism in Food Mumber 7.Microbiological Testing in Food Safety Management[R].Netherlands:Kluwer A Cadem ie/Plenum Publishers,2002.
[4]Joint FAO/WHO Workshop on Enterobacter Sakazakii and Other Microoganisms in Powdered Infant Formula,Geneva.2004-02-02-05.
[5]SN/T 1632.1—2005.奶粉中阪崎腸桿菌檢驗方法.第1部分[S].
[6]SN/T 1632.2—2005.奶粉中阪崎腸桿菌檢驗方法.第2部分[S].
[7]SN/T 1632.3—2005.奶粉中阪崎腸桿菌檢驗方法.第3部分[S].
[8]GB/T 4789.40—2008,食品衛生微生物學檢驗.阪崎腸桿菌檢驗[S].
[9]GB/T 4789.40—2010,食品衛生微生物學檢驗.阪崎腸桿菌檢驗[S].
[10]Ji Y B,Chankyu P,Insoo C,et al.Development of Multiplex Real-Time PCR with Internal Amplification Control for Simultaneous Detection of Salmonella and Cronobacter in Powdered Infant Formula[J].Food Microbiology,2010,144(1):177-181.
[11]Seung Y B,Hyun H J,Sun Y L.Inhibitory Effect of Organic Acids Against Enterobacter Sakazakii in Laboratory Media and Liquid Foods[J].Food Control,2009,20(10):867-872.
[12]Hongdeng Q,Shengxiang J,Xia L.N-Methylimidazolium Anion-Exchange Stationary Phase for High-Performance Liquid Chromatography[J].Chromatography A,2006,1103:265-270.
[13]Fenghua L,Ye J.Room Temperature Ionic Liquid as Matrix for the Determination of Residual Solvents in Pharmaceuticals by Static Gas Chromatography[J].Chromatography A,2007,1167(1):116-119.
[14]Pino V,Baltazar Q,Anderson J L.Examination of Analyte Partitioning to Monocationic and Dicationic Imidazolium-Based Ionic Liquid Aggrefates Using Solid-Phase Microextraction-Gas Chromatography[J].Chromatography A,2007,1148(1):92-97.
[15]Tolstogouzov A,Bardi U,Nishikawa O,et al.Mass Spectro-metricanalysis of Imidazolium-Basedionic Liquids by Scanning Atom Probe[J].International Journal of Mass Spectrometry,2009,281(1-2):37-40.
[16]Jean M A,Fabian J,Alfons B.Decolorization of Ionic Liquids for Spectroscopy[J].Supercritical Fluids,2010,55(1):395-400.
[17]Michal P M,Michal J M,Roman K.Separation of Nicotinic Acid and Its Structural Isomers Using 1-Ethyl-3-Methylimidazolium I-onic Liquid as a Buffer Additive by Capillary Electrophoresis[J].Pharmaceutical and Biomedical Analysis,2006,41:329-332.
[18]Wilkes J S,Zaworotko M J.Air and Water Stable 1-Ethyl-3-Methylimidazolium Based Ionic Liquids[J].Chem.Soc.Chem.Commun,1992,13:965-967.
[19]Fuller J,Carlin R T,Osteryoung R A.The Room Temprature Ionic Liquid 1-Ethyl-3-Methylimidazolium Tetrafluoroborate:Electrochemical Couples and Physical Properties[J].Electrochem.Soc.,1997,144(11):3881-3885.
[20]Kaar J L,Jesionowski A M,Berterich J A,et al.Impact of Ionic Liquid Physical Properties on Lipase Activity and Stability[J].Chem.Soc.,2003,125(14):4125-4131.
[21]Mori M,Garcia R G,Belleville M P,et al.A New Way to Conduct Enzymatic Synthesis in an Active Membrane Using Ionic Liquids as Catalyst Support[J].Catalysis Taday,2005,104(3):313-317.
[22]Fei X,Faqiong Z,Deping,et al.Nonenzymatic Glucose Sensor Based on Ultrasonic-Electrodeposition of Bimetallic PtM(M=Ru,Pd and Au)Nanoparticles on Carbon Nanotubes-Ionic Liquid Composite Film[J].Biosensor and Bioelectronics,2009,24(12):3481-3486.
[23]Afsaneh S,Norouz M,Elaheh F.Fabrication of a Glucose Sensor Based on a Novel Nanocomposite Electrode[J].Biosensor and Bioelectronics,2009,24(6):1655-1660.
[24]Meunier V,Lambin P H.Tight-Binding Computation of the STM Image of Carbon Nanotubes[J].Phys Pev Lett,1998,81(25):5588-5591.
[25]Kasumov A,Deblock R,Kociak M,et al.Supercurrents Through Single-welled Carbon Nanotubes[J].Science,1999,284:1508-1511.
[26]Collins P G,Zettl A,Bando H,et al.Nanatube Nanodevice[J].Science,1997,278(5335):100-102.
[27]Wang L,Yuan Z B.Direct Electrochemistry of Glucose Oxidase at a Gold Electrode Modified With Single-Wall Carbon Nanotubes[J].Sensor,2003,3(12):544-554.
[28]Cai C X,Chen J.Direct Electron Transfer of Glucose Oxidase Promoted by Carbon Nanotubes[J].Analytical Biochemistry,2004,332(2):75-83.
[29]趙廣英,詹學佳.一次性免疫傳感器電極快速檢測福氏志賀氏菌的研究[J].傳感技術學報,2009,22(9):1221-1226.
[30]林偉,黃世震,陳文哲.射頻反應磁控濺射SnO2/MWCNTs薄膜材料的氣敏性能研究[J].傳感技術學報,2009,22(6):771-775.
[31]惠國華,陳裕泉.基于納米管微傳感器陣列和隨機共振的氣體檢測方法研究[J].傳感技術學報,2010,23(2):179-182.
[32]Yu C T,Ping C H,Yen W L,et al.Silver Nanoparticles in Multi-Walled Carbon Nanotube-Nafion for Surface-Enhanced Raman Scattering Chemical Sensor[J].Sensor and Actuators B,2009,138,5-8.
[33]許紅巖,王麗莉,王彥懷,等.沒食子酸在Nafion/單壁碳納米管/聚(3-甲基噻吩)復合膜修飾電極上的電化學行為及測定[J].傳感技術學報,2009,21(7):1113-1118.
[34]Upadhyay A K,Ya Y P,Shen M C.Immobilization of Horseradish Peroxidase and Nile Blue into the Ormosil Nanocomposite for the Fabrication of Hydrogen Peroxide Biosensor Based on MWCNT Modified Glassy Carbon Electrode[J].Sensors and Actuators B,2009,141:557-565.
[35]Manesh K M,Hyun T K,Santhosh P,et al.A Novel Glucose Biosensor Based on Immuobilization of Glucose Oxidase into Multi-Wall Carbon Nanotubes-Polyelectrolyte-Loaded Electro Spun Nanofibrous Membrane[J].Biosensors and Bioelectronics,2008,23:771-779.
[36]王美芳,張偉,方賓.基于Nafion/碳納米粒子修飾的葡萄糖傳感器[J].分析化學,2010,38(1):125-128.
[37]Upadhyay A K,PengY Y,ChenSM.Immobilizationof Horseradish Peroxidase and Nile Blue into the Ormosil Nanocomposite for the Fabrication of Hydrogen Peroxide Biosensor Based on MWCNT Modified Glassy Carbon Electrode[J].Sensors and Actuators B,2009,141:557-565.
[38]Anantha I G,Kwang P L,Dhanusuraman R,et al.An Electrochemical Glucose Biosensor Exploiting a Polyaniline Grafted Multiwalled Carbon Nanotube/Perfluorosulfonate Ionomer-Silica Nanocomposite[J].Biomaterials,2009,30:5999-6005.
[39]趙廣英,吳淑春.基于四通道絲網印刷碳電極的禽流感(H5N1)抗體電化學免疫傳感器的研制[J].傳感技術學報,2008,21(8):1295-1300.

