金黃色葡萄球菌特異性PCR檢測靶點的自動化篩選
范一靈,朱東升,胡瑜,史賢明
1 上海交通大學(xué)農(nóng)業(yè)與生物學(xué)院陸伯勛食品安全研究中心 中美食品安全聯(lián)合研究中心,上海 200240
2 上海市食品藥品檢驗所,上海 201203
3 聯(lián)合利華 (上海) 研發(fā)中心 聯(lián)合利華中國研究所,上海 200335
金黃色葡萄球菌特異性PCR檢測靶點的自動化篩選
范一靈1,2,朱東升1,3,胡瑜1,史賢明1
1 上海交通大學(xué)農(nóng)業(yè)與生物學(xué)院陸伯勛食品安全研究中心 中美食品安全聯(lián)合研究中心,上海 200240
2 上海市食品藥品檢驗所,上海 201203
3 聯(lián)合利華 (上海) 研發(fā)中心 聯(lián)合利華中國研究所,上海 200335
旨在挖掘用于鑒定金黃色葡萄球菌的高特異性靶點及其PCR檢測引物。采用C++語言編程,以金黃色葡萄球菌Staphylococcus aureus MRSA 252基因組編碼序列為對象,對2 656個可編碼區(qū)進(jìn)行分析,獲得特異性靶點序列,并設(shè)計PCR擴(kuò)增引物。對包括葡萄球菌屬11個種及其他細(xì)菌屬在內(nèi)的共計137株細(xì)菌驗證引物特異性,篩選獲得9個DNA序列,并設(shè)計了4對引物。經(jīng)驗證2對引物的特異性較好,其中引物SA3的基因組DNA檢測限為13.7 fg/μL,菌體檢測限為9.25×102CFU/mL。結(jié)果驗證了特異性DNA靶點篩選平臺的實用性,該方法突破了傳統(tǒng)特異性靶點挖掘方法對檢測對象的限制,適用性廣,可移植性強(qiáng)。
金黃色葡萄球菌,基因組,生物信息比對分析,編碼序列,C++編程
Abstract:The aim of this study was to establish a fast and accurate method for developing specific DNA sequences and PCR primers for the detection of Staphylococcus aureus. An automatic C++ program for genomic comparison was used to identify specific DNA sequences from the genome of S. aureus MRSA 252. Four primer pairs were obtained from 9 specific target sequences by comparison of 2656 coding sequences with our local genome database, and 2 pairs of primers were confirmed to be specific to S. aureus by PCR evaluation against 137 bacterial strains, including 11 species of Staphylococcus. Furthermore, the DNA detection sensitivity of primer SA3 was 13.7 fg/μL and the cell sensitivity for this primer was 9.25×102CFU/mL. This method has overcome the limitations of specific target mining in conventional assays, and it could be easily and widely used forother foodborne pathogens.
Keywords:Staphylococcus aureus, genome, bioinformatic comparison analysis, coding sequence, C++ programming
金黃色葡萄球菌 Staphylococcus aureus是一種重要的食源性和醫(yī)源性致病菌[1],它可以分泌多種毒力因子,如腸毒素 (Staphylococcal enterotoxins,SEs)、毒素休克綜合征毒素-1 (Staphylococcal toxic shock syndrome-1,TSST-1)、表皮剝脫毒素 (Exfoliative toxins,ETs)、葡萄球菌溶素 (Staphylolysin) 和凝固酶 (Coagulase) 等,可以引起食物中毒、毒素休克綜合征、骨髓炎、壞死性肺炎和心內(nèi)膜炎等嚴(yán)重疾病[2-3]。在國家標(biāo)準(zhǔn)檢驗方法中金黃色葡萄球菌檢測方法仍然采用傳統(tǒng)培養(yǎng)分離法,需要 5~6 d才能得到檢驗結(jié)果[4]。快速、有效地檢測和鑒別金黃色葡萄球菌是急需解決的問題之一。近些年,以特異性DNA片段為靶點的分子生物學(xué)檢測手段作為一種快速檢測方法已被廣泛采用[3,5-10]。
細(xì)菌特異性 DNA是指僅存在于某一目標(biāo)細(xì)菌基因組內(nèi)、而在其他非目標(biāo)細(xì)菌基因組內(nèi)缺失或者變異、可用于特異性檢測和鑒定該目標(biāo)細(xì)菌的DNA片段[3]。在細(xì)菌的分子生物學(xué)檢測中,常用的特異性保守區(qū)域DNA片段多位于16S rRNA和23S rRNA區(qū)。另外,nuc1基因是檢測金黃色葡萄球菌的重要靶點,它可以編碼產(chǎn)生一種金黃色葡萄球菌特有的與凝固酶相關(guān)的耐熱核酸酶 (TNase)[6-8,11]。除了上述檢測靶點外,其他特異基因片段還有coa基因[12]和tRNA間隔序列等[3,5]。然而,上述目標(biāo)DNA的檢測位點的發(fā)現(xiàn)經(jīng)歷了十分漫長的研究過程。
隨著致病微生物基因組數(shù)據(jù)的增加,生物信息學(xué)、基因組學(xué)和蛋白質(zhì)組學(xué)的不斷發(fā)展,大規(guī)模的基因組比對分析和蛋白質(zhì)功能預(yù)測為快速、高效地發(fā)掘特異性DNA靶點提供了可能[13-15]。通過自動化程序?qū)蚪M數(shù)據(jù)庫編碼序列 (Coding sequences,CDS) 的比對和篩選,可以大幅度提高特異性檢測位點的發(fā)掘效率。
本研究在組建本地細(xì)菌基因組數(shù)據(jù)庫的基礎(chǔ)上,建立了基于 C++編程的金黃色葡萄球菌特異性DNA序列自動化篩選方法。利用該方法對金黃色葡萄球菌MRSA 252的全基因組編碼序列進(jìn)行分析,以獲得特異性DNA片段。
1 材料與方法
1.1 細(xì)菌培養(yǎng)及基因組DNA提取
本實驗所用菌株共 137株,其中金黃色葡萄球菌分離株來自臨床樣本 (表 1)。實驗所用菌株均接種于Luria-Bertani (LB) 培養(yǎng)基中,160 r/min、37 ℃振蕩培養(yǎng)18 h備用。
細(xì)菌基因組DNA提取和純化采用QIAGEN公司DNeasy Blood and Tissue Kit試劑盒,按試劑盒說明書操作,用 100 μL TE緩沖液洗脫細(xì)菌基因組DNA,存放于?20 ℃?zhèn)溆谩?/p>
1.2 基因組CDS自動化比對
在GenBank細(xì)菌全基因組數(shù)據(jù)庫 (ftp://ftp.ncbi.nlm.nih.gov) 中,選取具有代表性的139個細(xì)菌的基因組數(shù)據(jù),利用Blast軟件 (版本號Blast-2.2.9-ia32)建立本地基因組數(shù)據(jù)庫 (不包含 14個金黃色葡萄球菌基因組信息)。采用基于C++平臺的基因組CDS比對程序[16],分析金黃色葡萄球菌MRSA252的全基因組CDS信息 (文件來源NCBI數(shù)據(jù)NC_002952.ffn)。篩選參數(shù)為E>4.0,L>400 bp,由程序自動比對每個Blast生成文件中的E值。對程序篩選出的CDS序列通過網(wǎng)上 Blast比對 (http://blast.ncbi.nlm.nih.gov),驗證自動篩選的CDS特異性。
1.3 引物的設(shè)計及PCR檢測
采用PRIMER PREMIER 5.0軟件,對篩選出的CDS區(qū) DNA序列設(shè)計引物 (表 1)。引物由上海生工生物工程技術(shù)服務(wù)有限公司合成。
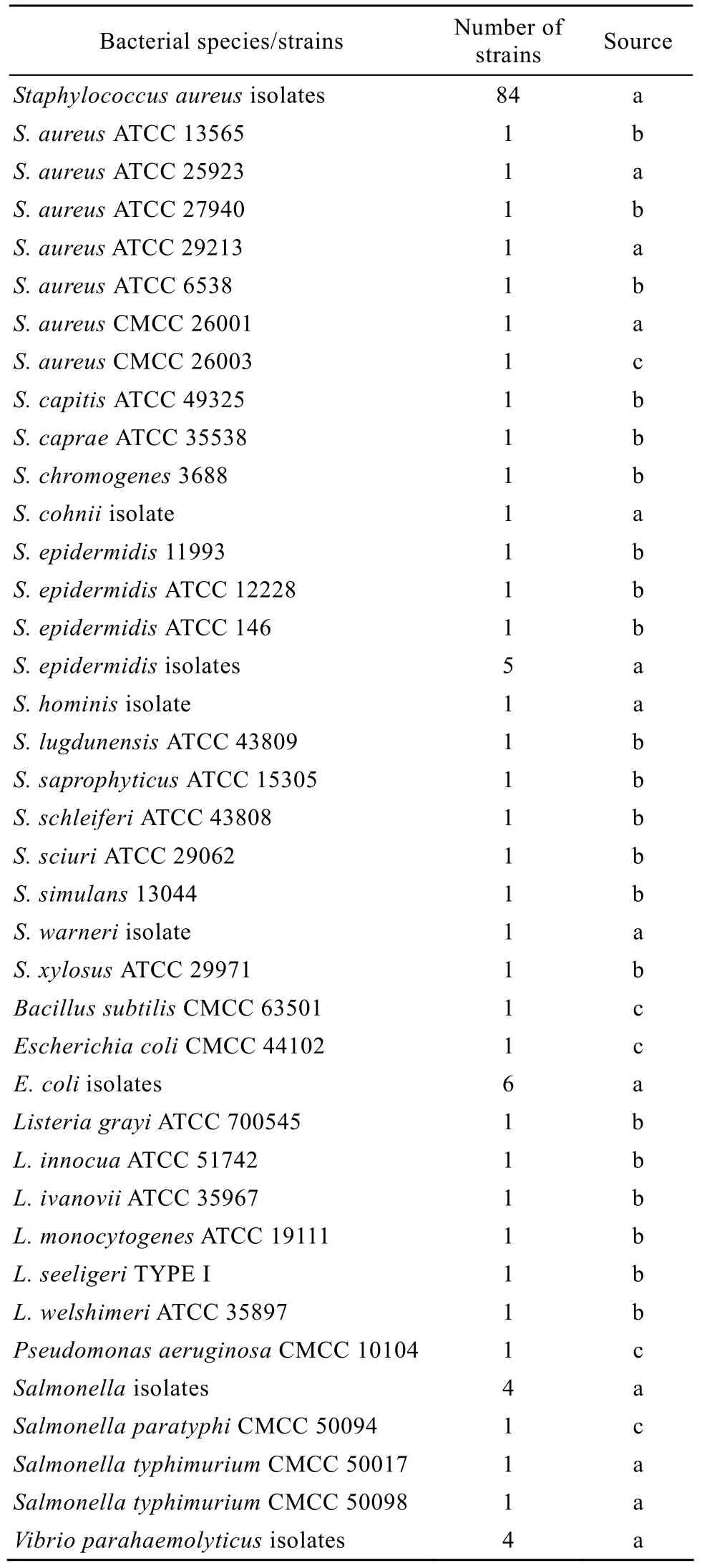
表1 實驗菌株Table 1 Bacteria strains tested in this assay
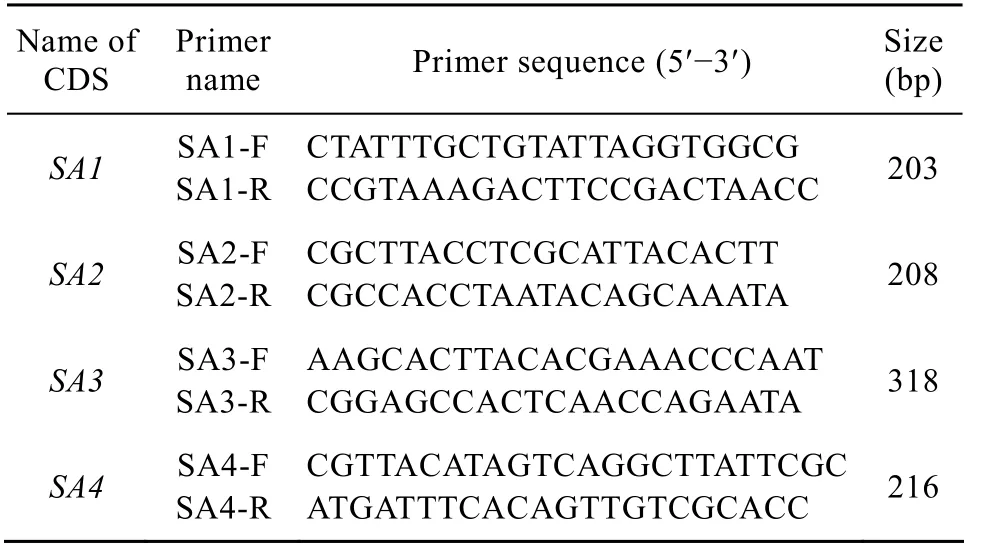
表2 特異性CDS區(qū)段的PCR擴(kuò)增引物Table 2 PCR primers against specific CDS
PCR擴(kuò)增體系為:1.0 μL細(xì)菌基因組DNA;1 U rTaq DNA聚合酶 (天根生化科技有限公司,北京);1×PCR 緩沖液 [200 mmol/L Tris-HCl(pH 8.4);200 mmol/L KCl;100 mmol/L (NH4)2SO4];2.0 mmol/L MgCl2;4種 dNTPs各 0.25 mmol/L;上、下游引物各10 nmol/L;加蒸餾水至25 μL。
采用 Peltier Thermal Cycler PTC-200 PCR儀(Bio-Rad Laboratories,USA) 進(jìn)行PCR擴(kuò)增。反應(yīng)條件為:105 ℃熱蓋;95 ℃變性5 min;95 ℃變性30 s,56 ℃退火30 s,72 ℃延伸 30 s,30個循環(huán);72 ℃延伸 5 min。
將6 μL PCR產(chǎn)物經(jīng)1.0%瓊脂糖凝膠電泳,用10 μg/mL的EB溶液染色15 min,置于紫外成像儀(MultiImage Light Cabinet, Alphalmager) 內(nèi)觀察。DNA分子量標(biāo)準(zhǔn)選用100 bp DNA ladder (天根生化科技有限公司,北京)。
1.4 引物特異性評價和檢測限評價
初步評價實驗選擇15株細(xì)菌,包括11株金黃色葡萄球菌和4株非金黃色葡萄球菌。在上述PCR檢測體系中,利用設(shè)計的 4對引物對細(xì)菌基因組DNA進(jìn)行擴(kuò)增,評價引物的特異性。將初步評價結(jié)果較好的特異性引物,應(yīng)用于全部其他細(xì)菌的檢測驗證中。
選取特異性較高的引物進(jìn)行檢測限的評價,分別采用金黃色葡萄球菌標(biāo)準(zhǔn)菌株 CMCC 26003的基因組 DNA濃度 10倍稀釋組和細(xì)菌菌體濃度 10倍稀釋組,對引物的DNA檢測限和菌體檢測限兩項指標(biāo)進(jìn)行評價。基因組 DNA的濃度梯度為:1.37×107、1.37×106、1.37×105、1.37×104、1.37×103、1.37×102、13.7、1.37 fg/μL。細(xì)菌菌體濃度梯度為:9.25×106、9.25×105、9.25×104、9.25×103、9.25×102、9.25、0.925、0 CFU/mL (空白對照)。
1.5 人工污染樣品的制備
取新鮮雞蛋蛋液200 g,混勻后分成蛋液含量為25.0 g的樣品8份。其中隨機(jī)抽取2份蛋液,按照國標(biāo) GB/T 4789.10-2008金黃色葡萄球菌檢驗中規(guī)定的方法進(jìn)行檢驗。其余6份蛋液分為3組,向3組蛋液中加入金黃色葡萄球菌標(biāo)準(zhǔn)菌株 CMCC 26003菌懸液,接種量分別為9.25×102CFU/25 g、9.25 CFU/25 g和0.925 CFU/25 g。將人工污染的蛋液樣品加入到225 mL生理鹽水中混勻,吸取5 mL上述液體加入50 mL 7.5% NaCl肉湯中培養(yǎng)8 h。取1 mL肉湯培養(yǎng)物,按1.3中所述步驟進(jìn)行PCR檢測。每組做 2個平行試驗。人工污染的樣品的后續(xù)步驟仍按國標(biāo)方法進(jìn)行檢測,比較兩種方法的檢測結(jié)果。
1.6 食品污染調(diào)查應(yīng)用
調(diào)查市售加工點心類產(chǎn)品,包括漢堡、壽司、三明治、中西式糕點、包子、月餅、批薩和肉卷等共計185件,按國標(biāo)規(guī)定的前處理方法進(jìn)行增菌培養(yǎng),取增菌肉湯1 mL采用本研究所用引物和PCR擴(kuò)增條件進(jìn)行檢查;并同時取增菌肉湯分別采用DuPont BAX Q7熒光定量PCR方法和國標(biāo)方法進(jìn)行檢查,比較三者對金黃色葡萄球菌的檢出情況。
2 結(jié)果
2.1 特異性CDS的自動化篩選
金黃色葡萄球菌MRSA 252全基因組包含已注釋的編碼序列共有2 656個,通過C++篩選程序,獲得9個E>4.0且L>400 bp的CDS,分別命名為編碼區(qū) SA1至 SA9 (表 3)。通過比對驗證,選出 4個特異性較好的CDS區(qū)設(shè)計檢測引物。
2.2 引物的特異性評價
將SA1-SA4這4對引物分別對11株金黃色葡萄球菌和4株非金黃色葡萄球菌的基因組DNA進(jìn)行PCR擴(kuò)增實驗。引物SA2和SA3對所用金黃色葡萄球菌 DNA 具有特異性 (圖 1)。137株細(xì)菌基因組DNA的PCR試驗結(jié)果表明:引物SA2和SA3可以特異性鑒別金黃色葡萄球菌基因組DNA,試驗所用非金黃色葡萄球菌基因組DNA未見PCR擴(kuò)增條帶(包括葡萄球菌屬內(nèi)的其他13個種)。

表3 金黃色葡萄球菌特異性CDS的自動化篩選Table 3 Screening of specific CDS from S. aureus

圖1 金黃色葡萄球菌4對PCR引物的特異性驗證圖Fig. 1 PCR specificity evaluations on four primers for S. aureus. 1?15: results for primer SA1; 17?31: results for primer SA2;33?47: results for primer SA3; 49?63: results for primer SA4. The bacterial strains (From left to right) tested for each pair of primers were S. aureus ATCC 27940, S. aureus ATCC 13565, S. aureus ATCC 25923, S. aureus ATCC 6538, S. aureus CMCC 26001, S. aureus ATCC6538, S. aureus ATCC25923, S. aureus ATCC12228, S. aureus ATCC29213, S. aureus strain B255, V.Parahaemolyticus strian 39001, Salmonella strain T16, S. aureus strain G64, S. capitis ATCC 49325 and E. coli strain 133; 16, 32,48: standard DNA marker.
2.3 引物的檢測限評價
通過PCR退火溫度梯度試驗 (48 ℃~62 ℃) 和鎂離子濃度梯度試驗 (0.5~3.0 mmol/L),對引物進(jìn)行反應(yīng)條件優(yōu)化。在56 ℃溫度下退火,鎂離子濃度為2.0 mmol/L時,引物SA2和SA3的PCR產(chǎn)物具有明亮的單一擴(kuò)增條帶,PCR擴(kuò)增效率較高。
根據(jù)特異性評價結(jié)果,采用優(yōu)化的 PCR反應(yīng)條件評價引物的檢測限。引物SA2的基因組DNA檢測限為 137 fg/μL (圖 2,Lane 6);引物 SA3的基因組 DNA檢測限為 13.7 fg/μL (圖 2,Lane 15)。另外,引物SA2和引物SA3的菌體檢測限都能達(dá)到9.25×102CFU/mL (圖 3,Lane 5 和 Lane 15)。
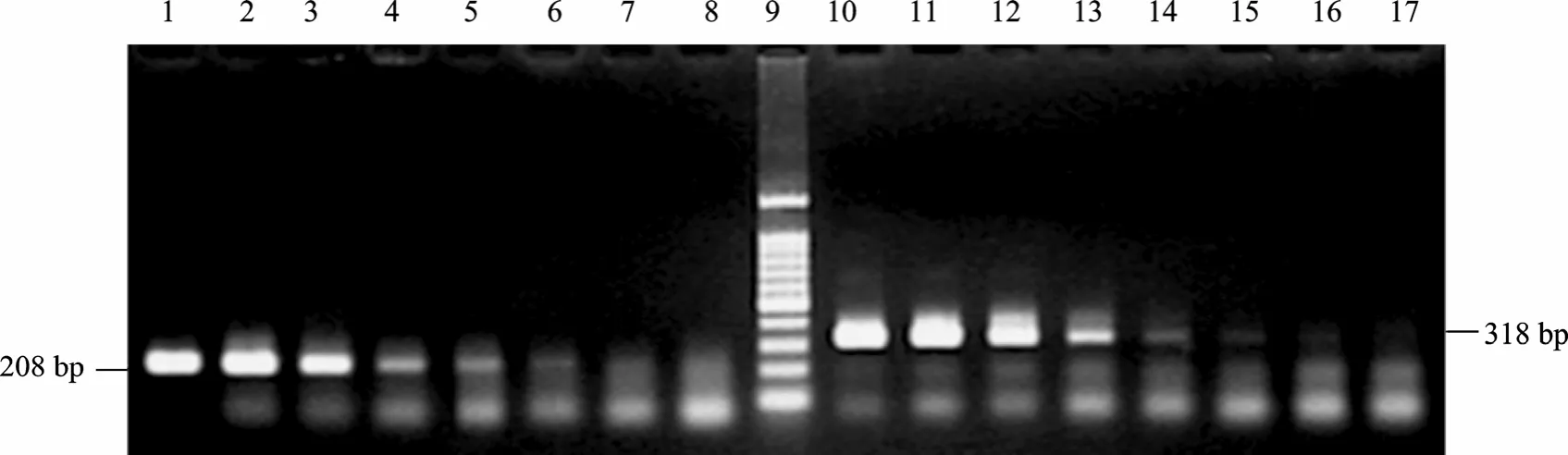
圖2 引物SA2和SA3的基因組DNA檢測限試驗PCR擴(kuò)增結(jié)果Fig. 2 PCR amplification of sensitivity tests genomic DNA of primer SA2 and SA3. 1?8: primer SA2 were applied; 10?17: primer SA3 were applied; 9: standard DNA marker. The genomic DNA of S. aureus ATCC 6538 were 1.37×107fg/μL, 1.37×106fg/μL,1.37×105fg/μL, 1.37×104fg/μL, 1.37×103fg/μL, 1.37×102fg/μL, 13.7 fg/μL and 1.37 fg/μL, respectively.

圖3 引物SA2和SA3細(xì)菌菌體檢測限試驗PCR擴(kuò)增結(jié)果Fig. 3 PCR amplification of cell sensitivity tests for primer SA2 and SA3. 1?9: primer SA2 were applied; 11?19: primer SA3 were applied. 1?9 and 11?19: the cell concentrations of S. aureus CMCC 26003 were 9.25×106CFU/mL, 9.25×105CFU/mL,9.25×104CFU/mL, 9.25×103CFU/mL, 9.25×102CFU/mL, 9.25 CFU/mL, 0.925 CFU/mL and negative control, respectively; 10:standard DNA marker (From bottom to top: 100 bp, 250 bp, 500 bp, 750 bp, 1 000 bp and 2 000 bp).
2.4 人工污染雞蛋樣品和食品污染調(diào)查應(yīng)用
采用PCR方法 (含有引物SA2或SA3) 和國標(biāo)方法均能檢出樣品中含接種量為9.25×102CFU/25 g和 9.25 CFU/25 g的金黃色葡萄球菌;然而,在含0.925 CFU/25 g金黃色葡萄球菌樣品檢測中,由于
接種量太低,國標(biāo)方法和PCR方法均得到陰性結(jié)果。在調(diào)查檢驗市售 185件樣品中,通過本研究的檢測方法共檢出金黃色葡萄球菌陽性3株,占全部樣品的1.62%,與BAX Q7檢測系統(tǒng)和國標(biāo)檢測方法得到的結(jié)果相同。
3 討論
傳統(tǒng)微生物特異性 DNA序列的發(fā)掘是基于對已知細(xì)菌特異性蛋白質(zhì)的分析,然后對調(diào)控或編碼該特異蛋白質(zhì)的基因或DNA片段進(jìn)行研究[3]。其中,不少序列既有種內(nèi)特異性又存在多態(tài)性,如 coa基因和 16S rRNA序列在金黃色葡萄球菌種的最低相似度僅為79%,只有尋找這些區(qū)段內(nèi)相對保守的部分進(jìn)行引物設(shè)計來提高特異性。本實驗通過生物信息學(xué)方法篩選出的4個金黃色葡萄球菌CDS區(qū)不存在種內(nèi)多態(tài)性,保守性好。SA2基因在金黃色葡萄球菌種內(nèi)相似性在 99%以上,SA1、SA3和 SA4基因在金黃色葡萄球菌種內(nèi)相似性不低于93%。
分析金黃色葡萄球菌CDS序列對應(yīng)的蛋白質(zhì)產(chǎn)物信息可知,這些編碼序列均與細(xì)胞膜和細(xì)胞壁物質(zhì)轉(zhuǎn)運(yùn)和調(diào)控的基因有關(guān) (表3)。其中,SA1和SA3的表達(dá)產(chǎn)物分別為透性酶SirC和SirB (Siderophore compound ABC transporter permease protein SirC and SirB)。通過對Sir系列蛋白質(zhì)序列的分析研究顯示,許多細(xì)菌都含有類似 ABC轉(zhuǎn)運(yùn)子功能的離子轉(zhuǎn)運(yùn)蛋白[18-20],如表面葡萄球菌和沙門氏菌等[20-22]。通過DNA序列分析,金黃色葡萄球菌的sirB和sirC基因都具有很好的保守性[23],和本研究的結(jié)論相符。由于sirB和sirC基因可能是多拷貝基因[24],更適合用于對靈敏度要求較高的致病菌檢測方法。SA2的表達(dá)產(chǎn)物為蔗糖專屬 PTS轉(zhuǎn)運(yùn)蛋白轉(zhuǎn)錄調(diào)控基因(Sucrose-specific PTS transporter protein RpiR family transcriptional regulator)。RpiR蛋白可能與編碼磷酸核糖異構(gòu)酶的rpiB基因調(diào)控有關(guān)[25]。SA4則被推定為細(xì)胞壁纖維連接蛋白基因,其表達(dá)產(chǎn)物是一個推定蛋白EbhB (Cell wall associated fibronectin-binding protein,hypothetical protein EbhB)。通過基因組比對發(fā)現(xiàn) ebh基因廣泛存在于金黃色葡萄球菌基因組中[26],與本實驗結(jié)果相吻合。
大量可供分析的微生物基因組序列信息已成為生物信息學(xué)研究的重要內(nèi)容[13-15]。本研究結(jié)合 C++程序調(diào)用Blast軟件,對金黃色葡萄球菌基因組進(jìn)行自動比對,篩選編碼區(qū)特異性DNA序列。該方法簡單實用,可以快速鎖定微生物特異性檢測位點,提高比對效率,為建立基于微生物特異性DNA序列的快速檢測方法提供了大量關(guān)鍵的備選目標(biāo)區(qū)間。
致謝:真誠感謝美國農(nóng)業(yè)部東部研究中心George C.Paoli博士為本研究提供了大量標(biāo)準(zhǔn)菌株。
REFERENCES
[1] Crossley KB, Archer GL. The Staphylococci in Human Disease. 2nd ed. New York: Churchill Livingstone, 1998:253?255.
[2] Cowie SE, Ma I, Lee SK, et al. Nosocomial MRSA infection in vascular surgery patients: impact on patient outcome. Vasc Endovas Surg, 2005, 39(4): 327?334.
[3] Fan YL, Pan F, Shi XM. Common target genes of Staphylococcus aureus in molecular detection technique. J Microbiol, 2008, 28(3): 72?76.
范一靈, 潘峰, 史賢明. 金黃色葡萄球菌分子檢測技術(shù)的常用靶基因. 微生物學(xué)雜志, 2008, 28(3): 72?76.
[4] GB/T 4789.10-2008, Detection of Staphylococcus aureus.Beijing: Standards Press of China, 2008.GB/T 4789.10-2008, 金黃色葡萄球菌檢驗. 北京: 中國標(biāo)準(zhǔn)出版社, 2008.
[5] Drancourt M, Raoult D. rpoB gene sequence-based identification of Staphylococcus species. J Clin Microbiol,2002, 40(4): 1333?1338.
[6] Brakstad OG, Aasbakk K, Maeland JA. Detection of Staphylococcus aureus by polymerase chain reaction amplification of the nuc gene. J Clin Microbiol, 1992,30(7): 1654?1660.
[7] Wilson IG, Cooper JE. Gilmour A. Detection of enterotoxigenic Staphylococcus aureus in dried skimmed milk: use of the polymerase chain reaction for amplification and detection of staphylococcal enterotoxin genes entB and entC1 and the thermonuclease gene nuc.Appl Environ Microbiol, 1991, 57(6): 1793?1798.
[8] Thomas LC, Gidding HF, Ginn AN, et al. Development of a real-time Staphylococcus aureus and MRSA (SAM-)PCR for routine blood culture. J Microbiol Methods, 2007,68(2): 296?302.
[9] Fan YL, Pan F, Paoli GC, et al. Development of a multiplex PCR method for detection of the genes encoding 16S rRNA, coagulase, methicillin resistance and enterotoxins in Staphylococcus aureus. J Rapid Methods Autom Microbiol, 2008, 16(4): 394?411.
[10] Wang XH, Xie BJ, Shi XM. Detection of Staphylococcus aureus pathogenetic factor by PCR. Food Machin, 2004,20(3): 48?50.
王小紅, 謝筆鈞, 史賢明. 金黃色葡萄球菌致病因子檢測的PCR方法. 食品與機(jī)械, 2004年, 20(3): 48?50.
[11] Tang JN, Zhou R, Shi XM, et al. Two thermostable nucleases coexisted in Staphylococcus aureus: evidence from mutagenesis and in vitro expression. FEMS Microbiol Lett, 2008, 284(2): 176?183.
[12] Maes N, De Gheldre Y, De Ryck R, et al. Rapid and accurate identification of Staphylococcus species by tRNA intergenic spacer length polymorphism analysis. J Clin Microbiol, 1997, 35(10): 2477?2481.
[13] Altschul SF, Gish W, Miller W, et al. Basic local alignment search tool. J Mol Biol, 1990,215(3): 403?410.
[14] Johnson M, Zaretskaya I, Raytselis Y, et al. NCBI BLAST:a better web interface. Nucleic Acids Res, 2008(36): 5?9.
[15] Karlin S, Altschul SF. Methods for assessing the statistical significance of molecular sequence features by using general scoring schemes. Proc Natl Acad Sci USA, 1990,87(6): 2264?2268.
[16] Zhu DS, Zhou M, Fan YL, et al. Identification of new target sequences for PCR detection of Vibrio parahaemolyticus by genome comparison. J Rapid Methods Autom Microbiol, 2009, 17(1): 67?79.
[17] Tian J, Ji R, Yang J, et al. Staphylococcus aureus in food determined by polymerase chain reaction. J Hygiene Res,2007, 36(2): 183?186.
田靜, 計融, 楊軍, 等. PCR方法快速檢測食品中的金黃色葡萄球菌. 衛(wèi)生研究, 2007, 36(2): 183?186.
[18] Linton KJ, Higgins CF. The Escherichia coli ATP-binding cassette (ABC) proteins. Mol Microbiol, 1998, 28(1):5?13.
[19] Nikaido H, Hall JA. Overview of bacterial ABC transporters. Methods Enzymol, 1998(292): 3?20.
[20] Boos W, Eppler T. Prokaryotic Binding Protein-Dependent ABC Transporters. Microbial Transport Systems,Germany: Wiley-VCH, 2003: 77?114.
[21] Heinrichs JH, Gatlin LE, Kunsch C, et al. Identification and characterization of SirA, an iron-regulated protein from Staphylococcus aureus. J Bacteriol, 1999, 181(5):1436?1443.
[22] Hill PJ, Cockayne A, Landers P, et al. SirR, a novel iron-dependent repressor in Staphylococcus epidermidis.Infect Immun, 1998, 66(9): 4123?4129.
[23] Dale SE, Sebulsky MT, Heinrichs DE. Involvement of SirABC in iron-siderophore import in Staphylococcus aureus. J Bacteriol, 2004, 186(24): 8356?8362.
[24] Rakeman JL, Bonifield HR, Miller SI. A HilA-independent pathway to Salmonella typhimurium invasion gene transcription. J Bacteriol, 1999, 181(10):3096?3104.
[25] Sorensen KI, Hove-Jensen B. Ribose catabolism of Escherichia coli: characterization of the rpiB gene encoding ribose phosphate isomerase B and of the rpiR gene, which is involved in regulation of rpiB expression. J Bacteriol, 1996, 178(4): 1003?1011.
[26] Tanaka Y, Sakamoto S, Kuroda M, et al. A helical string of alternately connected three-helix bundles for the cell wall-associated adhesion protein Ebh from Staphylococcus aureus. Structure, 2008, 16(3): 488?496.
Screening of specific target sequences for the PCR detection of Staphylococcus aureus by automatic genomic comparison
Yiling Fan1,2, Dongsheng Zhu1,3, Yu Hu1, and Xianming Shi1
1 Joint Sino-US Food Safety Research Center & Bor Luh Food Safety Center, School of Agriculture and Biology, Shanghai Jiao Tong University,Shanghai 200240, China
2 Shanghai Institute for Food and Drug Control, Shanghai 201203, China
3 Unilever Discover Shanghai, Unilever Research and Development Shanghai, Shanghai 200335, China
Received: July 8, 2010; Accepted: January 20, 2011
Supported by: National Key Technology Research and Development Program of China (No. 2009BAK43B31), Science and Technology Commission of Shanghai Municipality (Nos. 10142201300, 08142200700, 08391911000).
Corresponding author: Xianming Shi. Tel/Fax: +86-21-34206616; E-mail: xmshi@sjtu.edu.cn
國家科技支撐計劃 (No. 2009BAK43B31),上海市科委項目 (Nos. 10142201300, 08142200700, 08391911000) 資助。

