利用雨生紅球藻表達系統高通量篩選活力提高的阿特拉津氯水解酶突變子
王繪磚,陳喜文,郝曉華,陳德富
南開大學生命科學學院 分子遺傳學實驗室,天津 300071
呼延霆,尹大川,王偉,宋凱,王燕,盧慧甍,楊慧,薛小平
西北工業大學生命學院,西安 710072
利用雨生紅球藻表達系統高通量篩選活力提高的阿特拉津氯水解酶突變子
王繪磚,陳喜文,郝曉華,陳德富
南開大學生命科學學院 分子遺傳學實驗室,天津 300071
阿特拉津氯水解酶定向改造的關鍵是開發一種廉價的、表型改變明顯的高通量篩選方法。利用高錯誤傾向PCR和DNA洗牌相結合的突變方法,對來源于假單胞菌ADP和節桿菌AD1的阿特拉津氯水解酶基因進行隨機突變,以雨生紅球藻為受體、以阿特拉津為選擇壓力對突變文庫進行高通量篩選。篩選到的12個突變子序列分析顯示,突變均為點替換,位點分散在全基因上,是在高錯誤傾向PCR及DNA洗牌過程中逐漸累積形成的。酶活力分析顯示,突變子的酶活力均高于野生株,在添加1.0 mg/L阿特拉津培養液中的活力是野生株的1.9~3.6倍,在添加2.0 mg/L阿特拉津培養液中的活力是野生株的1.7~2.6倍,粗酶提取物的活力是野生株的1.7~2.7倍。上述結果表明,雨生紅球藻表達系統是定向改造阿特拉津氯水解酶的高通量篩選平臺。
阿特拉津氯水解酶,定向進化,雨生紅球藻,高通量篩選,酶活性
Abstract:Developing a high-throughput screening method is of great importance for directed evolution of atrazine chlorohydrolase.A mutagenesis library of atzA from Pseudomonas sp. ADP and Arthrobacter sp. AD1 was constructed using error-prone PCR and DNA shuffling. Candidate mutants were screened through Haematococcus pluvialis expression system, using atrazine as selection pressure. Sequence analysis showed that mutations in the obtained 12 mutants with enhanced activity were all point-substitutions and scattered throughout the gene. Enzymatic activity analysis showed that the mutants all had higher activities than that of the wild type.The activities were 1.8?3.6 fold of the wild-type enzyme when cultured in BBM medium with 1 mg/L atrazine, whereas 1.8?2.6 fold with 2 mg/L atrazine. These results indicated that Haematococcus pluvialis expression system is an ideal high throughput screeningsystem for directed evolution of atrazine chlorohydrolase.
Keywords:atrazine chlorohydrolase, directed evolution, Haematococcus pluvialis, high throughput screening, enzyme activity
阿特拉津 (Atrazine) 是一種世界范圍內廣泛使用了 50多年的、廉價的、適合于玉米高粱果園和林地等雜草防除的“選擇性內吸傳導型”苗前/苗后除草劑,在有效控制雜草、顯著提高作物產量與品質方面發揮重要作用[1]。然而,阿特拉津在土壤中的殘留期長 (4~57周)、不易流失,因此在為農業生產發揮重要作用的同時,也嚴重污染了農業和人居環境[2],已引起世界各國廣泛關注 (如歐盟規定飲用水的最大允許濃度為0.1 μg/L、美國為3 μg/L、加拿大為5 μg/L),并將其列為當前“亟需解決的實際問題”[3-4]。
利用抗性基因解毒機制,構建高效去除污染物的轉基因植物,是20世紀90年代以來環境修復研究的重要方向[5]。阿特拉津化學名稱為 2-氯-4-乙氨基-6-異丙氨基-1,3,5-三氮苯 (2-chloro-4-ethylamino-6-isopropylamino-1,3,5-triazine)。一旦2-位上的氯原子被水解掉,即變成無毒的羥基阿特拉津[6]。因此,尋找合適的阿特拉津氯水解酶基因是利用植物修復阿特拉津污染環境的關鍵。1995年,Mandelbaum等[7]克隆到降解阿特拉津的阿特拉津氯水解酶(Atrazine chlorohydrolase,AtzA,EC.3.8.1.8) 基因(atzA)。但隨后的植物轉基因研究顯示,苜蓿、水稻、煙草等轉基因株的降解阿特拉津能力仍需提高[8-10]。
自1995年來,多個實驗室從其他菌株中也克隆到 atzA。序列比對和功能分析發現,不同來源的阿特拉津氯水解酶不僅氨基酸序列高度同源,而且比活力無明顯差異[11-13]。如假單胞菌Pseudomonas sp.ADP菌株來源的 AtzA與節桿菌Arthrobacter AD1菌株來源的AtzA,僅在278位上有一個對阿特拉津脫氯活性無影響的氨基酸殘基的差異[14]。AtzA序列的高度同源及功能的一致特性,表明 AtzA結構保守、進化緩慢,要想從自然界中尋找高活性的 atzA基因可能并非易事。
模擬生物自然進化過程的定向進化技術是蛋白質的非理性設計[15],其策略非常適合于結構不清楚的AtzA的改造。由于AtzA介導的酶促反應無特異性的顏色改變,大腸桿菌本身又可耐受一定濃度的阿特拉津,因此定向改造AtzA的關鍵是開發一種廉價的、表型改變明顯的高通量篩選方法。為此,本文利用雨生紅球藻 Haematococcus pluvialis表達體系建立了一種穩定高效的高通量篩選 AtzA酶活力提高的突變子方法。
1 材料與方法
1.1 菌株與載體
雨生紅球藻藻種“H1”購自中鹽制鹽工程技術研究院。大腸桿菌DH5α-FT、質粒pCAMBIA1301、pET21b-atzA-NK (含節桿菌 AD1來源的 atzA-AD1基因,基因注冊號為 AF543694) 均為本實驗室保存。質粒pMD4 (含假單胞菌ADP來源的atzA-ADP基因,基因注冊號為U55933) 為美國Minnesota大學Michael Sadowsky教授惠贈。
1.2 方法
1.2.1 制備雨生紅球藻感受態細胞
參照Brown等[16]的方法并稍做修改。雨生紅球藻接種于 BBM 培養基[17]中,于 (25±3) ℃、50~60 μmol/(m2·s) 光照 12 h/黑暗 12 h條件下不定期振蕩 (1次以上/d)培養。3 000 r/min離心5 min收集對數生長期細胞 (約 1×106個),所得沉淀懸浮于電擊緩沖液 (含500 mmol/L NaCl、5 mmol/L KCl、5 mmol/L CaCl2、20 mmol/L Hepes、200 mmol/L甘露醇和200 mmol/L山梨醇) 中,反復懸浮離心2次所得藻體最終用電擊緩沖液調整密度至1×107個細胞/mL,分裝成 40 μL/管備用。
1.2.2 確定抑制雨生紅球藻生長的阿特拉津臨界濃度
取1 mL對數生長期雨生紅球藻分別轉至20 mL含0、0.05、0.1、0.2、0.5、1.0 mg/L阿特拉津的BBM培養液中,21 d后鏡檢統計綠色的、結構完整的細胞數,以此確定雨生紅球藻忍耐阿特拉津的臨界濃度。
1.2.3 atzA雙元載體的構建及雨生紅球藻的遺傳轉化
根據基因 atzA-ADP和 atzA-AD1序列及質粒pCAMBIA1301多克隆位點序列,設計PCR引物,上 游 為 atzA-S-FTCAGCATCC-3′,下劃線為 Sac I酶切位點),下游為 atzA-X-R (5′-AATCTAGA CTAGAGGCTGCGCCA AGC-3′,下劃線為Xba I酶切位點)。以質粒pMD4或 pET21b-atzA-NK為模板,以 atzA-S-F/atzA-X-R為引物進行高保真擴增,PCR方法參見文獻[18]。擴增產物用Sac I和Xba I消化后,與經同樣限制性內切酶消化的植物雙元載體 pCAMBIA1301連接,并轉化至大腸桿菌中。篩選序列未突變的轉化子擴大培養以提取其重組的雙元質粒 pCAMBIA1301-atzA。
取 1 μL 攜 帶 有 0.4 μg 的 雙 元 質 粒pCAMBIA1301-atzA加入到雨生紅球藻感受態細胞中,混勻后冰浴靜置10 min,再轉入預冷的0.1 cm Bio-Rad電轉化杯中。電擊3次 (間隔10 s、試驗電擊強度為 3~8 kV/cm) 后冰浴靜置 5 min,再轉入BBM液體培養基中靜置培養24 h,然后平鋪到含阿特拉津的BBM固體培養基上,倒置光照培養至單藻落出現。
1.2.4 atzA突變文庫的構建
以質粒 pMD4或 pET21b-atzA-NK為模板,以atzA-S-F/atzA-X-R為引物進行易錯PCR (Error-prone PCR,EP-PCR)。EP-PCR 體系為:0.2 mmol/L dATP、0.2 mmol/L dGTP、1.0 mmol/L dCTP、1.0 mmol/L dTTP、0.1 mmol/L dITP、每種引物 0.3 μmol/L、7.5 mmol/L MgCl2、0.01% Triton X-100、1.0 μmol/L NaNO2(或 37.5 μmol/L CoCl2)、0.05 U/μL rTaq DNA聚合酶及 0.01 ng/μL atzA-ADP (或 atzA-AD1)。擴增條件為:95 ℃預變性5 min;94 40 s℃,58 ℃32 s,72 ℃ 1 10 s ,循環50次;72 ℃延伸7 min。隨后經0.7%瓊脂糖凝膠電泳分離EP-PCR產物,分別 命 名 為 ADP-atzA-NO2?、ADP-atzA-Co、AD1-atzA-NO2?、AD1-atzA-Co。15 ℃下 0.1 U/μL DNase I消化EP-PCR產物5~15 min后,85 ℃保溫20 min,再添加5% (V/V) 預冷緩沖液A [含50 mmol/L EDTA和 30% (V/V) 甘油] 終止反應。回收經0.7%瓊脂糖凝膠電泳分離的約100 bp DNA片段后,等摩爾比混合進行無引物重排反應。無引物重排反應條件同EP-PCR,但不加引物,100 bp左右DNA混合片段的濃度為20~80 ng/μL,循環數為25。
0.7%瓊脂糖凝膠電泳回收無引物重排反應產生的1.2~1.5 kb條帶,再進行有引物PCR。擴增體系為:0.2 mmol/L dNTPs、每種引物 0.3 μmol/L、0.05 U/μL rTaq DNA 聚合酶及適量 (5~20 ng/μL) 無引物重排 DNA。有引物 PCR條件同無引物重排反應。產物回收后用Sac I和Xba I消化,并與經同樣限制性內切酶消化的 pCAMBIA1301載體連接,然后電轉化至大腸桿菌DH5α-FT,計算庫容。
1.2.5 AtzA突變子的篩選
回收突變文庫全部菌落,提取其質粒DNA,按1.2.3建立的遺傳轉化方法將atzA突變質粒電轉化進雨生紅球藻細胞,然后平鋪在含0.5 mg/L (5倍臨界濃度) 阿特拉津的BBM固體培養基上,倒置光照培養至單藻落出現。挑選生長明顯的單藻落逐級轉接至阿特拉津濃度為0.5 mg/L、1 mg/L和2 mg/L的BBM培養液中,3周后提取仍生長良好的雨生紅球藻轉化株的基因組 DNA,以 atzA-S-F/atzA-X-R為引物通過Ex Taq DNA聚合酶進行PCR和RT-PCR檢測。PCR和RT-PCR方法參見文獻[18]。回收PCR條帶與pMD19-T Simple Vector (TaKaRa) 連接后送上海生工生物工程技術服務有限公司測序。
1.2.6 AtzA突變酶的活力分析
取 1 mL對數生長期 AtzA轉化株,4 ℃、5 000 r/min離心收集所得藻體轉至4 mL含1 mg/L或2 mg/L阿特拉津的BBM培養液中,第0、1、7、14、21天取樣測定培養液中的阿特拉津殘留量,以確定酶活測定時間。
不同突變株培養 21 d后取樣測定培養液上清中的阿特拉津殘留量,以降解1 μg阿特拉津對應的培養液體積 (mL) 為1個AtzA酶活力單位,以此比較不同突變子的活力差異。相同轉化株的酶活力取3次重復試驗的平均值,處理間差異經新復極差檢測。
取20 mL對數生長期轉化株,4 ℃、5 000 r/min離心10 min收集藻體,液氮研磨后迅速加入600 μL預冷植物蛋白提取緩沖液 (150 mmol/L Tris-HCl(pH 8.0),25%甘油,2% PVP40),冰上靜置3~4 h后,4 ℃、12 000 r/min離心20 min,上清即為酶粗提取液。粗酶提取液的蛋白含量測定按照 Bradford法[19]進行。取3 mg蛋白量對應的粗酶提取液,添加0.6 mg阿特拉津后25 ℃保溫16 h,再測其阿特拉津殘留量,以降解1 mg阿特拉津所需粗酶提取液的量(mg蛋白) 為1個AtzA酶活力單位,以此比較不同突變子的活力差異。相同轉化株的酶活力取 3次重復試驗的平均值,處理間差異經新復極差檢測。
1.2.7 阿特拉津殘留量的高壓液相法測定
在培養液上清或粗酶提取液中加入等體積的二氯甲烷,混勻后25 ℃、200 r/min下振蕩1 h,再經12 000 r/min離心15 min,取下層 (二氯甲烷層)10 μL進行高壓液相分析[20]。高壓液相檢測儀為美國CoMetro公司的CoM 6000 HPLC Pressure Liquid Delivery System,色譜柱為 Comatex C18 (5 μm,Ф4.6×250 mm),檢測波長為228 nm,阿特拉津保留時間為20.925 min。流動相為乙腈和水混合物,0~6 min,乙腈由10%升到25%,水由90%降到75%;6~21 min,乙腈由25%升到65%,水由75%降到35%;21~23 min,乙腈由65%升到100%,水由35%降到0;23~25 min,乙腈保持100%。
2 結果與分析
2.1 轉化雨生紅球藻表達atzA體系的建立
雨生紅球藻對阿特拉津的耐受力測試顯示,0.1 mg/L阿特拉津即可完全抑制其生長 (表1),因此,確定該濃度為阿特拉津抑制雨生紅球藻生長的臨界濃度。

表1 雨生紅球藻對阿特拉津的耐受力測試Table 1 Tolerance test of Haematococcus pluvialis to atrazine
在不同電壓條件下,將重組質粒pCAMBIA1301-atzA電轉化進雨生紅球藻細胞,對獲得的單藻落進行PCR抽檢。結果顯示 (表2),隨著電擊強度的增大,獲得的單藻落數隨之減少,當電擊強度達到8 kV/cm時,培養基表面發白,無明顯單藻落,表明雨生紅球藻細胞被電擊致死。PCR抽檢顯示,電擊強度在7 kV/cm以下,陽性率隨電壓增強而提高。根據單藻落數和抽檢陽性率計算陽性單藻落數,顯示6 kV/cm最多,為atzA轉化雨生紅球藻最適電擊強度。

表2 不同電壓對雨生紅球藻轉化率的影響Table 2 Effect of voltage on transformation efficiency of Haematococcus pluvialis
2.2 atzA突變文庫的構建
分別以質粒 pMD4和 pET21b-atzA-NK為模板,以 atzA-S-F/atzA-X-R為引物,以 NaNO2或CoCl2為誘變劑進行 EP-PCR。圖 1顯示,目的條帶 (1.4 kb) 清晰。電泳切膠回收該目的條帶后用DNase I消化,結果如圖2所示,隨消化時間延長,片段變短,當消化15 min時,片段集中在100 bp左右。

圖1 atzA的EP-PCR電泳圖譜Fig. 1 Electrophosis pattern of atzA after EP-PCR. M: marker NTKV-3 (bp); 1: ADP-atzA-NO2?; 2: ADP-atzA-Co; 3:AD1-atzA-NO2?; 4: AD1-atzA-Co.

圖2 atzA的DNase I消化電泳圖譜Fig. 2 Electrophosis pattern of atzA restricted with DNase I.M: marker NTKV-3 (bp); 1?6: treated time was 5 min, 10 min,and 15 min, respectively.
切膠回收100 bp左右條帶進行無引物重排,電泳顯示在1.4 kb處有一明顯亮帶 (圖3),表明DNase I消化的短片段重新組裝成了全長片段。當模板濃度為80 ng/μL時,無引物重排的條帶最亮。切膠回收該重排條帶進行有引物 PCR,發現模板濃度為10~20 ng/μL時,能有效擴增出1.4 kb條帶 (圖4)。

圖3 atzA片段的無引物重排Fig. 3 Reassembly of the restricted atzA fragments. M: marker NTKV-3 (bp); 1: full-length of the atzA fragment; 2?4: the amount of the digested fragments were 80 ng/μL, 40 ng/μL and 20 ng/μL, respectively.

圖4 atzA重排產物的有引物PCRFig. 4 Amplification profile with primers using different amount of reassembled fragments as template. M: marker NTKV-3 (bp); 1?3: the amount of the reassembled fragments were 5, 10 and 20 ng/μL, respectively; 4: full-length atzA fragment.
2.3 AtzA突變庫的篩選及序列分析
回收有引物PCR產物,Sac I/Xba I雙酶切后與經同樣酶酶切的 pCAMBIA1301片段連接,電轉化進 DH5α-FT,得庫容為 1.5×105的突變文庫。收集全部轉化子,提取重組質粒,然后電轉化雨生紅球藻,再平鋪于含0.5 mg/L或1.0 mg/L阿特拉津的BBM 固體培養基上,倒置光照培養至單藻落出現(圖 5)。
分析不同轉化批次所得的12株AtzA突變子序列(表3)發現,突變子10-7和10-15、22-4和22-11、40-8和48-6/49-10的氨基酸突變位點完全相同,表明不同轉化批次轉化子可篩選出相同的 AtzA突變子,暗示以雨生紅球藻為平臺能穩定篩選出活力提高的AtzA突變子。

圖5 可能攜帶AtzA進化酶的雨生紅球藻單藻落Fig. 5 Haematococcus pluvialis single colony which may carry evolved AtzA.

表3 獲得的12個酶活力提高的AtzA進化子的序列分析Table 3 Sequence analysis of the obtained 12 improved AtzA mutants
比對表3突變序列發現,AtzA突變均為點替換,位點分散在全基因上,突變子10-7 (V12A) 和21-1(L395P) 為單點替換;22-4 (M226V、V/M278A) 為雙點替換;15-1 (T195A、M337T、F439L) 和 16-1(V58A、H80R、T121A) 為三點替換;7-10 (M315I、H399Q、N429S、V466A) 為四點替換;48-6 (A30G、M315I、R389C、H399Q、N429S、V466A) 為六點替換;32-2 (A30G、Q71R、M315I、R389C、H399Q、N429S、V466A) 為七點替換。7-10、32-2和 48-6(40-8/49-10) 均在315位、399位、429位和466位上發生了點替換,48-6 (40-8/49-10) 在上述4個位點基礎上又在30位和389位上發生了點替換,32-2比48-6(40-8/49-10) 在71位多一個點替換,表明位點突變是在EP-PCR及DNA洗牌過程中逐漸累積形成的。
2.4 AtzA突變酶活力分析
選取突變序列完全不同的 3株突變株 15-1、16-1和48-6,接種到含2 mg/L阿特拉津的BBM培養液中,第 0、1、7、14、21天取樣分析其阿特拉津降解率與時間的關系 (圖6),顯示未含atzA的雨生紅球藻僅降解很少的阿特拉津 (約 2%~5%),且隨時間延長,降解率無明顯提高;3株突變株的阿特拉津降解率隨時間延長,降解率明顯提高,第21天時降解率最高 (15-1為41.3%,16-1為42.9%,48-6為 43.6%)。
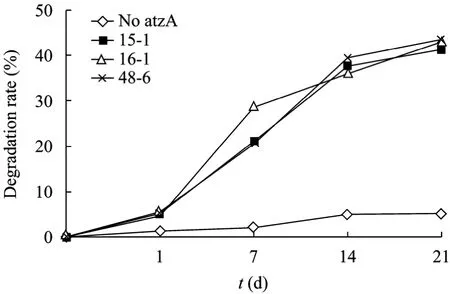
圖6 不同AtzA突變株不同時間的阿特拉津降解率Fig. 6 Atrazine degradation rate of Haematococcus pluvialis with mutated atzA at different times.
為比較不同突變子的阿特拉津降解活力,將含atzA突變基因的雨生紅球藻培養在含1 mg/L或2 mg/L阿特拉津的BBM培養液中,21 d后測定不同突變子的酶活力;同時,提取突變株對數生長期粗酶提取液測定其酶活力 (表 4),結果顯示,所有突變株的上清酶活力或粗酶提取液酶活力都明顯高于野生株AtzA-ADP。以AtzA-ADP酶活力為1,得各突變子的相對酶活力,可以看出,培養液中添加1 mg/L阿特拉津時,22-4活力最高,為 3.6;10-7次之,為3.2;21-1再次之,為3.1;其余突變株介于1.8~2.3之間。培養液中添加2 mg/L阿特拉津時,22-4活力最高,為2.6;48-6次之,為2.4;10-7和32-2再次之,為2.3;其余突變株介于1.7~2.2之間。粗酶提取液相對酶活力比較發現,10-7、21-1和32-2最高,為2.7;16-1、22-4和48-6次之,分別為2.6、2.5和2.3;7-10和15-1最低,為1.7和1.9。結合突變位點信息,發現 12位 (10-7)、226位 (22-4) 和395位 (21-1) 氨基酸殘基的改變對酶活力影響較大,可能是重要的酶活力位點。由于突變株7-10的酶活力提高最小,而與 7-10具有相同突變位點的32-2和48-6又有較高的相對活力,暗示30位、71位和389位可能是重要的酶活力位點,315位、399位、429位和466位可能不是重要的酶活力位點。

表4 不同AtzA突變酶的阿特拉津降解活力分析Table 4 Analysis of the atrazine degradation activity among the evolved AtzA mutants
3 討論
阿特拉津作為世界范圍內廣泛使用的除草劑,在為農業生產發揮積極作用的同時,也給環境帶來嚴重的污染。對阿特拉津污染環境的治理和修復已成為目前急需解決的實際問題,atzA的分離為該問題的解決提供了幫助,但目前分離得到的atzA具有很高的同源性,編碼的AtzA功能無差異[11-13],因此限制了該酶的綜合利用。對AtzA進行改造以提高酶活力,將會大大促進該酶的應用,為阿特拉津污染環境修復奠定基礎的同時也會推動對該酶結構功能關系的研究。2001年Seffernick等[21]對atzA的DNA洗牌研究和2009年Scott等[22]對atzA的有限點飽和突變研究,均獲得了 AtzA酶活力提高的突變子。Seffernick等的篩選方法是氣相色譜法,氣相色譜法顯然不是高通量篩選方法,費時費力、成本高,因此篩選規模僅在1 600突變株水平,且僅篩選出1個酶活力提高 1.4倍的突變酶,效果很不理想。Scott等[22]的篩選方法是降解圈大小的比較,降解圈大小的比較雖然是高通量篩選方法,但降解圈通常不清晰、時隱時現,其大小判定人為影響很大,且與菌落生長狀況密切相關,難以重復,因此以其來判定突變子優劣缺乏足夠的科學性和準確性。所以,建立穩定的、簡單易行的高通量篩選方法是AtzA大規模定向改造的關鍵。
本文開發的雨生紅球藻篩選系統是以atzA為標記基因、以阿特拉津為篩選壓力對突變酶進行篩選,完全基于培養基自動篩選機制,因此是一種典型的正向高通量篩選方法——無或低 AtzA活性藻株在高濃度阿特拉津培養基中生長受到抑制,難以形成單藻落;高AtzA活性藻株因生長不受影響而迅速發育成單藻落。所以,通過阿特拉津選擇壓力的人為調節,從atzA突變文庫中可有效獲取高活性突變子。本文選擇雨生紅球藻為受體系統,是因為其是一種具有雙鞭毛的淡水單細胞綠藻[23],繁殖速度快 (幾個小時可繁殖一代)、培養方式簡單 (可在固體培養基上生成單藻落)、對阿特拉津敏感 (致死濃度為0.1 mg/L),且通過操作簡單、轉化率高的電擊轉化方法可大量獲取單藻落,因此可實現AtzA突變子的大規模篩選。本文得到的12個突變子的AtzA活力明顯改善這一結果,表明該篩選手段非常有效。由于阿特拉津篩選壓力僅人為調節,因此篩選工作也非常簡單。
本文結果雖證實該高通量篩選系統簡單有效,但其自身也存在瑕疵。外源atzA在雨生紅球藻基因組中的重組是基于Ti載體插入原理,而Ti載體插入具一定隨意性[24],使得突變酶活力除序列相關外,還與插入位置有關。本實驗在 5倍阿特拉津臨界濃度篩選壓力下得到了 1株陽性轉化子,但測序顯示其序列與野生型atzA-ADP序列完全相同,顯示插入隨意性對定向篩選的干擾。依此推測,某些有益突變子也可能因插入位點不合適而被遺漏掉。為避免此干擾,可將突變的atzA基因定點插入到雨生紅球特定藻基因組中進行篩選,但遺憾的是,目前植物同源重組頻率尚很低 (最高為 10?3~10?4)[25],無法保證篩選規模。此外,細菌來源的atzA基因在雨生紅球藻中的表達還可能因密碼子偏好性問題而出現干擾,比如細菌atzA基因突變為雨生紅球藻偏好密碼子而出現高表達,或突變為雨生紅球藻稀有密碼子而出現低表達或不表達,都將導致假陽性或假陰性干擾。在序列分析時發現,實驗過程中確實存在基因序列發生突變但氨基酸序列未發生改變的突變子。為避免密碼子偏好性干擾,可將篩選到的突變基因再轉化進大腸桿菌表達系統,以準確闡明對其結構-功能關系。
本文結果顯示,雨生紅球藻在阿特拉津濃度低于0.1 mg/L的BBM培養基中能緩慢生長,表明雨生紅球藻自身對阿特拉津有一定耐受性。該耐受性不僅影響高通量篩選,還影響突變酶活性分析。為此,篩選中務必增加突變子序列分析過程,同時對突變酶進行活性分析時還應排除雨生紅球藻自身對阿特拉津的吸收。本文所得突變子的酶活力均扣除了未轉化atzA雨生紅球藻對阿特拉津的吸收,所得酶活力比較準確地反映了其真實活力變化。
本文構建的 atzA突變文庫為 EP-PCR與 DNA洗牌相結合的隨機突變文庫,庫容雖僅 105水平,但突變種類是豐富的。在文庫篩選前,隨機測定了5個突變子的序列,發現其中 4個突變子為多點替換突變,另1個突變子除缺失1 061 bp片段外還增加了非同源的183 bp片段,顯示突變文庫除點突變外,還有缺失和插入突變。但5倍阿特拉津篩選壓力篩選到的7個突變子 (7-10、15-1、16-1、21-1、40-8、48-6和49-10),10倍篩選壓力篩選到的5個突變子 (10-7、10-15、22-4、22-11和32-2) 序列分析發現,突變均為點突變,不存在缺失或插入突變類型,表明AtzA高度保守,不允許氨基酸殘基數目發生改變。在篩選到的 12個突變子中,17%的突變子 (10-7和10-15) 在12位上發生突變 (V12A),17%的突變子 (22-4和22-11) 在226位上發生突變(M226V),25%的突變子 (40-8、48-6和 49-10) 在30、315、389、399、429和 466位上共同突變 (A30G、M315I、R389C、H399Q、N429S、V466A),表明其中的某些突變位點可能與酶活性有關,但其結構-功能關系尚需更多數據支持。
REFERENCES
[1] Wang HM, Zhang ZM. A New Pesticide Manual. Beijing:China Agriculture Press, 1989.
王煥民, 張子明. 新編農藥手冊. 北京: 中國農業出版社, 1989.
[2] Sheets TJ. Persistence of triazine herbicides in soils.Residue Rev, 1970, 32: 287?310.
[3] Martin M, Hagege A, Brunette JP, et al. Use of synergistic extraction for the study of atrazine/metal interactions.Anal Chim Acta, 1998, 373(2/3): 161?165.
[4] Lu K, E XL, Chen YY. The standards of drinking water inU.S.A. at present. Foreign Med Sci: Section of Hygiene,2000, 27(2): 104?109.
路凱, 鄂學禮, 陳亞妍. 美國現行飲用水標準. 國外醫學: 衛生學分冊, 2000, 27(2): 104?109.
[5] Padmavathiamma PK, Li LY. Phytoremediation technology: hyper-accumulation metals in plants. Water Air Soil Pollut, 2007, 184(1/4): 105?126.
[6] Strong LC, McTavish H, Sadowsky MJ, et al. Field-scale remediation of atrazine-contaminated soil using recombinant Escherichia coli expressing atrazine chlorohydrolase. Environ Microbiol, 2000, 2(1): 91?98.
[7] Mandelbaum RT, Allan DL, Wackett LP. Isolation and characterization of a Pseudomonas sp. that mineralizes the s-triazine herbicide atrazine. Appl Environ Microbiol,1995, 61(4): 1451?1457.
[8] Wackett LP, Sadowsky MJ, Vance CP, et al. Transgenic plants expressing bacterial atrazine degrading gene atzA:US, 6369299. 2002-04-09.
[9] Wang SW, Shi LL, Sun ZX, et al. Agrobacterium-mediated transformation of rice with atzA gene. Sci Agric Sin, 2004,37(8): 1093?1098.
王松文, 施利利, 孫宗修, 等. 農桿菌介導的細菌阿特拉津氯水解酶基因對水稻的遺傳轉化. 中國農業科學,2004, 37(8): 1093?1098.
[10] Wang L, Samac DA, Shapir N, et al. Biodegradation of atrazine in transgenic plants expressing a modified bacterial atrazine chlorohydrolase (atzA) gene. Plant Biotechnol J, 2005, 3(5): 475?486.
[11] Vibber LL, Pressler MJ, Colores GM. Isolation and characterization of novel atrazine-degrading microorganisms from an agricultural soil. Appl Microbiol Biotechnol, 2007, 75(4): 921?928.
[12] Iwasaki A, Takagi K, Yoshioka Y, et al. Isolation and characterization of a novel simazine-degrading β-proteobacterium and detection of genes encoding s-triazine-degrading enzymes. Pest Manag Sci, 2007,63(3): 261?268.
[13] Hernández M, Villalobos P, Morgante V, et al. Isolation and characterization of a novel simazine-degrading bacterium from agricultural soil of central Chile,Pseudomonas sp. MHP41. FEMS Microbiol Lett, 2008,286(2): 184?190.
[14] Chen DF, Chen XW, Cai BL. Site-directed mutagenesis of atrazine chlorohydralase gene and detection of its activity.Acta Scientiarum Naturalium Univ Nankaiensis, 2004,37(3): 109?114.
陳德富, 陳喜文, 蔡寶立. 阿特拉津氯水解酶基因的定點誘變和酶活力檢測. 南開大學學報: 自然科學版,2004, 37(3): 109?114.
[15] Kolkman JA, Stemmer WPC. Directed evolution of proteins by exon shuffling. Nat Biotechnol, 2001, 19(5):423?428.
[16] Brown LE, Sprecher SL, Keller LR. Introduction of exogenous DNA into Chlamydomonas reinhardtii by electroporation. Mol Cell Biol, 1991, 11(4): 2328?2332.
[17] Jin CY, Song LR, Liu YD, et al. Study on the media for Haematococcus sp. HB748. Chin J Appl Environ Boil,1997, 3(2): 177?179.
金傳蔭, 宋立榮, 劉永定, 等. 紅球藻水生 748株(Haematococcus sp. HB748) 培養基的選擇與對維生素B12的需求. 應用與環境生物學報, 1997, 3(2): 177?179.
[18] Wang HZ, Chen XW, Wang YQ, et al. Obtainment of atzA-transgenic tobacco plants and analysis of their phytoremediation capability. Acta Agron Sin, 2008, 34(5):783?789.
王繪磚, 陳喜文, 王永芹, 等. 轉阿特拉津氯水解酶基因煙草的獲得及其生物降解能力分析. 作物學報, 2008,34(5): 783?789.
[19] Bradford MM. A rapid and sensitive method for the quantization of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem, 1976,72(7): 248?254.
[20] De Souza ML, Sadowsky MJ, Wackett LP. Atrazine chlorohydrolase from Pseudomonas sp. strain ADP: gene sequence, enzyme purification, and protein characterization. J Bacteriol, 1996, 178(16): 4894?4900.
[21] Seffernick JL, Wackett LP. Rapid evolution of bacterial catabolic enzymes: a case study with atrazine chlorohydrolase. Biochemistry, 2001, 40(43): 12747?12753.
[22] Scott C, Jackson CJ, Coppin CW, et al. Catalytic improvement and evolution of atrazine chlorohydrolase.Appl Environ Microbiol, 2009, 75(7): 2184?2191.
[23] Chen F, Chen H, Gong XD. Mixotrophic and heterotrophic growth of Haematococcus lacustris and rheological behaviour of the cell suspensions. Bioresour Technol,1997, 62(1/2): 19?24.
[24] Hoekema A, Hirsch PR, Hooykaas PJJ, et al. A binary plant vector strategy based on separation of vir- and T-region of the Agrobacterium tumefaciens Ti-plasmid.Nature, 1983, 303: 179?180.
[25] Wright DA, Townsend JA, Winfrey RJ, et al.High-frequency homologous recombination in plants mediated by zinc-finger nucleases. Plant J, 2005, 44(4):693?705.
人類天冬胺酰基β-羥化酶的表達及其單克隆抗體的制備
呼延霆,尹大川,王偉,宋凱,王燕,盧慧甍,楊慧,薛小平
西北工業大學生命學院,西安 710072
摘 要:旨在深入研究人類天冬胺酰基β-羥化酶 (HAAH) 在腫瘤早期診斷中的作用機制。應用RT-PCR方法從肝癌組織中獲得人類天冬胺酰基β-羥化酶HAAH編碼基因,并在原核表達載體pBV-IL1中進行融合表達,將Ni柱純化的融合蛋白免疫Balb/c小鼠,獲得了3株穩定的陽性單克隆細胞株 (H3/E10、E4/F12、G4/D8),間接ELISA和Western blotting鑒定單抗的特異性和靈敏度,以單抗H3/E10介導的間接免疫熒光檢測HAAH在各種腫瘤細胞系中的表達,可見特異的熒光。試驗中成功構建了可表達HAAH基因的原核表達載體pBV-IL1-HAAH,并制備了3株抗HAAH的單克隆抗體,為HAAH的結構和功能的研究奠定了基礎,同時也為進一步將該抗體應用于腫瘤的早期診斷以及研究HAAH在腫瘤發生轉移中的機理提供了重要工具。
關鍵詞:人類天冬胺酰基β-羥化酶,pBV-IL1,原核表達,單克隆抗體
Abstract:We investigated the mechanism of human aspartyl β-hydroxylase (HAAH) in early diagnosis of tumors. The encoding gene of HAAH was cloned from the hepatic carcinoma by RT-PCR and expressed as a fused protein in the prokaryotic vector pBV-IL1. The expressed HAAH was purified by Ni2+-NTA purification column and the purified protein was then used to immunize Balb/c mice. Three hybridoma cell lines (respectively designated H3/E10, E4/F12and G4/D8) stably expressing the monoclonal antibody specific to HAAH fusion protein were obtained. The specificity and sensitivity of the monoclonal antibody were assessed by indirect enzyme-linked immunosorbent assay (ELISA) and Western blot analysis. Finally, the monoclonal antibody expressed by H3/E10cell line was used to detect the expression of HAAH in several tumor cell lines by indirect immuno-fluorescence, and the specific fluorescence was observed. In conclusion, this study successfully constructed the recombinant prokaryotic vector pBV-IL1-HAAH and prepared HAAH-specific monoclonal antibody for further study of the structure and function of the protein. Theresult may also lay solid foundation for the research of the molecular mechanism of HAAH in early diagnosis of tumors.
Keywords:human aspartyl β-hydroxylase, pBV-IL1, prokaryotic expression, monoclonal antibody
人類天冬胺酰基 β-羥化酶 (Human Aspartyl/Asparaginyl β-hydroxylase,HAAH) 是胚胎期即存在于細胞內的一種酶,屬于依賴 α-酮戊二酸雙加氧酶家族,可催化特定蛋白中表皮生長因子 (EGF) 受體樣結構域的天冬氨酸或天冬酰胺殘基上的 β-碳原子羥基化[1]。10余年的研究表明HAAH在腫瘤細胞表面的高表達,使得瘤細胞的運動性和擴散性顯著增加,并通過血管和淋巴管擴散到臨近的正常組織,最終引起腫瘤的惡性轉化和腫瘤病灶的形成,但其作用機制尚不明確。因此它可能是體內調節腫瘤細胞生長的重要靶點,被認為是一種新型惡性腫瘤高特異性的分子標記物[2]。
本研究利用溫度誘導的原核表達載體pBV-IL1[3]重組表達了HAAH蛋白,經純化后用重組蛋白免疫小鼠,篩選并獲得了抗HAAH特異的單克隆抗體細胞株,為HAAH的結構和功能的研究奠定了基礎,同時也為進一步將該抗體應用于腫瘤的早期診斷以及研究HAAH在腫瘤發生轉移中的機理提供了重要工具。
1 材料與方法
1.1 材料
肝癌組織:由第四軍醫大學西京醫院消化病醫院趙青川教授提供,樣品的取得均遵守現行的道德規范準則,并正式得到所有參與者和該研究各方的同意,該組織標本經病理檢驗確診為肝細胞肝癌,保存在液氮中。腫瘤細胞系:人腎腺癌細胞ACHN、人膀胱癌細胞BIU-87、人乳腺癌細胞MCF-7、人肝癌細胞SMMC-7721、人喉癌細胞Hep-2、人宮頸癌細胞 HeLa、人卵巢癌細胞 SKOV、人正常肝細胞L02均購自中國科學院武漢細胞所。細胞培養基DMEM購自美國GIBCO公司,新生牛血清購自杭州四季青公司。所有細胞培養于含有100 mL/L新生牛血清、100 mg/L青霉素及 1×104U/L鏈霉素的DMEM培養液中。E. coli DH5α、HB101等菌株由本室保存。
pBV-IL1載體由本室保存; pGEMT-easy載體購自Promega公司。E. coli DH5α等菌株由本室保存;各種限制性內切酶、T4 DNA連接酶和 RNA反轉錄試劑盒為TaKaRa公司產品;DNA凝膠回收試劑盒購自AXYGEN公司;鼠單克隆抗體亞型鑒定試劑盒購自Sigma公司;DNA Marker和蛋白Marker為 Hybigen公司和百泰克生物技術公司產品;針對His的鼠源性單克隆抗體 (Catalog No.:70796-4) 為美國 Merck公司產品,IRDye 800CW Goat Anti-Mouse IgG熒光二抗購自美國Li-Cor生物技術公司。PCR所用引物及產物測序均由上海生工生物工程技術有限公司合成。
1.2 方法
1.2.1 模板的制備
取液氮中的肝癌腫瘤組織約100 mg,依照Trizol法提取組織總 RNA,使用 PrimeScript RT-PCR Kit(TaKaRa) 合成cDNA第一鏈。
1.2.2 HAAH基因的克隆
根據GenBank發表的HAAH的cDNA序列 (GI:14589865),綜合利用Primer5和Oligo6引物設計軟件設計HAAH的全長引物 (表1)。引物Forward包含Xho I酶切位點及His標簽序列;引物Reverse包含Spe I酶切位點及終止碼。

表1 HAAH克隆引物序列Table 1 Cloning primer sequences of HAAH
以反轉錄得到的HAAH cDNA為模板,經PCR擴增得到HAAH基因片段,PCR產物電泳后回收目的片段,通過 T4 DNA連接酶將目的基因克隆到pGEMT-easy載體中,連接產物轉化E. coli DH5α感受態細胞,涂布于含氨芐青霉素 (100 mg/mL Amp)的 LB平板,挑取單克隆進行酶切、測序鑒定獲得陽性克隆。
1.2.3 pBV-IL1原核表達載體的構建
將測序鑒定正確的陽性克隆載體 pGEMT/HAAH,經Xho I/Spe I酶切后得到HAAH基因片段,插入到同時經Xho I/Xba I酶切的pBV-IL1載體中,連接轉化E. coli DH5α感受態細胞,涂布于含Amp抗性的 LB平板,挑取單克隆提取質粒后進行酶切鑒定,獲得重組載體pBV-IL1-HAAH。
1.2.4 HAAH重組蛋白的誘導表達鑒定、可溶性分析及其純化
將重組 pBV-IL1-HAAH原核表達載體轉化入HB101宿主菌,過夜菌1:50轉接入含Amp的LB培養基中,30 ℃搖菌4 h,再調節培養溫度至42 ℃誘導目的蛋白表達,誘導培養時間5 h。同時設空載體對照組 (培養條件同實驗組) 和非誘導培養對照組(30 ℃培養)。
4 000r/min、4 ℃離心30 min,收集得到菌體后,取少量菌液與2×上樣緩沖液混合,95 ℃、10 min裂解菌體后,進行SDS-PAGE和Western blotting鑒定目的蛋白的表達。以抗His 標簽的單抗作為一抗,以羊抗鼠熒光抗體 (Goat anti mouse IRdye 800)為二抗,最后采用 Odyssey紅外發光顯色法鑒定目的蛋白的表達;其余大部分菌體使用超聲破碎,4 000 r/min、4 ℃離心30 min,分別收集上清和沉淀,進行其可溶性分析。
收集2 L誘導表達菌,10 000 r/min離心30 min收集菌體沉淀,用100 mL平衡液重懸后,超聲波處理30 min,4 ℃、10 000 r/min離心30 min,收集裂解上清。采用Ni2+NTA親和柱純化重組蛋白,并備樣進行SDS-PAGE分析。
1.2.5 抗HAAH單克隆抗體的制備及鑒定
用純化的HAAH重組蛋白作為抗原對6~8周齡Balb/c小鼠進行免疫。初次免疫,50 μg抗原 (溶于100 μL PBS) 以 1:1 (V/V) 的比例加入福氏完全佐劑,充分混合制成乳液,分多點注射于Balb/c小鼠頸背部皮下。間隔2周追加免疫1次,方法為腹腔注射 100 μg/只抗原 (溶于 100 μL PBS,不加福氏佐劑),共追加免疫2次。每次免疫后1周尾靜脈采血,分離血清,非競爭間接ELISA法測定免疫效果。細胞融合采用PEG融合法,有限稀釋法進行陽性克隆篩選,陽性雜交瘤細胞以5×105/mL的細胞密度,注射Balb/c小鼠制備腹水,腹水的純化按辛酸-硫酸銨法進行。
采用Western blotting對單克隆抗體特異性進行鑒定。單克隆抗體亞型鑒定采用間接ELISA法,檢測試劑盒 (Sigma公司),操作按使用說明進行。
非競爭酶免疫法測定抗體親和力,抗原以20 μg/mL、10 μg/mL 和 5 μg/mL 三個濃度分別包被ELISA板條,純化的mAb稀釋成11種濃度:4、2、1、0.5、0.25、0.13、0.06、0.03、0.02、0.01、0 μg/mL,分別加入不同包被量的反應孔中,反應后依次加入HRP標記的羊抗鼠IgG和底物TMB顯色,測OD450。根據抗原抗體結合的S形曲線,求解不同抗原濃度下半數吸光值的抗體濃度,代入公式

計算親和常數,式中Ab和Ab′分別表示當抗原濃度為 Ag和 Ag′時,產生半數吸光值的抗體濃度(mol/L),n=Ag/Ag′。當 n=2時,可得3個 Ka值,以3個Ka值的均數作為最終結果。
1.2.6 抗HAAH單克隆抗體在腫瘤細胞系中檢測HAAH的應用
培養人腎腺癌細胞 ACHN、人膀胱癌細胞BIU-87、人乳腺癌細胞 MCF-7、人肝癌細胞SMMC-7721、人喉癌細胞 Hep-2、人宮頸癌細胞HeLa、人卵巢癌細胞 SKOV、人正常肝細胞 L02,制備細胞爬片。以本實驗獲得的抗HAAH單克隆抗體為一抗,FITC標記羊抗小鼠 IgG為二抗,并用Hoechst33258染核按常規方法進行間接細胞免疫熒光檢測HAAH的表達分布。
2 結果
2.1 HAAH基因克隆的鑒定
1%瓊脂糖凝膠電泳檢測 PCR產物,結果獲得約750 bp的片段,與預期目的片段相符 (圖1)。

圖1 PCR擴增得到的HAAH基因Fig. 1 HAAH gene isolated by PCR. M: DNA marker (HBI 1.0 kb Plus); A,B: PCR products of HAAH gene.
用Xho I與Spe I雙酶切鑒定pGEMT-HAAH,其中陽性克隆A、B、D、F切出3.1 kb和750 bp兩條片段,與預期目的片段相符 (圖 2),表明 HAAH基因已連接到pGEMT-easy載體,并將陽性克隆A、B、D、F測序以證明其與預期序列一致。
2.2 重組原核表達載體pBV-IL1-HAAH的鑒定
用 Xho I與 Spe I雙酶切鑒定重組載體pBV-IL1-HAAH,陽性克隆切出3.6 kb和750 bp兩條片段,與預期結果相符 (圖3),表明HAAH基因已成功連接到原核表達載體pBV-IL1。
2.3 重組蛋白的誘導表達鑒定、可溶性分析及純化
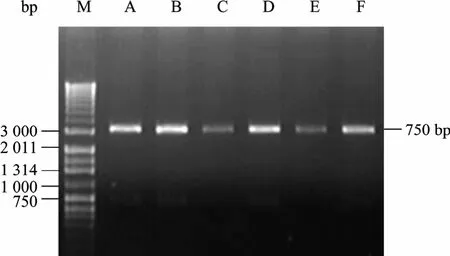
圖2 Xho I/Spe I雙酶切鑒定pGEMT-HAAH質粒Fig. 2 pGEMT-HAAH digested with Xho I and Spe I. M:DNA marker (HBI 1.0 kb Plus); A,B,D,F (positive clone):plasmid of GEMT-easy (3.1 kb), HAAH segment (750 bp);C,E: negative clone.

圖3 Xho I/Spe I雙酶切鑒定pBV-IL1-HAAHFig. 3 pBV-IL1-HAAH digested with Xho I and Spe I. M:DNA marker (HBI 1.0 kb Plus); A?D (positive clone): pBV-IL1(3.6 kb) HAAH segment (750 bp).

圖4 重組蛋白在HB101中的誘導表達Fig. 4 Expression of recombinant protein His-HAAH in HB101. M: protein marker; A?D: product of the fusion protein induced in 42 °C; E: negative control induced in 30 °C; F: the blank positive control induced in 42 °C.
42 ℃誘導后,SDS-PAGE檢測融合蛋白HAAH的誘導表達,結果表明目的蛋白HAAH獲得了表達,電泳條帶經灰度掃描分析顯示,表達的融合蛋白約占菌體總蛋白的25% (圖4),而在30 ℃下誘導的陰性對照 (E) 并無特異表達的條帶,42 ℃誘導的空載體陽性對照中 (F) 在18 kDa處有一特異表達條帶,該表達帶是 pBV-IL1空載體誘導的 IL1蛋白[3]。Western blotting鑒定結果進一步表明該 His-HAAH融合蛋白能與抗 His單抗發生特異反應,并得到了預期表達 (圖5)。
經超聲裂解后的菌體分為上清和沉淀,可溶性分析表明目的蛋白主要存在于菌體裂解上清中 (圖6)。將裂解上清經 Ni2+NTA親和柱層析后,得到了純化的融合蛋白His-HAAH (圖7)。

圖5 重組蛋白的Western blotting分析結果Fig. 5 Western blotting analysis of fusion protein. M: protein marker; A: negative control; B: induction of fusion protein.

圖6 融合蛋白表達菌體裂解液的可溶性分析Fig. 6 Solubility analysis of expression fusion protein. M:protein marker; A: precipitate of induced pBVIL1-HAAH; B:supernatant of induced pBVIL1-HAAH.
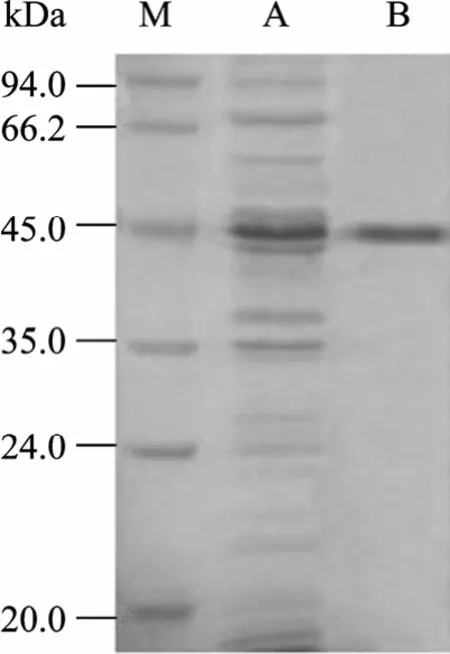
圖7 融合蛋白的純化Fig. 7 Purification of fusion protein. M: protein marker; A:expression of fusion protein without purification; B: purified fusion protein.
2.4 單克隆抗體的制備
小鼠經3次免疫后,尾靜脈采血,間接ELISA檢測其效價均超過1:104。取免疫小鼠的脾細胞與骨髓瘤細胞SP2/0進行PEG融合后,ELISA檢測確定陽性孔并進行了 3次克隆化篩選得到了 H3/E10、E4/F12、G4/D8三株可穩定分泌抗HAAH抗體的單克隆雜交瘤細胞株,取其中的 H3/E10株注射小鼠腹部制備腹水并進行純化 (圖8)。
2.5 單克隆抗體的鑒定
2.5.1 Western blotting單抗特異性鑒定
用H3/E10單抗檢測表達的HAAH蛋白,Western blotting分析結果顯示,所制備的單克隆抗體能特異地與HAAH蛋白反應 (圖9),而與空載體經溫度誘導后產生的IL-1片段無特異性結合反應。
2.5.2 單抗的亞類鑒定
Ig亞類測定:經間接ELISA試劑盒鑒定亞類,所制備的mAb為IgG1,κ輕鏈。
2.5.3 單抗的親和力測定
以非競爭性ELISA對初步純化后的單克隆抗體做親和力常數的測定。單克隆抗體的親和常數為5×108,圖 10是對不同濃度包被的抗原結合的反應曲線。
2.6 在腫瘤細胞系中檢測HAAH的初步應用

圖8 H3/E10單克隆抗體的純化Fig. 8 Purification of monoclonal antibody H3/E10. M: protein marker; A: purified antibody.

圖9 Western blotting鑒定單抗的特異性Fig. 9 Specificity test of monoclonal antibody by Western blotting. A: purified fusion protein; B: the blank positive control.
在各種腫瘤細胞系中以本實驗制備的單抗H3/E10為一抗進行HAAH的間接免疫熒光分析結果如圖11所示,藍色熒光是Hoechst所激發,標記結構為細胞核。各種腫瘤細胞膜和細胞胞質區域有綠色熒光,為FITC所激發,證明在各種腫瘤細胞膜和細胞胞質區有抗原 HAAH存在,而在正常肝細胞L02中只有藍色熒光并未有特異綠色熒光,表明在正常細胞L02中未檢測到HAAH表達。

圖10 單克隆抗體對抗原的ELISA反應曲線Fig. 10 Experimental ELISA curve for mAb with different antigen coating concentrations. (Antigen coating concentrations:20 μg/mL, 10 μg/mL, 5 μg/mL).

圖11 間接免疫熒光檢測結果Fig. 11 Results of indirect cellular immuno-fluorescence. (A) ACHN. (B) BIU-87. (C) MCF-7. (D) SMMC-7721. (E) Hep-2. (F)HeLa. (G) SKOV. (H) L02 (×40).
3 討論
人們對HAAH的研究已有10多年的歷史,早在1996年,Laurent等以肝癌細胞株FOCUS的細胞提取物為免疫原制備了針對肝癌細胞系的一系列單克隆抗體,用以鑒定人肝細胞惡變時的上調表達基因。結果發現單克隆抗體FB-50可與其中一種膜蛋白發生特異性結合反應,該蛋白在肝癌和膽管癌組織中高表達,并在多種變異的非正常細胞株中高表達,而在正常肝細胞和非新生上皮細胞不表達或低表達,在正常人體組織中只在胎盤滋養層細胞和腎上腺細胞高表達。后用RT-PCR法從HepG2人肝胚細胞瘤細胞系的γGT11表達文庫中分離出該蛋白的全序列 cDNA,并最終鑒定該蛋白為 HAAH。編碼基因長度為2 277 bp[1]。隨后,研究發現受HAAH催化的含有表皮生長因子樣結構域的蛋白 (如Notch及其配體) 與細胞分化有關,特別是其胞內區與致瘤性密切相關[2],因此HAAH與腫瘤的關系引起了科學家的關注,初期的研究結果表明HAAH可在膽管癌、肝癌、乳腺癌和結腸癌中高表達[4-8],而正常組織細胞中不表達或僅僅是彌散性弱表達。近年來研究顯示HAAH是受胰島素和胰島素樣生長因子-1調節的基因,Erk MAPK和AKT/PKB通路均參與對其表達的調節[9]。HAAH的作用機制目前還不完全清楚,但作為一種腫瘤相關抗原,HAAH與惡性腫瘤細胞的形成具有顯著相關性,已越來越受到關注。
本研究所利用的 pBV-IL1表達載體是在pBV220表達載體的基礎上改構而得到的載體。它保留了pBV220上的抗性基因、啟動子PRPL以及溫度誘導系統。在重組質粒pBV220-IL1中插入Xho I和Xba I酶切位點,不改變起始密碼子和終止密碼子前后的結構。本課題組研究發現HAAH在其他原核表達載體中很難獲得高效表達 (數據未列出),因此將HAAH基因克隆至pBV-IL1載體,pBV-IL1載體上的IL-1序列對融合蛋白的表達具有促進作用,表達的蛋白雖然是有IL-1存在的融合蛋白,但是這并不影響作為抗體制備中免疫抗原的性質[3]。胡剛等[10]在應用pBV-L1載體表達HCV核心蛋白的研究中發現,IL-1對目的基因的表達產生上調的作用,融合蛋白中的IL-1并不影響目的蛋白的抗原活性;載體的改構者宋曉國等在研究中[11],曾對 IL-1β的晶體構象進行分析,選擇了位于分子表面的 g環作為克隆酶切位點的插入部位,使得插入基因能呈現在IL-1的表面,這樣更有利于目的蛋白抗原位點的暴露,表達的抗原具有較好的免疫原性和反應原性。IL1具有免疫增強活性,可起到免疫佐劑的作用,有報道用細胞因子和免疫原融合表達以達到增強免疫的作用[12]。
所制備的單抗H3/E10在Western blotting檢測中只與表達出來的重組融合蛋白產生特異性結合反應,而與空載體經溫度誘導后產生的 18 kDa蛋白(IL-1片段) 無特異性結合反應,說明制備的單抗所識別的抗原決定簇存在于HAAH上而非IL-1,所制備的抗HAAH mAb具有很好的特異性。mAb經亞類測定,為 IgG1型,所以選擇了辛酸-硫酸銨沉淀法純化抗體,純化出的抗體純度高于80%,達到了后續實驗的純度要求。以間接細胞免疫熒光染色法對7株腫瘤傳代細胞作HAAH抗原檢測,結果都呈陽性,HAAH主要定位于腫瘤細胞的胞漿和細胞膜上,這與HAAH N-末端有錨定序列,并錨定于內質網膜相關[13]。
本研究成功地構建了高效表達HAAH的原核載體pBV-IL1-HAAH,并將純化的融合蛋白免疫Balb/c小鼠,獲得了 3個穩定的陽性單克隆細胞株,初步利用制備的單抗來介導間接免疫熒光檢測 HAAH在各種腫瘤細胞系中的表達。獲得的抗HAAH單克隆抗體為HAAH的結構和功能的研究奠定了基礎,同時也為進一步將該抗體應用于腫瘤的早期診斷以及研究HAAH在腫瘤發生轉移中的機理提供了重要工具。
REFERENCES
[1] Lavaissiere L, Jia S, Nishiyama M, et al. Overexpression of human aspartyl (asparaginyl) β-hydroxylase in hepatocellular carcinoma and cholangiocarcinoma. J Clin Invest, 1996, 98(6): 1313?1323.
[2] Jones LR, Zhang L, Sanborn K, et al. Purification, primary structure, and immunological characterization of the 26-kDa calsequestrin binding protein (junctin) from cardiac junctional sarcoplasmic reticulum. J Biolog Chemis, 1995, 270(51): 30787?30796.
[3] Song XG, Lin SG, Zhang HQ, et al. Construction of prokaryotic expression vector (pBVIL1) and using it in the expression of antigens of HCV. J Cellular Mol Immunol,2001, 17(3): 231?235.
宋曉國, 凌世淦, 張賀秋, 等. 高效原核融合表達載體(pBV-IL1) 的構建及在 HCV抗原表達中的應用. 細胞與分子免疫學雜志, 2001, 17(3): 231?235.
[4] Ince N, de la Monte SM, and Wands JR. Overexpression of human aspartyl (asparaginyl) b-hydroxylase is associated with malignant transformation. Cancer Res,2000, 60(5): 1261?1266.
[5] Maeda T, Sepe P, Lahousse S, et al. Antisense oligodeoxynucleotides directed against aspartyl(asparaginyl) β-hydroxylase suppress migration of cholangiocarcinoma cells. J Hepatol, 2003, 38(5):615?622.
[6] Takashi M, Ken-ichi T, Shin-ichi A, et al.Clinicopathological correlates of aspartyl (asparaginyl)β-hydroxylase over-expression in cholangiocarcinoma.Cancer Detect Prevent, 2004, 28(5): 313?318.
[7] Feldmann G, Nattermann J, Nischalke HD, et al. Detection of human aspartyl (asparaginyl) β-hydroxylase and homeobox B7 mRNA in brush cytology specimens from patients with bile duct cancer. Endoscopy, 2006, 38(6):604?609.
[8] Palumbo KS, Wands JR, Safran H, et al. Human aspartyl(asparaginyl) β-hydroxylase monoclonal antibodies:potential biomarkers for pancreatic carcinoma. Pancreas,2002, 25(1): 39?44.
[9] De la Monte1 SM, Tamaki1 S, Cantarini MC, et al. Aspartyl-(asparaginyl)-β-hydroxylase regulates hepatocellular carcinoma invasiveness. J Hepatol, 2006, 44(5): 971?983.
[10] Hu G, Dong XH, Xue XX, et al. Cloning of the truncated gene of hepatitis C virus core and expression in E. coli. J Xi’an Jiaotong Univ: Med Sci, 2005, 26(4): 320?326.
胡剛, 董曉慧, 薛小平, 等. 丙型肝炎病毒 C區截短型基因原核表達載體的構建及在大腸桿菌中的表達. 西安交通大學學報: 醫學版, 2005, 26(4): 320?326.
[11] Guo FK, Lin SG, Song XG, et al. Molecular cloning and expression of IL-1β and its mutants. Bull Acad Milit Med Sci, 1999, 23(3): 238?239.
郭甫坤, 凌世淦, 宋曉國, 等. 人白介素-1β及其突變體的克隆、表達與活性研究. 軍事醫學科學院院刊, 1999,23(3): 238?239
[12] Lee SW, Cho JH, Sung YC. Optimal induction of hepatitis C virus envelope-specific immunity by bicistronic plasmid DNA inoculation with the granulocyte-macrophage colony-stimulating factor gene. J Virol, 1998, 72(10):8430?8436.
[13] Dinchuk JE, Henderson NL, Burn TC, et al. Aspartyl beta-hydroxylase (Asph) and an evolutionarily conserved isoform of Asph missing the catalytic domain share exons with junctin. J Biol Chem, 2000, 275(50):39543–39554.
High throughput screening atrazine chlorohydrolase mutants with enhanced activity through Haematococcus pluvialis expression system
Huizhuan Wang, Xiwen Chen, Xiaohua Hao, and Defu Chen
Laboratory of Molecular Genetics, College of Life Sciences, Nankai University, Tianjin 300071, China
Expression of human aspartyl β-hydroxylase and preparation of its monoclonal antibody
Ting Huyan, Dachuan Yin, Wei Wang, Kai Song, Yan Wang, Huimeng Lu, Hui Yang,and Xiaoping Xue
Faculty of Life Science, Northwestern Ploytechnical University, Xi’an 710072, China
Received: July 19, 2010; Accepted: October 12, 2010
Supported by: Research and Development Special Projects for Public Welfare Industry of State Oceanic Administration People’s Republic of China(No. 200805044), National Natural Science Foundation of China (No. 31070717).
Corresponding author: Defu Chen. Tel/Fax: +86-22-23500133; E-mail: chendefu@nankai.edu.cn
海洋公益性行業科研專項 (No. 200805044),國家自然科學基金 (No. 31070717) 資助。
Received: July 21, 2010; Accepted: October 28, 2010
Supported by: Doctorate Foundation of Northwestern Polytechnical University (No. CX201023), Basic Scientific Research Foundation of Northwestern Ploytechnical University (No. 003).
Corresponding author: Xiaoping Xue. Tel/Fax: +86-29-88460541; E-mail: Xiaoping@fmmu.edu.cn
西北工業大學博士論文創新基金 (No. CX201023),西北工業大學基礎科研基金 (No. 003) 資助。

