鹽湖鹵水萃取提鋰及其機理研究
孫淑英 葉 帆 宋興福 李云釗 汪 瑾 于建國
(華東理工大學化學工程聯合國家重點實驗室,上海 200237)
鹽湖鹵水萃取提鋰及其機理研究
孫淑英 葉 帆 宋興福*李云釗 汪 瑾 于建國
(華東理工大學化學工程聯合國家重點實驗室,上海 200237)
本文以磷酸三丁酯(TBP)為萃取劑,煤油為稀釋劑,在FeCl3存在的條件下,選擇性萃取鹽湖鹵水中的鋰。系統研究了相比、萃取劑組成、鐵鋰比等對鋰萃取率的影響,及洗滌、反萃取工藝條件。得到最佳工藝條件為:萃取相比VO/VA為1.5,TBP質量分數為75%,cFe3+/cLi+=2,cH+=0.02 mol·L-1,萃取時間為20 min;洗滌相比VO/VA為15;反萃取相比VO/VA為20。并運用紅外與核磁方法分析研究,表明是TBP上的P=O雙鍵與LiFeCl4金屬配合物的配位水分子產生氫鍵作用而使金屬配合物與TBP結合。
萃取;鹵水;鋰;磷酸三丁酯
鋰是目前已知原子半徑最小、質量最輕的金屬,具有獨特的物理化學性質,是一種極其重要的能源金屬[1]。近年來鋰及其化合物在傳統工業領域和新材料領域方面得到廣泛應用,全球對金屬鋰的需求十分迫切[2]。鹽湖鋰資源占全球鋰儲量的69%和鋰儲量基礎的87%,我國亦具有豐富的鹵水鋰資源,主要分布在西藏和青海的鹽湖地區[3]。傳統鋰工業主要在偉晶巖型鋰礦中通過強能和化學回收工藝提取鋰產品,鹽湖鹵水提鋰工藝與之相比能耗低,工藝簡單,生產規模易于調整,成本低,是目前國內外的研究焦點[4]。
溶劑萃取法能有效地分離堿金屬和堿土金屬,是比較有研究前途的鹽湖提鋰方法[5],目前對萃取劑及萃取體系的研究,主要集中在醇、酮及β-雙酮類[6]、有機磷類[7]、季胺鹽-偶氮類離子螯合-締合類[8]、冠醚類[5]等方面。對于我國高鎂鋰比的鹽湖鹵水體系較為適用的是以FeCl3為共萃取劑的有機磷類萃取體系。Nelli等[9]提出80%DIBK-20%TBP體系,Li與以LiFeCl4配合物的形式共萃取進入有機相,但其反萃取復雜。許慶仁[10]發表20%N-503-20%TBP-200號煤油萃取體系,可用濃鹽酸進行反萃取。在此基礎上,中國科學院青海鹽湖研究所[11]發明50~70%TBP-30~50%200號磺化煤油萃取體系,多級萃取后鋰萃取率可達97%~99%。鄭延軍等[12]研究了75%TBP-5%SE30-磺化煤油等萃取體系,單級萃取鋰的回收率在60%左右。陳正炎等[13-16]研究了SK-SE萃取體系,也選取FeCl3作為共萃取劑,并進行了流程研究。孫錫良等[17-19]研究了TBP-溶劑汽油體系,鋰的單級萃取率可達到70%。朱慎林等[20]比較了 3種中性磷類萃取劑 TBP,DBBP和 TOPO在FeC13存在的情況下萃取鋰的效果比較,發現TBP的萃取效果最好,并考察了萃取階段最優條件。
雖然目前對以FeCl3為共萃取劑的有機磷類萃取體系的研究已有一定的成果,但還沒有以TBP-煤油-FeCl3為萃取體系,對萃取、洗滌、反萃取整個系統進行工藝條件優化,也沒有對此萃取體系機理進行深入探討。本文則從這兩個方向進行研究,通過實驗確定最優工藝條件,通過斜率法得到萃合比與萃取平衡常數,并用紅外、核磁等表征手段分析了萃取劑與金屬配合物之間的相互作用機理。
1 實驗部分
1.1 試劑和溶液
配制含 LiCl 0.2 mol·L-1、MgCl23.5 mol·L-1的溶液用于萃取實驗。
參照蒸發后西臺鹵水組成配制模擬鹵水,其主要 成 分 為 :Li+1.416 g·L-1,Na+7.944 g·L-1,K+16.606 g·L-1,Mg2+93.578 g·L-1,Cl-260.39 g·L-1,63.88 g·L-1,用于洗滌、反萃取實驗。
實驗所用主要試劑為:磷酸三丁酯(A.R.),FeCl3·6H2O(A.R.),鹽酸(A.R.)(均為國藥集團化學試劑有限公司),溶劑煤油(C.P.)。
1.2 儀器和設備
Metrohm 861離子色譜分析儀(瑞士Metrohm公司),Magna-IR 550傅里葉紅外光譜分析儀 (美國Nicolet公司),AVANCE 500超導傅立葉變換核磁共振波譜儀(德國BRUKER公司),Metrohm 827 pH計(瑞士Metrohm公司),HY-D智能多功能大型搖床(金壇市正基儀器公司)。
1.3 實驗方法
在含鋰溶液中加入一定濃度的鹽酸溶液與FeCl3·6H2O配制成水相,并與磷酸三丁酯(TBP)和煤油混合而成的有機相按一定的體積比(即相比)混合,室溫下置于250 mL磨口具塞三角燒瓶中在搖床(轉速:200 r·min-1)中振蕩 20 min 后置于分液漏斗中分相。萃取液用水洗滌以洗脫部分雜質金屬離子后用8 mol·L-1濃鹽酸反萃取。用離子色譜分析萃取、洗滌、反萃取后各階段水相中金屬離子的濃度,計算萃取率、洗脫率、反。其中cB,A、cB,O表示萃取洗滌反萃取前水相、有機相物質B的物質的量濃度;cB,A′、cB,O′表示萃取洗滌反萃取后水相、有機相物質B的物質的量濃度;VA、VO表示水相、有機相體積。萃取率
2 結果與討論
2.1 TBP-煤油體系萃取鋰萃取階段的影響因素
為確定TBP-煤油體系萃取鋰的條件,進行萃取單因素分析實驗,如無特殊說明,實驗中一般使用條件是:萃取劑中TBP%為60%~75%,有機相對水相(VO/VA)相比為 1.5~2;初始水相中 cLiCl=0.2 mol·L-1,cMgCl2=3.5 mol·L-1,cFe3+/cLi+=1.5~2,cHCl=0.02 mol·L-1,溶液為橙紅色;萃取時間為20 min。
2.1.1 萃取相比的影響
由圖1可知在萃取過程中,相比對于Li+萃取率的影響顯著,隨著相比增大,萃取率升高,在相比達到1.1后趨緩。當相比不大于1.2時,水相與有機相之間出現第三相,紅外研究表明,此時有機相主要為煤油,則該現象產生的原因可能為萃合物濃度超過其在有機相中的溶解度而析出,形成TBP與金屬離子聚集的第三相。第三相的產生會對萃取的質量傳遞和流體流動造成較大干擾,必須避免。所以實驗時采用相比為1.5,既保證較寬的工藝操作范圍,取得較高的萃取率,也可以降低萃取劑成本。

圖1 相比對鋰萃取率的影響Fig.1 Relation of extraction phase ratio and lithium extraction rate
2.1.2 TBP濃度的影響
由于TBP的粘度較大、密度接近于水,因此須加入稀釋劑以改善其物理性質,使兩相混合與分離易于進行[20],本實驗選用煤油作為稀釋劑。由圖2可知,隨著TBP含量的增加,有機分子與Li+之間的接觸機會增多,形成萃合物的幾率增大,萃取率升高;但當TBP含量過大,稀釋劑作用能力下降,萃取率會略有下降,同時實驗過程中當TBP濃度≤50%時,會出現三相現象,因此萃取體系選用TBP質量濃度為75%。

圖2 TBP濃度對鋰萃取率的影響Fig.2 Relation of TBP concentration and lithium extraction rate
2.1.3 鐵鋰濃度比的影響
FeCl3是作為協萃劑加入到水相中,其與Li+反應形成配合物LiFeCl4,再被萃入有機相中。由圖3可知,隨著鐵鋰比增大,萃取率增大,在鐵鋰比達到2后增加趨緩。實驗選取鐵鋰比為2,即cFe3+約為0.4 mol·L-1。
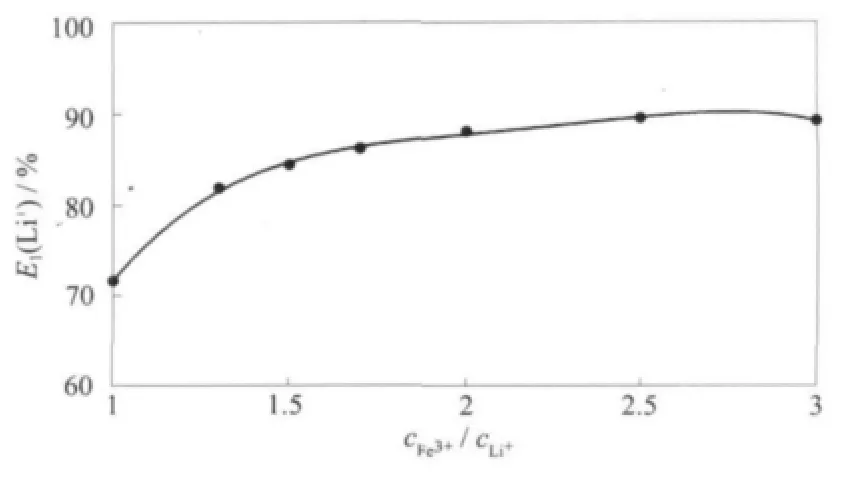
圖3 鐵鋰濃度比對鋰萃取率的影響Fig.3 Relation of cFe3+/cLi+and lithium extraction rate
2.1.4 萃取時間的影響
在萃取過程中,要達到平衡狀態,兩相需一定的接觸時間。圖4是萃取時間對鋰萃取率的影響,從圖中可以看出在10 min左右,萃取率已達到基本穩定,約為88%。從實驗中萃取后的水相顏色也可看出,初始水相為橙紅色,隨著萃取時間延長,水相顏色逐漸變淺,10 min后幾乎為無色,說明萃取基本完全。為確保萃取達到平衡,實驗時選取萃取時間為20 min。

圖4 萃取時間對鋰萃取率的影響Fig.4 Relation of extraction time and lithium extraction rate
2.1.5 初始水相酸度的影響
由于水相中含有Fe3+,為了防止其水解,需保證水相為酸性。改變水相酸度研究其對Li+萃取率的影響,由圖5可知,隨著溶液酸度增強,Li+的萃取率不斷下降,而H+的萃取率不斷上升,這是因為H+也可形成配合物HFeCl4,H+與Li+在配合物形成過程中存在競爭關系,活性順序為:H+>Li+。故初始水相的酸度不能太高,但必須保證鐵離子不水解,則選擇H+濃度為 0.02 mol·L-1。

圖5 酸度對鋰萃取率的影響Fig.5 Relation of cH+and lithium extraction rate
2.1.6 堿金屬離子的影響
由于鹵水中含有較多Na+、K+,也能分別與形成 NaFeCl4、KFeCl4配合物,與鋰離子產生競爭,則需要研究Na+、K+離子含量對于Li+萃取率的影響。由圖6可知,Na+與K+的加入,使鋰的萃取率逐漸降低,由88%降到約84%,Na+比K+的影響力更強。

圖6 鈉離子和鉀離子對鋰萃取率的影響Fig.6 Relation of cNa+、cK+and lithium extraction rate
2.2 TBP-煤油體系萃取鋰洗滌階段的影響因素
雖然萃取階段進行了有選擇性的萃取,Li+萃取率可達88%,而Mg2+、Na+、K+萃取率分別只有3%、10%、2%左右,但由于原始水相中雜質金屬離子濃度較高,還是有一定量的雜質離子進入了萃取液,因此,需要用水對萃取得到的有機相進行洗滌,盡可能多地脫除雜質金屬離子,特別是Mg2+。洗滌階段初始有機相采用萃取模擬鹵水后的萃取液,其中主要成分為:Li+0.875 g·L-1,Na+0.882 g· L-1,K+0.244 g·L-1,Mg2+2.893 g·L-1。
圖7中可以看出隨著有機相對水相(VO/VA)相比增大,Li+的洗脫率先急速下降,當相比達到20后,趨于穩定,而Mg2+、Na+、K+的洗脫率也隨相比增大而下降,但在相比10~20之間下降趨緩。考慮到需要收集盡可能多的Li+,同時除去盡可能多的雜質離子,則選取15為最佳相比。

圖7 洗滌相比對離子洗脫率的影響Fig.7 Relation of washing phase ratio and ion washout rate
2.3 TBP-煤油體系萃取鋰反萃取階段的影響因素
相比影響實驗中選取濃鹽酸濃度為8 mol·L-1[10]。由圖8可知,金屬離子的反萃取率都是隨著相比(VO/VA)增大而減小的,Li+反萃取率下降得最快,當相比為10時,Li+與其他離子反萃取率差值最大,但反萃取后水相中 Li+為 6.936 g·L-1, 濃度較小,當相比為20時,能較好分離Li+與其他金屬離子,同時保證反萃取后的水相中Li+濃度較高,則選擇20為最佳反萃取相比。

圖8 反萃取相比對離子反萃取率的影響Fig.8 Relation of back extraction phase ratio and ion back extraction rate
2.4 斜率法測定萃合比及萃取平衡常數
為確定萃合比、萃取平衡常數及萃取反應方程式,采用斜率法進行研究。萃取實驗中改變TBP質量分數,其余條件為萃取相比VO/VA為1.5,cFe3+/cLi+=,萃取時間為 20 min。設 TBP 萃取鋰的方程式如下[19-22]:

其中,n為萃合比,D為分配比,Kex為平衡常數。
實驗中改變TBP濃度,其他條件采用萃取實驗得到最佳工藝條件,以lgD-lgcFeCl-對lgcTBP作圖得如
4圖9的直線,斜率為2.18,則n可歸整為2,說明萃合物組成應為LiFeCl4·2TBP,由直線截距求得Kex=5.09 L3·mol-3。
2.5 萃取機理研究
Morris等[7]研究過用TBP直接萃取LiCl溶液,萃取率小于5%。而加入FeCl3為共萃取劑后萃取率達到88%,說明Li+是以與FeCl4-配位陰離子結合成的LiFeCl4形式被萃入有機相。金屬配合物在水中會發生水合作用,水分子以配位鍵與其結合,則萃取劑與金屬配合物的作用機理包括直接與金屬配合物生成配位鍵結合或者與配位水分子形成氫鍵結合[21]。為探索此作用機理,本文采用了紅外與核磁分析萃取前后TBP譜圖的方法。

圖9 斜率法測定萃合比及萃取平衡常數Fig.9 Determination of combined ratio and extraction equilibrium constant by slope method
2.5.1 紅外光譜分析結果
圖10是純TBP、萃取20與30 min后TBP的紅外譜圖。TBP在2900 cm-1左右有C-H伸縮振動峰,在1 280 cm-1處有P=O鍵的強吸收峰,在1 030 cm-1處有P-O-C的不對稱伸縮振動峰。20和30 min的有機相譜圖幾乎相同,說明萃取20 min后已平衡,實驗時取萃取時間為20 min是合理的。

圖10 萃取劑、萃取20和30 min有機相的紅外光譜圖Fig.10 IR spectra of extractant and organic phases after 20,30 min extraction
從圖10中可以看出,P=O的特征吸收峰在萃取前在1280 cm-1處,萃取后吸收峰位于1270 cm-1處,偏移了10 cm-1,這是由于P=O中,P原子與O原子的電負性相差很大,電子云很大程度上偏向O原子,O原子與外界物質作用后,電子云偏向外界物質,使得P=O鍵拉長,振動頻率降低。但P=O雙鍵特征吸收峰偏移較小,說明其受到的作用力較弱,是氫鍵作用[23-24],則TBP是與金屬配合物的配位水分子通過氫鍵結合。
2.4.3 核磁分析結果
圖11為萃取前后TBP的核磁分析譜圖,從中可知萃取后質子化學位移普遍向低場移動并寬化,但質子的化學位移變化較小。這說明產生了氫鍵[25],金屬配合物的配位水分子與有機物作用,對有機物中的質子產生了自旋干擾。同時此干擾強度隨著質子和發生氫鍵作用的官能團之間距離的增加而減弱,離官能團越近的質子化學位移值增加越大,則從圖11可以看出,TBP上-CH2-O-P-上的質子化學位移由4.0移動到4.4,變化最大,驗證了紅外分析的結果,是TBP上的P=O與金屬配合物的內層水分子產生了氫鍵作用。

圖11 萃取前后有機物的核磁共振譜圖Fig.11 1H NMR spectra of organic phases before and after extraction
3 結 論
本實驗系統研究了TBP-煤油-FeCl3萃取體系的萃取、洗滌、反萃取的最佳工藝條件:萃取相比VO/VA為 1.5,TBP質量分數為 75%,0.02 mol·L-1,萃取時間為 20 min;洗滌相比為 15;反萃取相比為20。鋰離子的單級萃取率可達到88%左右,反萃取后鋰離子濃度約為11.5 g·L-1,鋰離子收率約為60%。
通過斜率法確定了萃取反應萃合比為2,萃取平衡常數為5.09 L3·mol-3。通過紅外與核磁分析研究,表明是通過TBP上的P=O雙鍵與LiFeCl4金屬配合物的配位水分子產生氫鍵作用而使得金屬配合物與TBP結合。
[1]HUANG Qun(黃群).Chin.J.Org.Chem.(Youji Huaxue),1979,1:90-118
[2]Armstrong A,Peter G.Nature,1996,381:499-500
[3]GAO Shi-Yang(高世揚),SONG Peng-Sheng(宋彭生),XIA Shu-Ping(夏樹屏),et al.Salt Lake Chemistry-New Type Lithium Boron Salt Lake(鹽湖化學新類型硼鋰鹽湖).Beijing:Science Press,2007:5-10
[4]Neipert M,Bon K.US Patent,3306700.1967-02-28
[5]ZHANG Jin-Cai(張金才),WANG Min(王敏),DAI Jing(戴靜).J.Salt Lake Res.(Yanhu Yanjiu),2005,13(1):42-48
[6]Gabra G G,Torma A E.Hydrometallurgy,1978,3(1):23-33
[7]Morris D C,Short E L.J.Inorg.Nucl.Chem.,1963,25(3):291-301
[8]SHENG Hai-Yu(盛懷禹),LI Bei(李蓓),CHEN Yao-Huan(陳耀煥),et al.Acta Chim.Sin.(Huaxue Xuebao),1995,53:689-694
[9]Neilli J R,Arthur T E.US Patent,3537813.1970-11-03
[10]XU Qing-Ren(許慶仁).Chin.J.Org.Chem.(Youji Huaxue),1979,1:13-32
[11]QinghaiInstituteofSaltLakes,ChineseAcademyof Sciences(中科院青海鹽湖研究所).CN87103431,1987.
[12]ZHENG Yan-Jun(鄭延軍).Thesis for the Master of University of Science&Technology Beijing(北京科技大學碩士論文).2002.
[13]CHEN Zheng-Yan(陳正炎),QIU Shi-Yuan(仇世源),GU Wei-Liang(古偉良),et al.Chin.J.Rare Metals(Xiyou Jinshu),1996,20(3):161-164
[14]CHEN Zheng-Yan(陳正炎),GU Wei-Liang(古偉良),CHEN Fu-Zhen(陳富珍),et al.Chin.J.Rare Metals(Xiyou Jinshu),1997,21(2):89-92
[15]CHEN Zheng-Yan(陳正炎),CHEN Fu-Zhen(陳富珍),GU Wei-Liang(古偉良).Chin.J.Rare Metals(Xiyou Jinshu),1998,22(1):5-9
[16]CHEN Zheng-Yan(陳正炎),GU Wei-Liang(古偉良),CHEN Fu-Zhen(陳富珍),et al.Chin.J.Rare Metals(Xiyou Jinshu),1999,23(2):95-99
[17]SUN Xi-Liang(孫錫良).Thesis for the Master of Central South University(中南大學碩士論文).2005.
[18]XU Hui(徐徽),SUN Xi-Liang(孫錫良),HOU Li-Song(侯立松).Hunan Nonferrous Metals(Hunan Youse Jinshu),2005,21(1):9-10
[19]SUN Xi-Liang(孫錫良),CHEN Bai-Zhen(陳白珍),XU Hui(徐徽),et al.J.Central South Univ.:Sci.&Tech.(Zhongnan Daxue Xuebao:Ziran Kexue Ban),2007,38(2):262-266
[20]ZHU Shen-Lin(朱慎林),PIAO Xiang-Lan(樸香蘭),GOU Ze-Ming(緱澤明).J.Tsinghua.Univ.:Sci.&Tech.(Qinghua Daxue Xuebao:Ziran Kexue Ban),2000,40(10):47-50
[21]ZHU Tun(朱屯).Solvent Extraction and Ion Exchange(萃取與離子交換).Beijing:Metallurgical Industry Press,2005:49-52
[22]CHEN Zheng-Yan(陳正炎),GU Wei-Liang(古偉良),QIU Shi-Yuan(仇世源),et al.Chin.J.Rare Metals(Xiyou Jinshu),1996,20(4):259-264
[23]XIE Qi-Ying(謝琦瑩),CHEN Jing(陳景),YANG Xiang-Jun(楊項軍),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2007,23(1):57-62
[24]CHEN Zheng-Yan(陳正炎),CHEN Fu-Zhen(陳富珍),GU Wei-Liang(古偉良),et al.Chin.J.Rare Metals(Xiyou Jinshu),1997,21(1):19-24
[25]ZHANG Hua(張華).Spectrometric Identification of Organic Structure(有機結構波譜鑒定).Dalian:Dalian University of Technology Press,2009:94-128
Extraction of Lithium from Salt Lake Brine and Mechanism Research
SUN Shu-Ying YE Fan SONG Xing-Fu*LI Yun-Zhao WANG Jin YU Jian-Guo
(State Key Laboratory of Chemical Engineering,East China University of Science and Technology,Shanghai 200237,China)
The paper presents extraction of lithium from salt lake brine by tributyl phosphate(TBP)-kerosene-FeCl3extraction system.Extraction,washing and back extraction stages were studied systematically.The best conditions were determined by studying the single factors of extraction VO/VAratio,extractant composition,molar ratio of Fe3+to Li+and so on,and the results were:extraction VO/VAis 1.5,TBP%is 75%,cFe3+/cLi+is 2,cH+ is 0.02 mol·L-1,extraction time is 20 min;washing VO/VAis 15;back extraction VO/VAis 20.The interaction of lithium complex with TBP was investigated by IR and NMR.The results showed that the complex and TBP were associated by hydrogen bond.
extraction;brine;lithium;TBP
TQ420.6;TF826.3
:A
:1001-4861(2011)03-0439-06
2010-10-08。收修改稿日期:2010-11-10。
中央高校基本科研業務費專項資金;國家自然科學基金(No.20906022)資助項目。
*通訊聯系人。 E-mail:xfsong@ecust.edu.cn
- 無機化學學報的其它文章
- Synthesis,Crystal Structure and Cytotoxicity of Palladium(Ⅱ)Complexes with N-(4-methylbenzoyl)-L-valine Dianion and Aromatic Diimine
- Synthesis,Crystal Structure of Uranium-Potassium Heteronuclear Coordination Polymer
- Synthesis,Crystal Structure and Antibacterial Activity of Magnesium(Ⅱ)Complex with N-Benzenesulphonyl-L-phenylalanine and 1,10-Phenanthroline
- 氧化鈦催化羥基磷灰石分解制備可降解磷酸鈣陶瓷
- 菱鎂礦風化石與葉臘石合成堇青石的結構表征
- 微波水熱時間對C/C復合材料結構和抗氧化性能的影響

