超聲聯合PW11O7-39 /TiO2光催化降解亞甲基藍
李 佳, 董 學 偉, 董 曉 麗, 張 家 榮
( 1.大連工業大學 化工與材料學院, 遼寧 大連 116034;2.大連交通大學 環境與化學工程學院, 遼寧 大連 116028 )
0 引 言
染料廢水成分復雜,一般的化學和生物等方法處理該類廢水的效果均不理想。TiO2因其無毒無害、化學性質穩定和催化高效的優勢,在處理水中有機污染物的研究領域最為活躍[1],而雜多酸因其與半導體氧化物具備相似的結構特點被研究者關注,有研究表明它可以作為有效的電子受體,減緩受光激發的TiO2上電子和空穴結合的速度,從而達到增強光催化性能的效果[2]。但印染廢水色度深,濁度大,紫外光對非透明物質的穿透能力很低,光的利用率不高。而超聲波不存在這個問題,一般情況下,超聲波的穿透能力在15~20 cm[3]。作者采用超聲波(US)聯合紫外光(UV)來輻射PW11O7-39/TiO2催化劑去降解亞甲基藍模擬染料廢水,探討處理染料廢水新思路。
1 實 驗
1.1 PW11O7-39/TiO2催化劑的制備
將0.05 mol磷鎢酸(H3PW12O40)和0.35 mol乙酸鈉分別加入到盛有0.5 mL蒸餾水的試管中,充分振蕩10 min后,緩慢滴入1 mL無水乙醇,邊滴邊振蕩得到溶液A。將11 mL無水乙醇溶液倒入燒杯中,在強烈攪拌下,緩慢滴入3 mL鈦酸丁酯[Ti(OC4H9)4],使之充分混合,10 min后滴入1 mL冰乙酸,5 min后用HCl調pH=1.5得到溶液B。5 min后,在劇烈攪拌下把溶液A緩慢滴入溶液B中,持續攪拌1 h,超聲振蕩1 h,反應停止,得到穩定均勻半透明溶膠。將溶膠在80 ℃干燥箱內干燥1 h,研磨,放入5 ℃/min的速度升溫的電阻爐中,在350 ℃下煅燒1 h,隨爐冷卻,取出,得到PW11O7-39/TiO2復合催化劑。
1.2 超聲聯合PW11O7-39/TiO2光催化亞甲基藍的降解與分析
在室溫下,將一定量PW11O7-39/TiO2復合催化劑,加入到盛有新配的初始質量濃度C0=5 mg/L的亞甲基藍染料溶液的燒杯中,將燒杯至于超聲波反應器中(40 kHz),以高壓汞燈為光源,燈底部距反應液面17 cm,改變超聲功率(P)、初始pH、催化劑投加量(ρ)等條件,進行超聲光催化降解反應,在一定的反應時間間隔取一定量反應液,離心分離后,取上層澄清液,用PE公司LAMBDA 35型號UV-vis光譜儀在λmax=664 nm測定吸光度,利用染料的吸光度和濃度關系的工作曲線(R2=0.999 8)計算出反應后染料溶液濃度Ct,溶液的脫色情況以染料的濃度變化來表示。反應液的初始TOC0和反應后的TOCt用日本理學公司的TOC-VCPH來進行測定分析。
2 結果與討論
2.1 反應條件對亞甲基藍降解的影響
2.1.1 超聲功率
由圖1可知,隨著超聲功率的增加,亞甲基藍的降解效果越好,250 W以上變化趨于平穩,降解效果變化不大,在450 W時甚至有下降的趨勢。有研究表明,在其他條件不變時,提高超聲功率亦即意味著增大超聲波的聲能密度,空化程度也隨之增加,空化泡內的溫度、壓力相應提高,即空化泡內的物理化學環境對污染物的降解更為有利[4];但超聲功率也不可過高,因為如果聲能太大,空化泡會在聲波的負相長得很大而形成聲屏蔽,反而使系統可利用的聲場能量降低[5],致使亞甲基藍的降解率也隨之降低。由于噪聲和能源的考慮,本文都采用功率P=250 W進行實驗。
2.1.2 溶液初始pH
隨著亞甲基藍溶液初始pH的增大去除率也增加,在弱堿性條件下,效果最為明顯(圖2)。這是因為,在堿性條件下,TiO2表面帶負電荷,同時PW11O7-39也帶負電荷,而亞甲基藍為陽離子染料,有利于亞甲基藍在復合催化劑上的吸附。另外,PW11O397-可作為電子受體,接收光生電子,從而延長電子和空穴復合時間,有高度活性的空穴在反應中消耗水中的OH-,將其氧化成具有強氧化活性的·OH。有研究表明,當在強堿性條件下,·OH的猝滅速度增快[6],溶液易脫穩形成絮體,影響反應體系對光的吸收,導致降解率下降,而本實驗中,采用聯合超聲波降解,彌補了對光吸收弱的問題,在強堿性條件下,亞甲基藍的降解率并沒有大幅下降,而是維持在一個較高的數值上。染料溶液在弱堿性的條件下光催化降解效果較好,實驗反應溶液選擇在pH=7.5進行。

圖1 超聲功率對亞甲基藍降解的影響

圖2 初始pH對亞甲基藍降解的影響
2.1.3 PW11O7-39/TiO2投加量(ρ)
從圖3可以看出,隨著ρ的增加,染料溶液的去除率也隨之增加,但當ρ>0.2 g/L時,脫色率變化不是很明顯,如果繼續增加到0.6 g/L,去除率反而有所下降。這是因為,在催化劑增加的初期,盡可能多的催化劑意味著有盡可能多有效光子加速了光催化反應的速率,但是當催化劑用量增加到一定程度時,光催化產生的·OH 的量一定,催化劑過量時反而會造成光的散射,相互之間對光的掩蔽作用也使有效光子的產生率降低。同樣,過量的催化劑也會分散超聲震動帶來的能量,從而導致光催化反應速率的下降。從實驗得出,催化劑投加量在0.2~0.4 g/L染料的降解效果較好,本實驗將選用0.2 g/L的催化劑作為實驗條件來進行實驗。

圖3 催化劑投加量對亞甲基藍降解的影響
2.2 超聲聯合PW11O7-39/TiO2催化降解亞甲基藍過程的分析
2.2.1 紫外-可見光譜分析
圖4為降解亞甲基藍隨時間變化的UV-vis譜圖。由圖4可見,隨著反應時間的增加,原始染料溶液在可見光區613和664 nm的吸收峰逐漸減弱,并在90 min后基本消失,說明亞甲基藍中的生色團已被破壞。664 nm處的吸收峰發生藍移,逐漸移至568 nm處,這可能是由于亞甲基藍分子脫甲基作用的結果。在近紫外區,291 nm處的吸收峰為亞甲基藍共軛體系的吸收峰,該吸收峰逐漸增強,說明隨著反應時間的增加,大的共軛體系被逐漸分解為含有共軛雙鍵的小分子,此處的強吸收峰表明至少有3個或3個以上的共軛雙鍵產生。在218和249 nm左右的吸收峰,也隨著反應時間的增加而增加,然而在180 min后,吸收峰又有所降低,說明隨著反應時間的增加,中間產物可逐漸被分解。

a: 0 min, b: 30 min, c: 60 min, d: 90 min, e: 120 min, f: 150 min, g: 180 min
2.2.2 亞甲基藍降解過程去除率隨時間變化的分析
從圖5可以看出,反應90 min后,溶液色度基本被去除。TOC的去除呈現出先快后慢的趨勢。反應的前30 min,復合催化劑對亞甲基藍的吸附起主要作用,當吸附/脫附維持在一個相對平衡的階段后,光催化和超聲作用開始占主導地位,溶液開始被逐漸礦化。在光催化和超聲波的共同作用下,有色基團很容易被去除。而在反應180 min后,TOC去除率為64%,說明仍有中間產物很難被分解礦化。聯合降解體系對亞甲基藍的降解,呈現出快脫色慢礦化的過程,且有難降解物質仍未被去除。

圖5 超聲聯合PW11O7-39/TiO2光催化降解亞甲基藍降解過程的C和 TOC變化圖
2.3 亞甲基藍不同降解途徑的效果對比
圖6為不同降解途徑下降解亞甲基藍效果的對比圖。從圖6可以看到,單獨US降解亞甲基藍的效率很低,以UV為光源,用PW11O7-39/TiO2復合催化劑對亞甲基藍進行光催化降解時,效率較高,而在US聯合PW11O7-39/TiO2光催化作用下,降解效果最高,在反應180 min后,溶液色度和TOC去除率分別為99.2% 和62%。這是因為超聲波可穿透透明度較低的染料溶液,提供更多、更有效的能量激發TiO2產生電子和空穴;同時PW11O7-39作為電子受體捕獲電子,從而延長電子和空穴再結合時間,空穴與H2O和OH-產生高氧化性·OH,從而達到降解亞甲基藍的效果。另外,超聲波的機械振動效應使得催化劑表面得到不斷的摩擦、沖洗和更新,有效表面積增加,保持較多的催化活性位,強化降解效果。
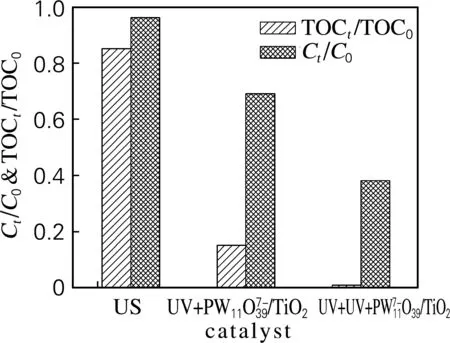
圖6 不同降解方式對亞甲基藍的降解效果對比
3 結 論
采用超聲聯合PW11O7-39/TiO2光催化對溶液中亞甲基藍的去除十分有效,可使含亞甲基藍廢水完全脫色,TOC去除率也很高,且其降解效果優于單純的超聲和PW11O7-39/TiO2光催化對亞甲基藍的降解。弱堿性條件有利于亞甲基藍的降解,超聲功率和PW11O7-39/TiO2投加量分別在250~350 W和0.2~0.4 g/L亞甲基藍的降解效果較好。從超聲聯合PW11O7-39/TiO2光催化降解亞甲基藍的UV-vis譜圖中得出,亞甲基藍的有色基團很容易被去除,而大共軛基團只能被分解成含有共軛雙鍵的小分子,若使之完全礦化,還需要更苛刻的條件和較長時間。
[1] REDDY E P, SUN B, SMIMIOTIS P G. Transition metal modified TiO2-loaded MCM-41 catalysts for visible-and UV-light driven photodegradation of aqueous organic pollutants[J]. The Journal of Physical Chemistry B, 2004, 108:17198-17205.
[2] YANG Yu, WU Qingyin, GUO Yihang, et al. Efficient degradation of dye pollutants on nanoporous Polyoxotungstate-anatase composite under visible-light irradiation[J]. Journal of Molecular Catalysis A:Chemical, 2005, 225:203-212.
[3] ABBASI M, RAZZA N. Sonochemical degradation of basic blue 41 dye assisted by nano TiO2and H2O[J]. Journal of Hazardous Materials, 2008, 153:942-947.
[4] ZHANG Hui, ZHANG Jianhua, ZHANG Chunyang, et al. Degradation of C. I. Acid Orange 7 by the advanced Fenton process in combination with ultrasonic irradiation[J]. Ultrasonics Sonochemistry, 2009, 16:325-330.
[5] HARTMANN J, BARTELS P, MAU U, et al. Degradation of the drug diclofenac in water by sonolysis in presence of catalysts[J]. Chemosphere, 2008, 70:453-461.
[6] SHIMIZU N, OGINO C, DADJOUR M F. Sonocatalytic degradation of methylene blue with TiO2pellets in water[J]. Ultrasonics Sonochemistry, 2007, 14:184-190.

