近平衡狀態(tài)海水中方解石和文石沉淀速率及動(dòng)力學(xué)研究
陶小晚, 蒲曉強(qiáng)
(1. 中國(guó)石油勘探開(kāi)發(fā)研究院, 北京 100083; 2. 廣東海洋大學(xué) 工程學(xué)院, 廣東 湛江 524088)
近平衡狀態(tài)海水中方解石和文石沉淀速率及動(dòng)力學(xué)研究
陶小晚1, 蒲曉強(qiáng)2
(1. 中國(guó)石油勘探開(kāi)發(fā)研究院, 北京 100083; 2. 廣東海洋大學(xué) 工程學(xué)院, 廣東 湛江 524088)
利用“freedrift”開(kāi)放反應(yīng)系統(tǒng), 研究人工海水中近沉淀平衡狀態(tài)時(shí)二氧化碳分壓(p(CO2))的變化對(duì)方解石、文石沉淀速率及其動(dòng)力學(xué)方程的影響。反應(yīng)在恒定的溫度(25.0℃±0.2℃)、p(CO2)環(huán)境下進(jìn)行, 通過(guò)實(shí)驗(yàn)得到了不同p(CO2)環(huán)境下, 方解石和文石的沉淀速率及動(dòng)力學(xué)方程。研究發(fā)現(xiàn): (1) 晶體類型和碳酸鹽堿度相同時(shí),p(CO2)越低沉淀速率越大; 飽和度(?)和p(CO2)相同時(shí), 方解石沉淀速率低于文石, 且p(CO2)越高, 沉淀速率越低。(2) 對(duì)于方解石, 當(dāng)p(CO2)介于 3 050×10?6和 3 200×10?6之間,1.5<?<3.1 時(shí), 反應(yīng)級(jí)數(shù)n=2.4; 當(dāng)p(CO2)≈130×10?6, 1.2<?<3.0 時(shí),n=2.6; 對(duì)于文石, 當(dāng)p(CO2)≈ 2 300×10?6, 1.1<?< 2.0 時(shí),n=3.2; 當(dāng)p(CO2)≈320×10?6, 1.1<?<1.9 時(shí),n=2.0。本研究結(jié)果加深了對(duì)不同沉積環(huán)境下方解石和文石沉淀機(jī)制的理解。此外, 不同方解石飽和度(?c)條件下方解石和文石沉淀速率的研究為探討為何現(xiàn)代淺海碳酸鹽沉積物以文石為主、而海底沉積物中的自生碳酸鈣礦物主要為方解石的現(xiàn)象提供了一種較好的解釋方案。
人工海水; 方解石; 文石; 沉淀; 飽和度; 碳酸鹽堿度; 反應(yīng)級(jí)數(shù)
在顯生宙, 碳酸鹽巖約占沉積巖總量的 20%,世界上 60%的油氣儲(chǔ)量與碳酸鹽巖儲(chǔ)層有關(guān)[1], 組成碳酸鹽巖的主要礦物是方解石和白云石, 且前者的量明顯大于后者。在深海沉積物中, 方解石是含量最高的碳酸鹽礦物, 而在現(xiàn)代淺海沉積物中, 文石和方解石是主要的碳酸鹽礦物。因此, 模擬方解石、文石的沉淀速率及動(dòng)力學(xué)過(guò)程對(duì)于理解人類活動(dòng)排放的 CO2對(duì)氣候的影響、海洋中碳酸鹽沉積物生成與溶解、全球碳循環(huán)以及碳酸鹽成巖作用的定量研究具有重要意義[2]。
在過(guò)去幾十年中, 人們?cè)诓煌臏亍杭叭芤撼煞謼l件下, 對(duì)方解石、文石的沉淀速率及沉淀反應(yīng)級(jí)數(shù)進(jìn)行了大量研究[3-6]。由于海水成分復(fù)雜, 鎂離子[7-9]和磷酸鹽[5]等會(huì)對(duì)方解石和文石沉淀速率造成影響, 因此對(duì)海水中方解石和文石沉淀過(guò)程的研究多用沉淀速率與飽和度(?)之間的經(jīng)驗(yàn)關(guān)系式來(lái)表示[2]。目前, 研究中主要存在兩個(gè)問(wèn)題: (1)近溶解-沉淀平衡處, 由于較小的pH值誤差、微小的溫度或二氧化碳分壓(p(CO2))的變化都對(duì)?的計(jì)算產(chǎn)生較大的影響, 故而一直缺乏可靠的數(shù)據(jù); (2)不同的學(xué)者[3-6,10-12]利用實(shí)測(cè)或模擬實(shí)驗(yàn)得到的反應(yīng)級(jí)數(shù)n有很大差異。為了解決以上兩個(gè)問(wèn)題, 本文利用“free drift”開(kāi)放反應(yīng)系統(tǒng), 在恒壓力(1×105Pa)、恒溫度(25.0℃±0.2℃)、恒p(CO2)環(huán)境下, 研究海水中近溶解-沉淀平衡狀態(tài)p(CO2)的變化對(duì)方解石溶解-沉淀速率及其動(dòng)力學(xué)方程的影響, 以得到不同p(CO2)時(shí)方解石溶解-沉淀速率及動(dòng)力學(xué)方程, 并探討反應(yīng)級(jí)數(shù)n產(chǎn)生差異的原因。
1 材料與方法
1.1 實(shí)驗(yàn)試劑和儀器
實(shí)驗(yàn)試劑有: 人工海水、方解石晶體、文石晶體和CO2/N2混合氣體。人工海水的配制參照文獻(xiàn)[13],不含 PO43-離子, 以排除其對(duì)反應(yīng)過(guò)程的干擾[5], 鹽度為35。方解石采用超純級(jí)方解石(Sigma?), 文石用超純級(jí)方解石(Sigma?)制成[11]。
儀器有: 洗氣瓶、聚四氟乙烯材質(zhì)的分液漏斗狀反應(yīng)器(Nalgene?, 容積約 600 mL)、恒溫槽(Thermo?Haake, 精度±0.1 ℃)、溫度計(jì)(精度±0.1 ℃)、去離子水、過(guò)濾器、濾膜(0.45μ)、電子天平(精度0.000 1 g)、pH 電極(Orion, 8102BNUWP, 精度 0.001)、pH 計(jì)(Mettler?235, 精度 0.1 V)、電位滴定儀(萬(wàn)通798MPT Titrino)。
方解石和文石表面積測(cè)定采用 Kr-BET[14]方法,S方解石=0.76 m2/g,S文石=0.77 m2/g ,S晶體為晶體的表面積。pH值測(cè)定標(biāo)準(zhǔn)采用三羥甲基氨基甲烷(Tris)和2-氨基-2-甲基-1-丙醇(AMP), Tris和 AMP的配制及pH值的測(cè)定方法參照DOE[15], pH值的計(jì)算以 Tris作為標(biāo)準(zhǔn)。
1.2 實(shí)驗(yàn)操作過(guò)程
首先過(guò)濾人工海水, 準(zhǔn)確稱量后加入反應(yīng)器中(圖1)。反應(yīng)器放置在恒溫槽內(nèi), 以保持溫度恒定, 恒溫槽控溫精度為±0.1℃。接著, 稱取一定量的NaHCO3粉末(精確到0.000 1 g), 加入反應(yīng)器中, 以調(diào)節(jié)反應(yīng)液初始飽和度(?0)。然后, 從反應(yīng)器底部通入p(CO2)恒定的CO2/N2的混合氣體。混合氣體的有效成分為 CO2。混合氣體在通入反應(yīng)器前經(jīng)過(guò)洗氣瓶中去離子水的濕潤(rùn)。從反應(yīng)器底部通入的混合氣體有兩個(gè)作用: (1) 保持反應(yīng)液具有恒定的p(CO2)(溶解過(guò)程后期才能真正達(dá)到p(CO2)平衡); (2) 起攪拌作用。通入反應(yīng)液的混合氣體壓力要較高, 以使文石或方解石晶體粉末和反應(yīng)液充分混合。在本實(shí)驗(yàn)中假定反應(yīng)液和晶體混合均勻, 每次采樣后, 晶體和溶液的質(zhì)量比不發(fā)生改變。
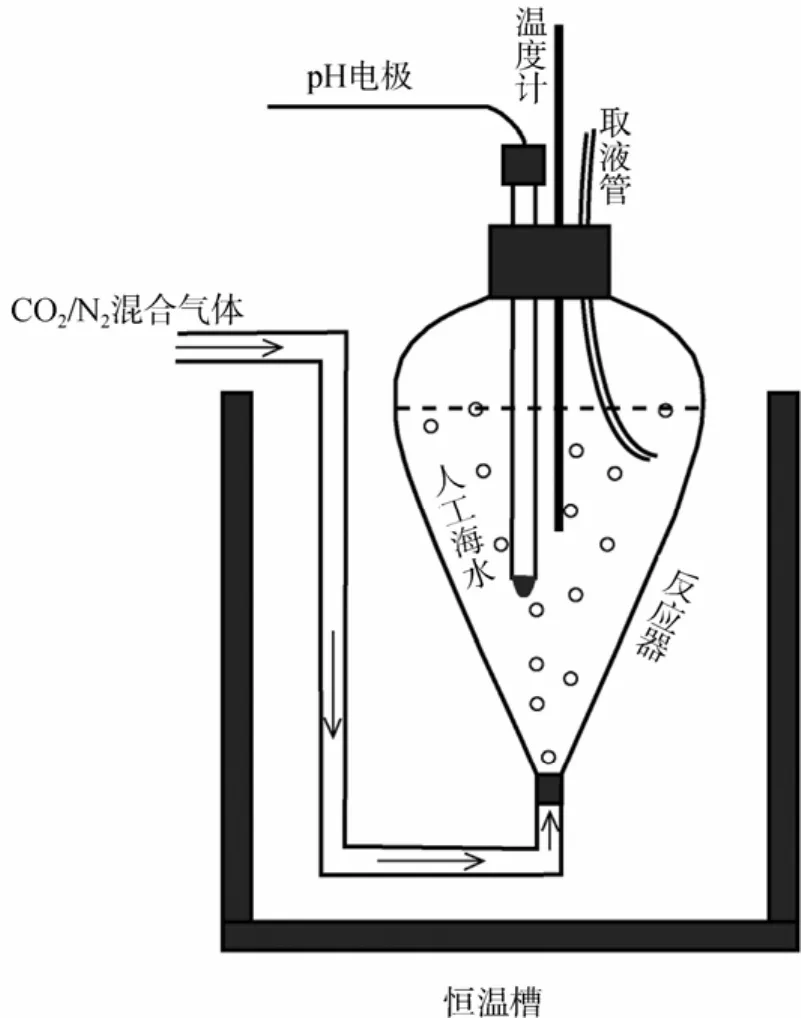
圖1 沉淀反應(yīng)裝置Fig. 1 Precipitation-reaction equipments
實(shí)驗(yàn)在常壓下進(jìn)行, 為了最大程度減少反應(yīng)液的蒸發(fā), 在反應(yīng)器的上口部, 用塑料薄板遮擋。反應(yīng)器的口部留有插入溫度計(jì)、電極、取液管等大小合適的孔。溫度計(jì)的精度為±0.1℃, 可以實(shí)時(shí)監(jiān)測(cè)反應(yīng)溫度。插入取液管是為了避免在取樣時(shí)打開(kāi)反應(yīng)器口部造成反應(yīng)環(huán)境的波動(dòng), 以最大限度的維持反應(yīng)液反應(yīng)環(huán)境(溫度、p(CO2))的恒定。
當(dāng)溶液和混合氣體間達(dá)到p(CO2)平衡(ΔpH<0.002 單位/h)時(shí), 加入文石或方解石晶體粉末(精確到0.000 1 g), 每千克人工海水中設(shè)計(jì)加入晶體粉末的質(zhì)量為 2.5 g。加入晶體的時(shí)刻, 代表實(shí)驗(yàn)正式開(kāi)始, 同時(shí)計(jì)時(shí)。
1.3 取樣過(guò)程
取樣過(guò)程分為兩個(gè)步驟: 反應(yīng)液pH值測(cè)定和取樣。在測(cè)定反應(yīng)液的pH值后, 開(kāi)始取樣。反應(yīng)器口部插有取樣管, 以便于注射器抽取樣品。為盡量降低器材對(duì)樣品的影響, 取樣前用反應(yīng)液潤(rùn)洗注射器。取潔凈的注射器連接取樣管, 先抽取 3~5 mL反應(yīng)液,然后取下注射器, 在注射器上加過(guò)濾頭。用取出的3~5 mL反應(yīng)液先潤(rùn)洗注射器, 然后將其過(guò)濾到樣品瓶中, 潤(rùn)洗樣品瓶。用潤(rùn)洗后的注射器取25~30 mL樣品, 過(guò)濾到經(jīng)過(guò)潤(rùn)洗的樣品瓶中, 密封保存在冰箱中, 用于以后的總堿度(AT)和[Ca2+]的測(cè)定。在取樣品的過(guò)程中要避免注射器吸入氣泡, 因過(guò)濾反應(yīng)液時(shí)需要加壓, 而氣泡中存在的 CO2會(huì)在壓力增大時(shí)加速文石或方解石晶體的溶解, 增加樣品的AT值,引入誤差。隨著溶解過(guò)程的進(jìn)行, 順序取樣。
1.4 樣品分析測(cè)試
利用電位滴定儀(萬(wàn)通798MPT Titrino)測(cè)定樣品AT以及反應(yīng)液的初始鈣離子濃度([Ca2+]0)[16]。AT測(cè)定單個(gè)樣品用量約25 mL, 相對(duì)標(biāo)準(zhǔn)偏差低于0.10%,即±2 μmol/kg; [Ca2+]測(cè)定單個(gè)樣品用量1 mL, 相對(duì)標(biāo)準(zhǔn)偏差低于 0.25%, 即±26 μmol/kg, 有時(shí)可達(dá)到0.10%, 即±10 μmol/kg。
2 數(shù)據(jù)的處理
2.1 碳酸體系參數(shù)的計(jì)算
研究海洋碳酸鹽體系時(shí)要涉及4個(gè)參數(shù): pH值,AT, 溶解無(wú)機(jī)碳的濃度(DIC)和p(CO2), 利用其中兩個(gè)參數(shù)可以計(jì)算另外兩個(gè)參數(shù)。本研究測(cè)定的參數(shù)有 pH值、AT以及[Ca2+]0。海水堿度可以分為AT和碳酸鹽堿度(Ac)。AT是指1 000g樣品中, 氫離子接受體(當(dāng)溫度為 25℃時(shí),離子力強(qiáng)度為0, 解離常數(shù)K≤10-4.5的弱酸解離形成的堿)超過(guò)氫離子給予體(K≥10-4.5的酸)的氫離子摩爾當(dāng)量中和酸的能力[17], 可表示為:
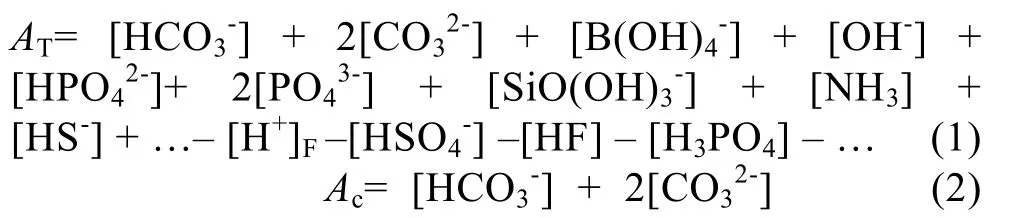
AT和Ac的單位均為 mmol/kg, “[ ]”代表溶液中某種離子的總濃度, [H+]F代表自由氫離子濃度, 省略號(hào)代表其他種類的酸或堿, 因?yàn)榱亢苌? 可以忽略。在開(kāi)闊海洋中 NH3和 HS-的濃度很低, 可以被忽略,但在還原環(huán)境的水體中, 則不能忽略其濃度[17]。
碳酸鹽堿度值(Ac)由AT值和pH值計(jì)算得出, 反應(yīng)過(guò)程中的鈣離子濃度([Ca2+]t)由AT和[Ca2+]0依據(jù)(3)式[18]計(jì)算得出:
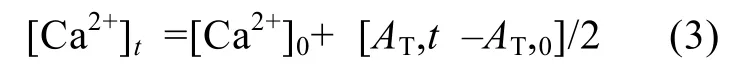
2.2 碳酸鹽堿度值隨時(shí)間變化曲線的模擬
本實(shí)驗(yàn)中,Ac隨時(shí)間變化曲線的擬合采用Gehlen等[19]運(yùn)用的經(jīng)驗(yàn)方程:
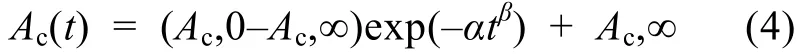
擬合文石或方解石在沉淀過(guò)程中Ac隨時(shí)間t變化的曲線
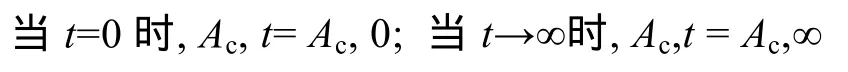
α和β為自由常數(shù), 它們由最小化方差和(minimizing the sum of squared residuals (least squares estimation))得出。Ac相對(duì)于時(shí)間變化的曲線的斜率代表沉淀速率。
碳酸鹽的沉淀速率及動(dòng)力學(xué)方程可以表示為:
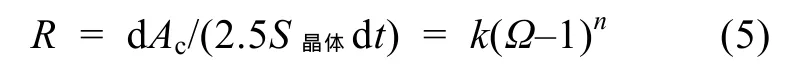
公式(5)中“2.5S晶體”表示單位質(zhì)量人工海水中加入晶體粉末的表面積(m2),R為沉淀速率(mmol/(m2·min)),即每分鐘每平方米晶體表面積所沉淀的Ac,?為反應(yīng)液的飽和度,?=[Ca2+]×[CO32?]/Ksp, [Ca2+]由(3)式得出 , [CO32?]=Ac/(10^(9–pH)×0.8909+2), 單 位 均 為mmol/kg,Ksp為方解石或文石的溶度積常數(shù), 單位為mmol2/kg2, 在常壓及 25.0℃時(shí), 對(duì)于方解石Ksp=0.439 mmol2/kg2, 對(duì)于文石Ksp=0.665 mmol2/kg2[20]。晶體每年的質(zhì)量沉淀速率Ra可表示為:
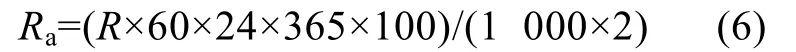
方解石和文石每年的質(zhì)量沉淀速率Ra方解石和Ra文石可以分別表示為
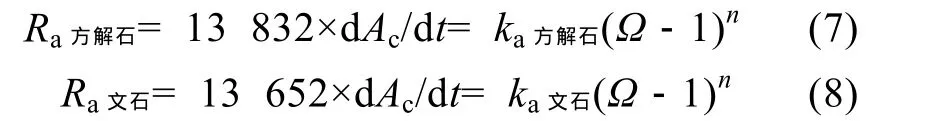
ka方解石和ka文石分別為方解石和文石的沉淀速率常數(shù)(g/(m2·a)),n為反應(yīng)的級(jí)數(shù), 沉淀過(guò)程的動(dòng)力學(xué)方程可由對(duì)數(shù)形式表示為:
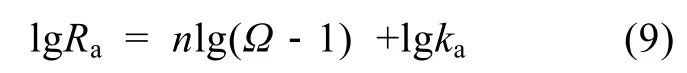
因需對(duì)Ac隨時(shí)間的變化進(jìn)行曲線擬合, 故樣品點(diǎn)越多擬合效果越好。但由于受到反應(yīng)容器體積(~660 mL)以及每次AT檢測(cè)用量(~30 mL)的限制, 樣品數(shù)保持在9~13個(gè)左右。順序取樣, 樣品的取樣間隔隨實(shí)驗(yàn)的進(jìn)行而增長(zhǎng)。沉淀實(shí)驗(yàn)開(kāi)始時(shí),AT變化相對(duì)較快, 取樣間隔相對(duì)較短, 隨著反應(yīng)向沉淀平衡的接近,AT變化也越來(lái)越慢, 為了能更好的檢測(cè)相鄰兩個(gè)樣品間AT的變化, 取樣時(shí)間間隔隨之增長(zhǎng)。
3 結(jié)果與分析
3.1 沉淀實(shí)驗(yàn)
方解石和文石的沉淀實(shí)驗(yàn)是在 25℃、反應(yīng)液p(CO2)恒定且?較低時(shí)進(jìn)行的。表1列出了每組實(shí)驗(yàn)的p(CO2)、?區(qū)間及實(shí)驗(yàn)用時(shí)。
在文石、方解石的沉淀實(shí)驗(yàn)中,Ac隨?的變化見(jiàn)圖 2。圖中標(biāo)示出了每組實(shí)驗(yàn)所用的晶體類型及p(CO2), 在每組實(shí)驗(yàn)中反應(yīng)液p(CO2)保持恒定。由于碳酸鹽的沉淀是一個(gè)放氣過(guò)程, 實(shí)驗(yàn)中p(CO2)能很好地維持平衡, 固Ac和?之間存在良好的線性關(guān)系。
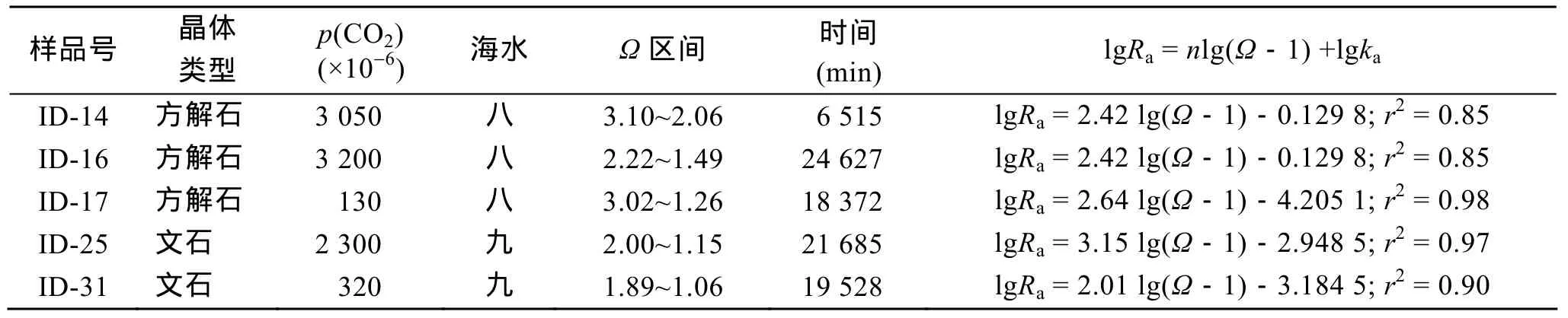
表1 沉淀實(shí)驗(yàn)參數(shù)表及動(dòng)力學(xué)方程Tab. 1 Precipitation parameters and kinetic equations
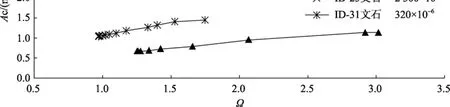
圖2 p(CO2)恒定時(shí), 近沉淀平衡處Ac隨?的變化Fig. 2 Variation ofAcwith?near precipitation equilibrium at constantp(CO2)
3.2 p(CO2)對(duì)Ra的影響
p(CO2)對(duì)Ra的影響表現(xiàn)在兩個(gè)方面: 一是在相同的Ac條件下,p(CO2)對(duì)Ra的影響; 二是在相同的?條件下,p(CO2)對(duì)Ra的影響。從圖3可以看出, 在相同的Ac條件下,p(CO2)越低, 方解石或文石的沉淀速率越高。依據(jù)此認(rèn)識(shí), 可以分析沉積物早成巖作用中的方解石的膠結(jié)速率, 即當(dāng)沉積物孔隙水Ac不變時(shí),孔隙水p(CO2)越低, 沉淀速率越大; 當(dāng)沉積物孔隙水p(CO2)不變時(shí), 孔隙水Ac越高沉淀速率越大。Mucci[21]研究了海底沉積物上部35 cm碳酸鹽的溶解和沉淀作用, 認(rèn)為在沉積物表層的 2 cm, 由于沉積物中有機(jī)質(zhì)受孔隙水中所溶解 O2的氧化, 造成p(CO2)升高, 導(dǎo)致碳酸鈣的溶解。隨著深度的加大,O2消耗殆盡, 孔隙水由氧化環(huán)境變?yōu)榱蛩猁}還原環(huán)境, 造成孔隙水Ac增大, 發(fā)生碳酸鹽的沉淀, 且硫酸鹽還原產(chǎn)生的Ac速率越快, 碳酸鹽的沉淀速率也就越快。
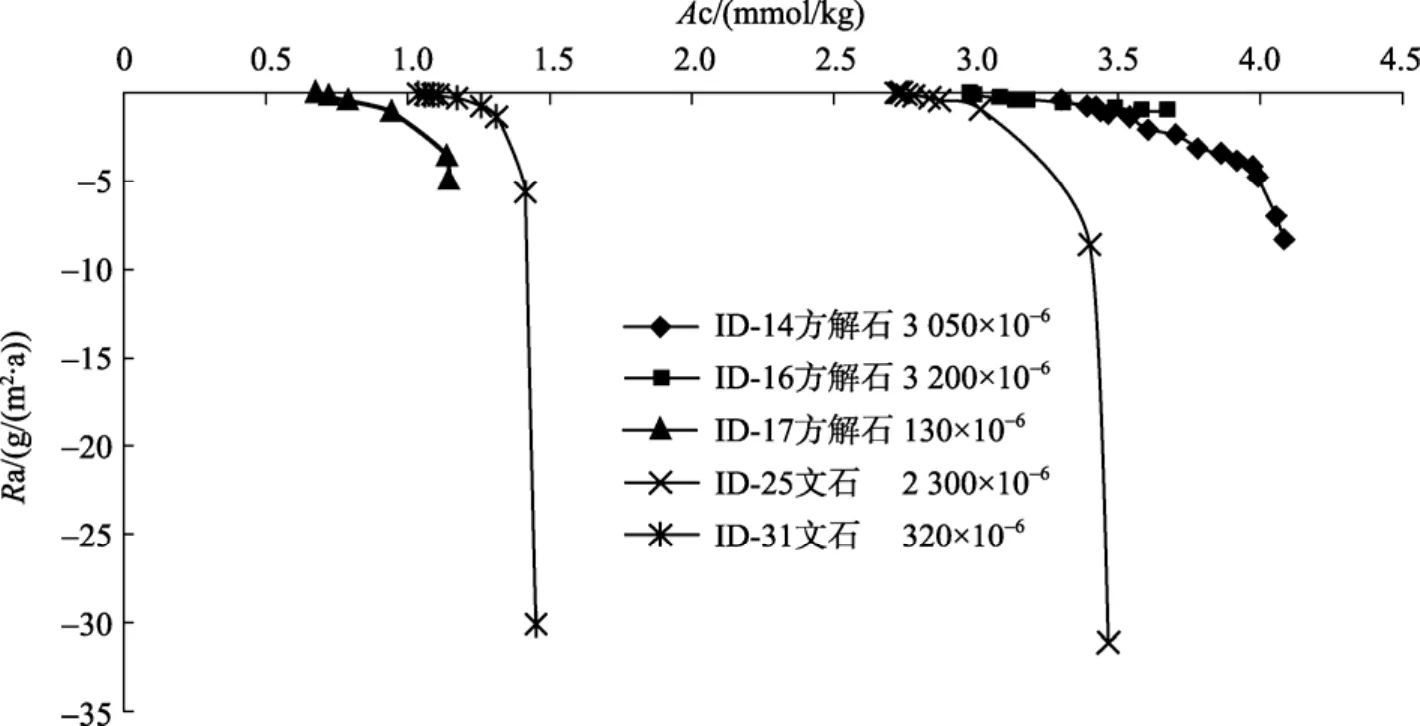
圖3 p(CO2)恒定時(shí), 近沉淀平衡處Ra隨Ac的變化Fig. 3 Variation ofRawithAcnear precipitation equilibrium at constantp(CO2)
本文利用“free drift”系統(tǒng)在不同p(CO2)環(huán)境下進(jìn)行了三組方解石的沉淀實(shí)驗(yàn)(ID-14, ID-16和ID-17)(圖 4),?相同時(shí),Ra非常相近。Lopez[3]、Zhong[4]和 Mucc[5]利用“constant addition”系統(tǒng)在不同p(CO2)環(huán)境下得到的沉淀數(shù)據(jù)(Zhong[4]和Mucci[5]的沉淀速率是根據(jù)其沉淀動(dòng)力學(xué)方程計(jì)算得出)和本實(shí)驗(yàn)得到的數(shù)據(jù)具有較好的吻合性(表2), 即驗(yàn)證了“free drift”系統(tǒng)的 可 靠 性 , 同 時(shí) 說(shuō) 明 了 在 130×10?6<p(CO2)<3 200×10?6、1<?<3 范圍內(nèi),?一定時(shí),Ra相同或相近。Lebrón[12]在p(CO2)分 別 為 350×10?6, 5 000×10?6,10 000×10?6,?為2~10的范圍為進(jìn)行了沉淀實(shí)驗(yàn)。依據(jù)其實(shí)驗(yàn)數(shù)據(jù), 當(dāng)?>4時(shí), 在相同的?條件下方解石的Ra隨p(CO2)的升高而增大, 但在 1<?<3范圍內(nèi),?一定時(shí), 并不能顯示出p(CO2)的變化對(duì)Ra的影響。
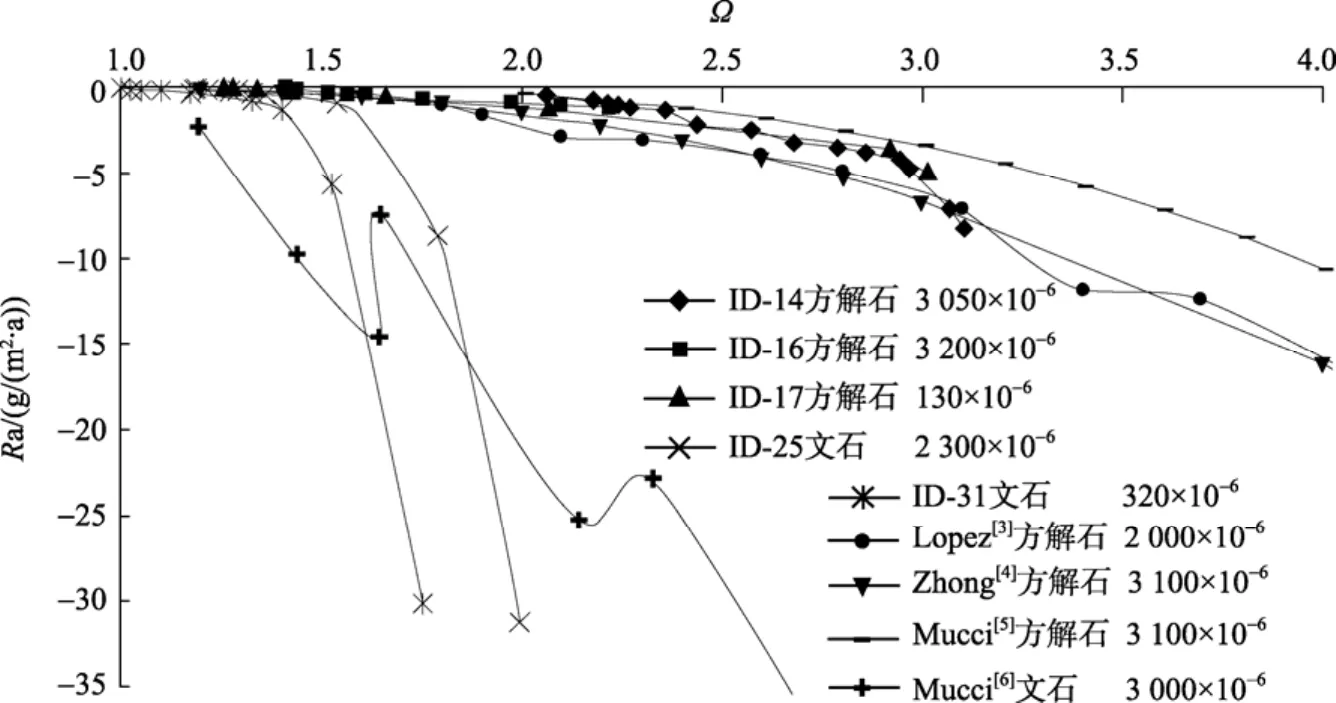
圖4 25℃、p(CO2)恒定時(shí), 近沉淀平衡處Ra和?關(guān)系圖Fig. 4 Relationship betweenRaand?near precipitation equilibrium at constantp(CO2)at 25℃
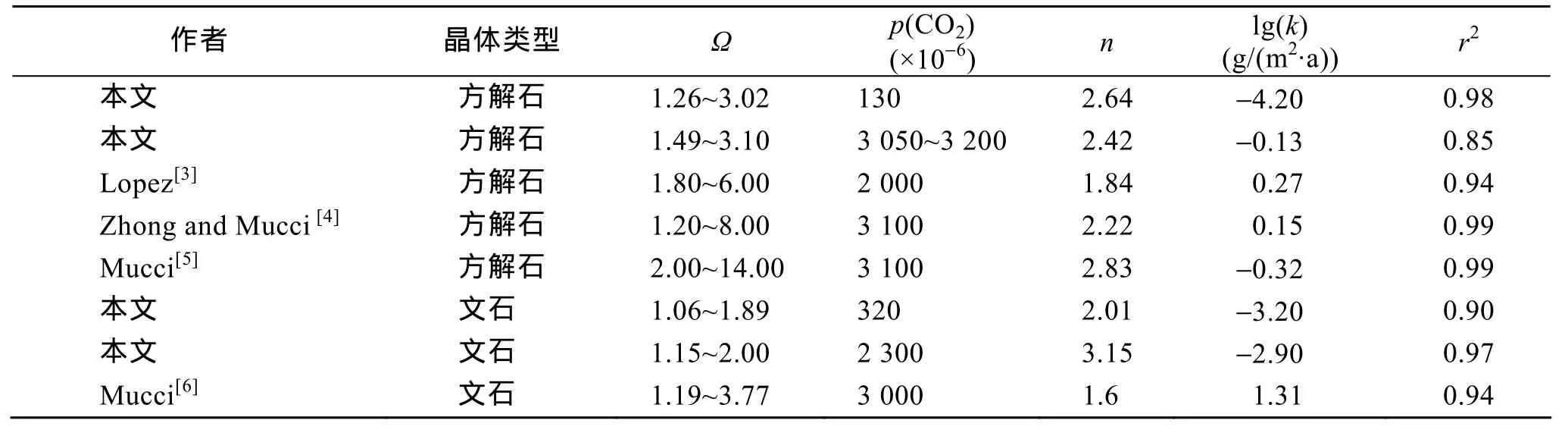
表2 25℃時(shí)海水中方解石和文石沉淀實(shí)驗(yàn)參數(shù)表Tab. 2 Precipitation experiment parameters for calcite and aragonite in seawater at 25℃
對(duì)于文石, 本實(shí)驗(yàn)得到的數(shù)據(jù)顯示, 當(dāng)?相同時(shí),p(CO2)越小Ra越大。?<2時(shí), 本實(shí)驗(yàn)得到的數(shù)據(jù)與 Mucci[6]在p(CO2)=3 100×10?6環(huán)境下得到的文石的Ra存在交叉現(xiàn)象, 因此p(CO2)變化對(duì)文石Ra的影響還需進(jìn)一步研究。但是, 當(dāng)?相同時(shí), 文石的Ra要高于方解石這一趨勢(shì)很明顯。
把文石沉淀過(guò)程中的?換算成相對(duì)于方解石的飽和度(?c)(圖 5), 從圖 5中可以看出, 當(dāng)?c>2.5時(shí),Ra文石>Ra方解石, 當(dāng) 1<?c<2.5 時(shí),Ra文石<Ra方解石。這也許能夠解釋, 為何現(xiàn)代淺海(?c約為 5~6)碳酸鹽沉積物以文石為主, 而海底沉積物中的自生碳酸鈣礦物主要為方解石(海底表層沉積物孔隙水1<?c<2.5 Mucci[21]), 但此設(shè)想還需進(jìn)一步求證。
3.3 沉淀動(dòng)力學(xué)方程
根據(jù)公式(8)做Ra和??1之間對(duì)數(shù)關(guān)系圖(圖6)得到的沉淀動(dòng)力學(xué)方程見(jiàn)表1。其中, ID-14和ID-16均是方解石的沉淀實(shí)驗(yàn), 且p(CO2)非常相近,(p(CO2)ID-14=3 050×10?6,p(CO2)ID-16= 3 200×10?6),故把這兩組實(shí)驗(yàn)數(shù)據(jù)作為一組進(jìn)行處理。本實(shí)驗(yàn)利用“free drift”得到的方解石沉淀反應(yīng)級(jí)數(shù)為 2.4~2.6,這與 Zhong[4]和 Mucci[5]利用“constant addition”系統(tǒng)在相同溫度條件下得到的反應(yīng)級(jí)數(shù)類似, 且可以看出 在 1<?<3 范 圍 內(nèi) ,p(CO2)的 變 化 (130×10?6~3 200×10?6)對(duì)方解石沉淀反應(yīng)級(jí)數(shù)影響不明顯。而文石在p(CO2)分別為 2 300×10?6和 320×10?6的環(huán)境下的沉淀反應(yīng)級(jí)數(shù)分別為3.2和2.0, 這與Mucci[6]得到的反應(yīng)級(jí)數(shù)1.6有一定的差別(表2)。
4 結(jié)語(yǔ)
本文較系統(tǒng)地研究了不同p(CO2)環(huán)境下, 近沉淀平衡狀態(tài)時(shí)人工海水中文石和方解石的沉淀動(dòng)力學(xué)過(guò)程, 得到了不同p(CO2)環(huán)境下, 方解石和文石的Ra及動(dòng)力學(xué)方程。由方解石和文石的沉淀數(shù)據(jù)可知: (1)晶體類型、Ac都相同時(shí),p(CO2)越低Ra越大; (2)近沉淀平衡時(shí), 如果?恒定,p(CO2)的變化對(duì)方解石的Ra無(wú)明顯的影響; (3) 1<?c<2.5 時(shí),Ra文石<Ra方解石;?c>2.5 時(shí),Ra文石>Ra方解石; (4) 對(duì)于方解石, 當(dāng)p(CO2)介于 3 050×10?6~3 200×10?6之間, 且 1.5<?<3.1 時(shí),n=2.4; 當(dāng)p(CO2)≈130×10?6, 且 1.2<?<3.0 時(shí),n=2.6。對(duì)于文石, 當(dāng)p(CO2)≈2 300×10?6, 1.1<?<2.0 時(shí),n=3.2; 當(dāng)p(CO2)≈320×10?6, 1.1<?<1.9 時(shí),n=2.0。
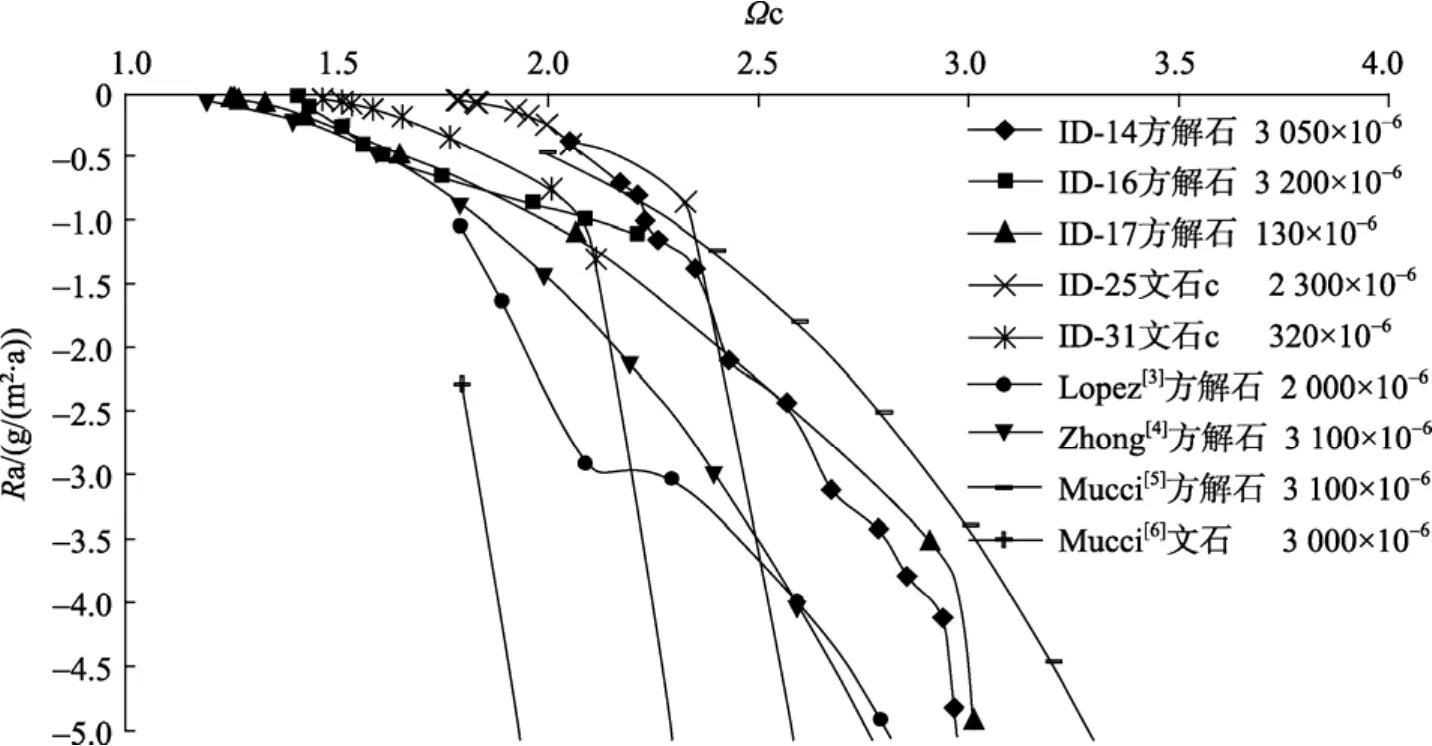
圖5 25℃、p(CO2)恒定時(shí), 近沉淀平衡處Ra和方解石飽和度?c關(guān)系圖Fig. 5 Relationship betweenRaand?near precipitation equilibrium at constantp(CO2) at 25℃
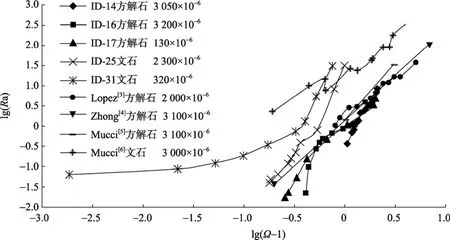
圖6 p(CO2)恒定時(shí), 近沉淀平衡處Ra和??1對(duì)數(shù)關(guān)系圖Fig. 6 Logarithmic relationship between??1 andRanear precipitation equilibrium at constantp(CO2)
[1] K?rtzinger A, Mintrop L, Wallace D W R, et al. The international at-sea intercomparison offCO2systems during the R/V Meteor cruise 36/1 in the North Atlantic Ocean [J]. Marine Chemistry, 2000, 72(2-4): 171-192.
[2] Sabine C L, Feely R A, Gruber N, et al. The oceanic sink for anthropogenic CO2[J]. Science, 2004,305(5682): 367-371.
[3] Lopez O, Zuddas P, Faivre D. The in fl uence of temperature and seawater composition on calcite crystal growth mechanisms and kinetics: Implications for Mg incorporation in calcite lattice [J]. Geochimica et Cosmochimica Acta , 2009, 73(2): 337–347.
[4] Zhong Shaojun, Mucci A. Calcite precipitation in seawater using a constant addition technique: A new overall reaction kinetic expression [J]. Geochimica et Cosmochimica Acta, 1993, 57(7): 1 409-1 417.
[5] Mucci A. Growth kinetics and composition of magnesian calcite overgrowths precipitated from seawater: Quantitative influence of orthophosphate ions[J]. Geochimica et Cosmochimica Acta, 1986, 50(10):2 255-2 265.
[6] Mucci A, Canuel R, Zhong Shaojun. The solubility of calcite and aragonite in sulfate-free seawater and the seeded growth kinetics and composition of the precipitates at 25°C[J]. Chemical Geology, 1989,74(3-4): 309-320.
[7] Kralj D, Vdovi N. The influence of some naturally occurring minerals on the precipitation of calcium carbonate polymorphs [J]. Water Research, 2000, 34(1):179-184.
[8] Lin Yipin, Singer P C. Effects of seed material and solution composition on calcite precipitation [J].Geochimica et Cosmochimica Acta, 2005, 69(18):4 495-4 504.
[9] Morse J W. The kinetics of calcium carbonate dissolution and precipitation [J]. Reviews in Mineralogy and Geochemistry, 1983, 11(1): 227–264.
[10] Plummer L N, Parkhurst D L, Wigley T M L. Critical review of the kinetics of calcite dissolution and precipitation [A]. Jenne E A. Chemical modeling in aqueous systems, American Chemical Society Symposium Series 93 [C]. Washington D C: Oxford University Press, 1979. 537–573.
[11] Wray J L, Daniels S F. Precipitation of calcite and aragonite [J]. Journal of the American Chemical Society,1957, 79(9): 2 031-2 034.
[12] Lebrón I, Suárez D L. Kinetics and mechanisms of precipitation of calcite as affected bypCO2and organic ligands at 25℃ [J]. Geochimica et Cosmochimica Acta,1998, 62(3): 405-416.
[13] Kester D R, Duedall I W, Connors D N, et al. Preparation of artificial seawater [J]. Limnology and Oceanography, 1967, 12(1): 176-179.
[14] de Kanel J, Morse J W. A simple technique for surface area determination [J]. Journal of Physics E: Scientific Instruments, 1979, 12(4): 272-273.
[15] DOE. Handbook of methods for the analysis of the various parameters of the carbon dioxide system in seawater (version 2) [R]. Oak Ridge, Tennessee:Carbon Dioxide Information Analysis Center, Oak Ridge National Laboratory, US Department of Energy, 1994.
[16] Tao Xiaowan, PU Xiaoqiang, NI Yunyan, et al. Determination of total alkalinity and calcium concentration of seawater rapidly and automaticly with small-amount samples [EB/OL]. 2009-07-14. http://ieeexplore.ieee.org/xpl/freeabs_all.jsp?arnumber=5162628
[17] Dickson A G. An exact definition of total alkalinity and a procedure for the estimation of alkalinity and total inorganic carbon from titration data [J]. Deep-Sea Research I, 1981, 28(6): 609–623.
[18] Dickson A G, Afghan J D, Anderson G C. Reference materials for oceanic CO2analysis: a method for the certification of total alkalinity [J]. Marine Chemistry,2003, 80(2-3): 185–197.
[19] Gehlen M, Bassinot F C, Chou L, et al. Reassessing the dissolution of marine carbonates: II. Reaction kinetics[J]. Deep-Sea Research I, 2005, 52(8): 1 461–1 476.
[20] Plummer L N, Wigley T M L, Parkhurst D L. The kinetics of calcite dissolution in CO2-water systems at 5 degrees 60 degrees and 0.0 to 1.0 atm CO2[J].American Journal of Scince, 1978, 278: 179-216.
[21] Mucci A, Sundby B, Gehlen M, et al. The fate of carbon in continental shelf sediments of eastern Canada: a case study [J]. Deep-Sea Research II, 2000, 47(3-4): 733-760.
Received: Jun., 26, 2009
Key words:artifical seawater; calcite; aragonite; precipitation; saturation state; carbonate alkalinity; reaction order
Abstract:The influence of carbon doxide partial pressure (p(CO2)) in seawater on the precipitation rates and kinetics of calcite and aragonite was studied using “freedrift” open reaction system at constant temperature(25.0℃±0.2℃) andp(CO2). The precipitation rates were measured under differentp(CO2). We found that: (1) the precipitation rate of aragonite was higher than that of calcite, and the lower thep(CO2)was, the higher the precipitation rate was at the same saturation state (?) and constantp(CO2); (2) as for calcite, the reaction order was 2.4 whenp(CO2) was fluctuating between 3 050×10?6~3 200×10?6and 1.5<?<3.1, and was 2.6 whenp(CO2)≈130×10?6and 1.2<?<3.0; as for aragonite, the reaction order was 3.2 whenp(CO2)≈2 300×10?6and 1.1<?<2.0 , and was 2.0 whenp(CO2)≈320×10?6and 1.1<?<1.9. Results of this study have deepened the understanding of the precipitation mechanisms of calcite and aragonite under different sedimentary conditions. In addition, the different precipitation rates of calcite and aragonite under different calcite saturation (?c) provide an explanation of why aragonite dominates the carbonate sediments in modern shallow sea while the main authigenic carbonate mineral in marine sediments is calcite.
(本文編輯:劉珊珊)
Precipitation rates and kinetics of calcite and aragonite in seawater near equilibrium
TAO Xiao-wan1, PU Xiao-qiang2
(1. Research Institute of Petroleum Exploration & Development, Petro China, Beijing, 100083, China; 2.Engineering College, Guangdong Ocean University, Zhanjiang 524088, China)
P736.4
A
1000-3096(2011)02-0064-08
2009-06-26;
2010-12-10
國(guó)家自然科學(xué)基金(40376038)
陶小晚(1981-), 男, 河北石家莊人, 博士, 研究方向?yàn)榈厍蚧瘜W(xué), 電話: 010-83597498, E-mail: taoxiaowan@petrochina.com.cn

