血清雌孕激素及輸卵管組織白血病抑制因子及其受體表達與輸卵管妊娠的關系
李 詠,趙丹梅,歐陽俊,向 梅,馬文琴,吳超英,史文忠,唐正華
(南京醫科大學附屬常州市婦幼保健院,1.普婦科,2病理科,江蘇常州,213003)
在正常月經周期中,輸卵管的腺上皮和子宮內膜一樣在雌孕激素的作用下會發生周期性變化。在子宮內膜的種植窗期,有許多因子和激素參與胚胎的種植,其中雌二醇(E2)和孕酮(P)是胚胎植入過程中起主導作用的激素。而輸卵管妊娠的發病機制目前還未明確。本實驗研究E2、P和白血病抑制因子(LIF)及其受體(LIFR)與輸卵管妊娠(TP)的關系,以揭示發生輸卵管妊娠的分子水平機制。
1 實驗方法和評價指標
1.1 病例選擇
從2008年至2010年在江蘇省常州市婦幼保健院收集了57例病例,其中非孕組:健康的未孕婦女(對照組)11例,年齡 16~46歲,平均(39.3±8.5)歲,均自愿行絕育手術;宮內妊娠組:正常的宮內妊娠(NIUP)12例,27~40歲,平均(34.5±4.1)歲,均自愿行人工流產或者孕足月剖宮產時絕育,既往均無自然流產、異位妊娠或激素治療史;TP組:輸卵管妊娠(TP)者 36例,22~43歲,平均(33.9±5.6)歲,每例患者均經手術和病理切片檢驗證實,術前均未行藥物保守治療。3組均選用種植部位的組織切片,種植部位的組織切片評定標準為:①有錨定絨毛移行穿入輸卵管筋膜層;②有與錨定絨毛穿入相連的正常輸卵管勃膜上皮。同時收集32例正常宮內孕孕婦[孕25~57 d,平均(42±1.6)d]、40例異位妊娠孕婦[孕35~72 d,平均(49.9±1.5)d]血清以檢測E2、P(兩者孕周差異無統計學意義,P>0.05)。所有患者均簽署知情同意書并且通過本院倫理委員會批準。各組年齡差異無統計學意義(P>0.05)。
1.2 標本來源
①外周血的獲取:于手術當天抽取空腹肘靜脈血3 mL,分離血清,檢測E2、P。②3組婦女輸卵管組織均在手術時(輸卵管妊娠手術和輸卵管結扎手術)收集,生理鹽水沖洗后,10%甲醛固定,石蠟包埋,切片(4 μ m),以備免疫組化分析。
1.3 實驗試劑
雌二醇和孕酮診斷試劑盒(德國羅氏診斷產品有限公司);羊抗人LIF多克隆抗體[LIF(N-18):Sc-1336]和兔抗人LIFR多克隆抗體[LIFR(C-19):Sc-659](美國 Santa Cruz公司);過氧化物酶標記的鏈酶卵白索(SP)染色試劑盒(北京中杉金橋生物技術有限公司)。
1.4 實驗方法
①采用電化學發光法檢測患者外周血血清E2、P;②免疫組化半定量分析(IRS):采用鏈霉素親和素-生物素復合物方法(SABC)。陰性對照均采用磷酸緩沖液(PBC)代替一抗,嚴格按試劑盒說明書操作。
1.5 評價指標
免疫組化結果判定綜合考慮切片中陽性細胞占所觀察同類的細胞數的百分比和陽性細胞著色強度兩項指標,半定量判定結果。①根據顯色程度判斷陽性程度:標本無色為0分,淡黃色1分,棕黃色2分,棕褐色3分;②根據陽性細胞在觀察細胞中所占的比例:陽性細胞數≤10%為1分,陽性細胞數11%~50%為2分,陽性細胞數51%~75%為3分,陽性細胞數>75%為4分。
2 結 果
2.1 宮內妊娠組和輸卵管妊娠組血清E2、P比較
用電化學發光法檢測32例正常宮內孕組、40例異位妊娠組血清E2、P,結果顯示輸卵管異位妊娠組血清E2低于正常宮內妊娠組,差異有統計學意義(P<0.05,圖1A);輸卵管異位妊娠組血清P低于正常宮內妊娠組,差異有統計學意義(P<0.01,圖1B)。
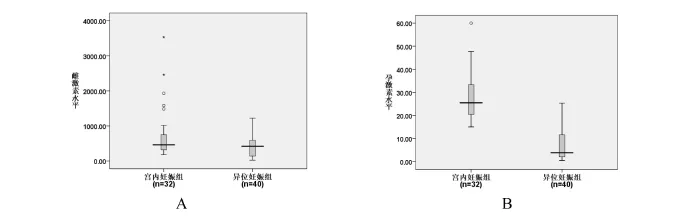
圖1 電化學發光法檢測正常早期宮內妊娠組和輸卵管異位妊娠組雌二醇和孕酮的差異
2.2 免疫組化檢測LIF和LIFR在正常對照組、宮內妊娠組及異位妊娠組輸卵管組織的表達率和定位
免疫組化檢測11例非孕組、12例宮內妊娠組及36例異位妊娠組其輸卵管組織LIF和LIFR的表達。結果顯示,LIF和LIFR在輸卵管腺上皮細胞表達較強,在間質細胞表達較弱,且主要定位于腺上皮細胞胞漿(圖2)。
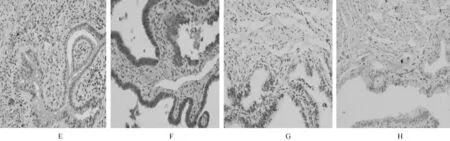
圖2 LIF和LIFR在輸卵管組織LIF和LIFR陽性表達SP法 (400倍)
2.3 半定量分析LIF和LIFR在正常對照組、宮內妊娠組及異位妊娠組輸卵管組織的表達差異
半定量分析發現,雖然LIF在異位妊娠組的表達略高于正常對照組和宮內妊娠組,但各組間差異無統計學意義(圖3A,P>0.05);LIFR在異位妊娠組的表達明顯高于前兩組,差異有統計學意義(圖3B,P<0.05),正常對照組和宮內妊娠組間無明顯差異(圖3B,P>0.05);但是在間質中,LIFR的表達在輸卵管妊娠組明顯低于其他兩組(P<0.01),而非孕組和宮內妊娠組上皮間其表達無明顯差異(圖3C,P>0.05)。

圖3 半定量分析LIF和 LIFR在各組輸卵管組織的表達差異
2.4 血清E2、P與輸卵管 LIF、LIFR相關性分析
分析表明輸卵管妊娠時血清E2與輸卵管腺上皮和間質LIFR均有顯著相關性。血清E2與腺上皮LIFR之間正相關(r=0.354,P<0.05),血清E2與間質LIFR之間負相關(r=-0.397,P<0.01);而血清P與輸卵管妊娠腺上皮和間質的LIF、LIFR的表達無顯著相關性;血清E2與腺上皮和間質的LIF表達無顯著相關性。
3 討 論
95%的異位妊娠發生在輸卵管,雖然輸卵管炎癥、局部解剖結構的改變是發病的主要原因,但是55%的輸卵管妊娠患者經肉眼檢查輸卵管是正常的,因此異位種植的基礎分子機制仍不明確[1]。本研究應用免疫組化方法檢測LIF及其受體LIFR在輸卵管中的表達,檢測患者血清E2、P,探討血清 E2、P與 LIF及LIFR與TP的關系。
在雌激素的作用下,輸卵管黏膜上皮纖毛細胞生長,體積增大,雌激素還促進輸卵管發育及輸卵管肌層節律性收縮的振幅。而孕激素則能增加輸卵管的收縮速度,減少輸卵管的收縮頻率、振幅。雌、孕激素的協調作用,使輸卵管上皮適應月經周期變化并保證宮內受孕的成功[2]。排卵后子宮內膜隨之發生的復雜改變,依賴于體內包括甾體激素在內的多種因素的調節,最終使內膜與胚胎發育同步化,以利于胚泡著床和進一步發育[3-4]。Pulkkinen等[5]對輸卵管肌層電生理進行研究,發現低孕酮水平下,輸卵管呈現功能障礙的特征。這些基本特征包括:①輸卵管傘端傾向子宮的肌電活動低下,向子宮的推進力較弱,可導致不孕或宮外孕(不過在運輸卵子方面傘端黏膜纖毛的擺動可能比肌層的機械作用扮演更重要的角色);②輸卵管肌電爆發波的產生率低(推進力弱);③無推進作用的正弦波和靜止波的發生率高,不能維持良好的輸卵管機械推進力,可致卵子、受精卵停留。這一研究結果與一些學者的流行病學發現相吻合,即黃體功能低下與高異位妊娠發病率之間有一定關聯。他們研究發現[5],異位妊娠患者外周血孕激素水平普遍較正常妊娠者為低,兩者共同作用使得輸卵管蠕動異常,受精卵容易在此發生滯留。這些資料揭示,血清低孕酮水平,輸卵管局部肌層孕激素受體含量低下,使輸卵管輸送受精卵功能障礙,導致桑葚胚異位植入,是輸卵管妊娠的可能因素。我們的研究也提示異位妊娠組的血清E2、P明顯低于正常宮內妊娠組(P<0.05,P<0.01)。異位妊娠患者體內雌二醇和孕酮水平低,導致輸卵管平滑肌收縮節律下降、纖毛向宮腔方向擺動減慢、輸卵管峽部無法放松,孕卵運行受阻,使胚泡異位種植。
胚胎著床是一種復雜的生理過程,同時受諸多因素調節。其中 LIF是一種多功能多生物學性細胞因子,LIF表達峰值與著床窗時間一致,是著床的關鍵因子[6]。一些研究表明[7],LIF對妊娠的維持有重要作用。LIF可以啟動胚泡著床和促進胚泡的發育,且其作用呈時間和劑量依賴關系。
LIF是Tomida等[8]在1984年首次從白血病細胞中分離鑒定的,已證實LIF的異常表達與多種疾病密切相關,如異位妊娠、腫瘤等[9-10]。LIF受體復合物由一個低親和性受體(LIFR)及一個高親和性受體(gpl30)組成,LIFR還有LIFRα及LIFRβ兩條鏈。LIF先以較低親和力與受體α結合,然后與gpl30相互作用形成親和力高的復合物,二聚體形成后gpl30磷酸化,激活Janus酶,磷酸化下游的信號傳導子及轉錄激活子(stat)蛋白,從而進入核內激活下游轉錄因子,產生一系列的生物效應[11]。同時 LIF是唯一能夠激活體內stat3的因子,而一些相關因子如 IL-6、CNTF等雖共用LIFR及gp130受體,卻無此功能[12]。小鼠子宮內膜LIFR在分泌期及妊娠早期表達量高,而gpl30在妊娠早期(3~4 d)表達量最高。人LIFR及gpl30在整個月經周期內均表達,LIFR主要分布于子宮內膜腔上皮,gpl30則在腔上皮和腺上皮中均有發現[13]。這些結果顯示,表達于子宮內膜中的LIF及其受體于圍著床期表達升高,LIF可能通過某種途徑為子宮接受胚胎著床作好準備。作者的研究結果顯示LIF主要在輸卵腺上皮表達,間質幾乎不表達,這與Keltz等[14]的研究結果一致。
有趣的是,雖然作者的研究結果表明LIF在各組間無明顯差異,但是其受體LIFR在異位妊娠組輸卵管的腺上皮表達水平明顯高于宮內妊娠組和非孕組(P<0.05),而宮內妊娠組和非孕組間無明顯差異(P>0.05)。同時作者還發現在輸卵管間質LIFR表達在異位妊娠組明顯低于與宮內孕組和非孕組,差異有顯著統計學意義(P<0.01);宮內孕組略高于非孕組,但是兩者之間差異無統計學意義(P>0.05)。作者的實驗結果提示LIFR同樣存在于輸卵管的腺上皮和間質中,LIFR在異位妊娠組輸卵管腺上皮的表達水平明顯高于宮內妊娠組和非孕組,而宮內妊娠組和非孕組間無明顯差異。這些結果表明,宮內孕組和非孕組輸卵管間質LIFR高表達提示LIFR在正常狀態時為儲備狀態,而在輸卵管妊娠狀態時大量LIFR游離至輸卵管腺上皮,與LIF一起參與母胎界面生化反應。這說明,輸卵管組織 LIFR的異常表達可能與異位妊娠的發生密切相關。從一個側面也說明,異位妊娠的發生不僅需要LIF的表達,同時也需要LIFR的協同高表達。因此,本實驗證明LIF和LIFR是輸卵管妊娠植入的關鍵因子,同時檢測 LIF和LIFR的表達可能成為預測異位妊娠發生傾向性的一組潛在指標,比單獨檢測LIF更有臨床意義。
作者通過血清雌二醇、孕酮和LIF及其受體LIFR的相關性分析發現:輸卵管妊娠時血清E2與輸卵管腺上皮和間質的LIFR表達均有顯著相關性。血清E2與腺上皮LIFR之間正相關(r=0.354,P<0.05),血清E2與間質LIFR之間負相關(r=-0.397,P<0.01);而血清P與輸卵管妊娠腺上皮和間質的LIF、LIFR的表達無顯著相關性;血清E2與腺上皮和間質的LIF表達無顯著相關性。提示E2能上調輸卵管腺上皮的LIFR表達,下調輸卵管間質LIFR的表達。
[1]Salih S M,Taylor S H.HOXA10 gene expression in human fallopian tube and ectopic pregnancy[J].Am J Obstet Gynecol,2004,190(5):1404.
[2]樂 杰.婦產科學[M].北京:人民衛生出版社,2004:20.
[3]Bersing N A,Brandenberger A,Berger E,et al.Serum pregnancy-specificβ-glycoprotein before embryo transfer is related to endometrialthickness and to outcome prognosis in women undergoing in vitro fertilization treatment[J].Hum Reprod,1998,13(7):1962.
[4]Hambartsoumian E.Human endometria1 leukemiainhibitory factor(LIF)secretion and its relationship to sonographic endometrial appeaarance[J].Am J Reprod Immunol,1997,37(4):320.
[5]Pulkkinen M O,Jaakkola U M.Low serum progesterone levels and tubal dysfunction--a possible cause of ectopic pregnancy[J].Am J Obstet Gynecol,1989,161(4):934.
[6]Sherwin J R,Freeman T C,Stephens R J,et al.Identification of genes regulated by leukemia inhibitoty factor in the mouse uterus at the time of implantation[J].Mol Endocrinol,2004,18(9):2185.
[7]Mitchell M H,Swanson R J,Oehninger S.In vivo effecct of leukemia inhvicaibitory factor(LIF)and an anti-LIF polyclonal antibody on murine embryo and fetal development following exposure at the time of transcervical blastocyst transfer[J].Biol Reprod,2002,67(2):460.
[8]Tomida M,Yamamoto-Yamaguchi Y,Hozumi M.Purification of a factor inducing differentiation of mouse myeloid leukemic M1 cells from conditioned medium of mouse fibroblast L929 cells[J].J Biol Chem,1984,259:10978.
[9]Ji Y F,Chen L Y,Xu K H,et al.Locally elevated leukemia inhibitory factor in the inflamed fallopian tube resembles that found in tubal pregnancy[J].Fertil Steril,2009,91(6):2308.
[10]Shin J E,Park S H,Jang Y K.Epigenetic up-regulation of leukemia inhibitory factor(LIF)gene during the progression to breast cancer[J].Mol Cell,2011,31(2):181.
[11]Ernst M,Inglese M,Waring P,et al.Defective gp130-mediated signal transducer and activator of transcription(STAT)signalingResultsin degenerative joint disease,gastrointestinal ulceration,and failure of uterineimplantation[J].J Exp Med,2001,194(2):189.
[12]Sherer D M,Abulafia O.Angiogenesis during implantation,and placental and early embryonic development[J].Placenta,2001,22(1):1.
[13]Culinan E B,Abbondanzo S J,Anderson P S,et al.Leukemia inhibitory factor(LIF)and LIF receptor expression in human endometrium suggests a potentialautocrine/paracrine function in regulating embryo implantation[J].Proc Natl Acad Sci,1996,93(7):3115.
[14]Keltz M D,Attar E,Buradagunta S,et al.Modulation of leukemia inhibitory factor gene expression and protein biosynthesis in the human fallopian tube[J].Am J Obstet Gynecol,1996,175(6):1611.

