胱硫醚β-裂解酶的表達純化及性質研究
曹珊珊,牛衛寧,羊夢林,欽傳光
(西北工業大學生命學院,陜西 西安 710072)
同型半胱氨酸(Homocysteine,Hcy),又稱高半胱氨酸,是一種含巰基的氨基酸,是蛋氨酸和半胱氨酸代謝過程中的重要中間產物。研究表明,Hcy是導致心腦血管疾病、糖尿病以及神經系統疾病的危險因素[1],因此,快速準確檢測Hcy含量方法的建立,對基礎研究和臨床診斷都有非常重要的意義。
目前,同型半胱氨酸最主要的檢測方法包括高效液相色譜法、熒光偏振免疫法、毛細管電泳-質譜聯用法以及電化學法,這些檢測方法均存在測定程序復雜、耗時、樣品需要預處理以及測試儀器價格昂貴等弊端[2~5]。因此,本實驗室擬建立一種通過酶催化測定Hcy的方法,該方法具有快速、方便、靈敏、精確的特點。反應原理如下:Hcy和L-絲氨酸在胱硫醚β-合酶(Cystathionineβ-synthase,CBS)催化下生成L-胱硫醚(L-Cystathionine),L-胱硫醚又經過胱硫醚β-裂解酶(Cystathionineβ-lyase,CBL)催化生成丙酮酸,丙酮酸在堿性條件下與2,4-二硝基苯肼反應生成棕紅色產物,利用分光光度計在520 nm下測定吸光度值即可得到丙酮酸含量[6],從而計算出樣品中Hcy的濃度。
因此,大量表達和純化CBS和CBL并對其性質進行研究是建立酶催化法測定Hcy濃度的關鍵,本實驗室前期已經對CBS的表達、純化以及性質進行了系統研究。作者在此構建了高效表達CBL的重組菌E.coliBL21(pETDuet-1-CBL),一步親和層析純化得到CBL,并建立了一種新的CBL酶活性檢測方法,同時對重組CBL的酶學性質進行了研究,為酶催化測定Hcy方法的建立奠定了基礎。
1 實驗
1.1 材料
1.1.1 菌種和試劑
大腸桿菌E.coliK12、E.coliDH5α、E.coliBL21,自行保存。質粒pETDuet-1,Novagen公司;質粒DNA抽提試劑盒、DNA膠回收試劑盒,Omega公司;T4DNA連接酶、Taq DNA聚合酶和各種限制性內切酶、蛋白Marker,TaKaRa公司;L-胱硫醚標準品,Sigma公司;HisTrap Fast Flow(1 mL)預裝柱,GE公司;其余試劑均為國產或進口分析純。
1.1.2 培養基
LB培養基:0.5% 酵母粉,1%蛋白胨,1%氯化鈉,氨芐青霉素(Ampicillin)終濃度為50 μg·mL-1。
1.2 方法
1.2.1 重組菌E.coliBL21(pETDuet-1-CBL)的構建
以大腸桿菌E.coliK12的基因組DNA為模板,通過PCR擴增獲得CBL基因片段,上下游引物分別為:5′-CTCGGGATCCGCGGACAAAAAGCTTG-ATACTC-3′和5′-CAGTGCGGCCGCTACAATTCGCGCAAAACCGG-3′。
PCR 反應條件為:95 ℃ 變性5 min;95 ℃ 60 s,55 ℃退火45 s,72 ℃ 90 s,循環25次;72 ℃延伸10 min。然后用BamHI和NotI雙酶切經過膠回收的CBL基因和質粒pETDuet-1,連接酶切后片段構建重組質粒pETDuet-1-CBL,將重組質粒轉化到E.coliDH5α感受態細胞中進行測序,測序正確后將重組質粒轉化到E.coliBL21感受態細胞中,獲得重組菌E.coliBL21(pETDuet-1-CBL)。
1.2.2 重組CBL的表達
將培養過夜的重組大腸桿菌E.coliBL21(pETDuet-1-CBL)按1∶100比例接種到500 mL含有50 μg·mL-1氨芐青霉素的LB培養基中,37 ℃、180 r·min-1培養至菌液OD600值為0.4~0.6,加入終濃度為0.5 mmol·L-1的IPTG于30 ℃誘導9 h,使菌體生長達到穩定期,再于4 ℃、6000 r·min-1離心10 min,獲得的菌體懸浮洗滌后,離心收獲菌體備用。
1.2.3 重組CBL的純化
(1)粗提取
將上述離心收獲的菌體重懸于破碎緩沖溶液(含50 mmol·L-1NaH2PO4、20 mmol·L-1咪唑、300 mmol·L-1NaCl、5 mmol·L-1DTT、1 mmol·L-1PMSF、1 mmol·L-1鹽酸苯甲醚)中,在冰水浴中超聲波(300 W,超聲3 s,間隔8 s)處理1100 s破碎細胞,破碎液在4 ℃、12 000 r·min-1離心30 min,上清液即為粗酶液。
(2)HisTrap Fast Flow親和層析
將上述粗酶液加入到經平衡緩沖溶液(含50 mmol·L-1NaH2PO4、20 mmol·L-1咪唑、300 mmol·L-1NaCl、2 mmol·L-1DTT)預平衡的HisTrap Fast Flow(1 mL)柱,流速1 mL·min-1洗脫至基線,然后用洗脫緩沖溶液(含50 mmol·L-1NaH2PO4、250 mmol·L-1咪唑、2 mmol·L-1DTT)進行洗脫,收集產物峰。酶液加甘油至終濃度為5%,-20 ℃保存備用。
1.2.4 酶活性測定
設置酶的反應體系為500 μL,在5 mmol·L-1的L-胱硫醚底物溶液(0.1 mol·L-1K2HPO4溶液配制,pH 值7.4)中加入適量酶液,37 ℃水浴保溫20 min,然后煮沸2 min終止反應,在反應液中加入500 μL 1 mmol·L-1的2,4-二硝基苯肼和5 mL 0.4 mol·L-1的NaOH溶液,室溫下靜置30 min,在520 nm波長下測定吸光度值,以不加酶液的反應液為對照。以不同濃度的丙酮酸鈉標準溶液和2,4-二硝基苯肼反應,繪制丙酮酸鈉濃度和吸光度之間的標準曲線。
酶活力定義:在上述條件下,37 ℃、pH值7.4、1 h能催化產生1 μmol丙酮酸的酶量為1個酶活力單位(1 U)。
由于CBL能催化底物L-胱硫醚生成含有巰基的同型半胱氨酸,王偉偉[7]采用巰基檢測試劑5,5′-二硫代雙(2-硝基苯甲酸)來測定同型半胱氨酸的含量,從而測定CBL的活性。但研究發現該方法重復性較差,主要原因是產物同型半胱氨酸的巰基很容易被氧化從而影響測定結果,如果在反應體系中加入巰基保護試劑DTT和巰基乙醇等還原劑,還原劑中本身含有的巰基基團又會嚴重影響實驗結果。
1.2.5 蛋白質含量測定
采用Bradford法測定蛋白質含量。繪制牛血清白蛋白標準曲線。
1.2.6 SDS-PAGE分析
十二烷基磺酸鈉-聚丙烯酰胺凝膠電泳(SDS-PAGE)用于分析蛋白質的分子量,分離膠濃度為10%,染色使用考馬斯亮藍R-250。
1.2.7 重組CBL的酶學性質考察
(1)最適溫度及溫度穩定性:在含有5 mmol·L-1的L-胱硫醚反應液(50 mmol·L-1Tris-HCl,pH值8.0)中加入適量純化的CBL酶液,在不同反應溫度下測定酶活性,研究溫度對酶催化活性的影響。同時將酶液置于不同溫度下保溫5 h,測定剩余酶活性,研究該酶在不同溫度下的穩定性。
(2)最適pH值及pH值穩定性:配制pH值5.0~10.0的反應液(含5 mmol·L-1的L-胱硫醚),將一定量的酶液分別加入到不同pH值的反應液中,測定重組酶在不同pH值反應體系中的活性,研究pH值對酶催化活性的影響。在pH值5.0~10.0緩沖溶液中加入一定量的酶液,4 ℃下保溫10 h,測定剩余酶活性,研究該酶在不同pH值條件下的穩定性。
(3)動力學常數的測定:配制濃度分別為20 mmol·L-1、10 mmol·L-1、5 mmol·L-1、2.5 mmol·L-1、1.25 mmol·L-1、0.625 mmol·L-1的L-胱硫醚溶液,分別與適量酶液在37 ℃下反應,計算反應速率,采用雙倒數作圖法確定重組CBL的反應速率常數KmL-cystathionine及最大反應速率VmaxL-cystathionine值。
2 結果與討論
2.1 重組菌的構建和表達
以大腸桿菌E.coliK12基因組DNA為模板PCR克隆了1185 bp的CBL基因片斷并進行測序,CBL基因編碼395個氨基酸殘基,然后將其連接至質粒pETDuet-1構建了重組質粒pETDuet-1-CBL,重組質粒BamHI和NotI雙酶切鑒定結果如圖1所示。

M.DNA Marker 1.CBL基因 2,3.pETDuet-1-CBL經Bam HI和Not I雙酶切的產物
將重組質粒轉入E.coliBL21感受態細胞構建了表達CBL的重組菌E.coliBL21(pETduet-1-CBL)。重組菌在37 ℃下培養至OD600為0.4~0.6,加入終濃度為0.5 mmol·L-1的IPTG于30 ℃誘導9 h至穩定期,SDS-PAGE分析結果表明,目的蛋白分子量約40 kDa,這與大腸桿菌CBL分子量的理論計算值一致。可溶性CBL的表達量達18 mg·L-1,占到菌體可溶性總蛋白的23%,重組菌在該條件下表達的重組蛋白包涵體少,而在37 ℃、1 mmol·L-1IPTG誘導的條件下盡管蛋白表達量較大,但大部分為包涵體。因此,低溫、低濃度的誘導劑有利于重組CBL的可溶性表達。
2.2 CBL的分離純化
菌體超聲破碎后的上清液,離心后上樣到預平衡的HisTrap Fast Flow柱,目的蛋白直接吸附到柱上,用洗脫緩沖溶液進行洗脫,一步純化得到CBL,酶活性回收率為71%,純化的CBL純度達到94%,單位酶活為134.6 U·mg-1,各步驟組分電泳結果見圖2。

M.蛋白質分子量標準 1.誘導前菌體總蛋白 2.IPTG誘導后菌體總蛋白 3.IPTG誘導后菌體破碎后上清液 4.親和層析純化后的CBL溶液
此外,研究發現純化后的CBL蛋白溶液經凍融后幾乎全部聚集沉淀,這可能是由于蛋白質溶液凍融時產生的冰晶影響了蛋白質的三級結構所致。在純化后的酶液中加入5%甘油,可以有效防止CBL溶液在凍融時發生聚沉。Laber等[8]也構建了表達大腸桿菌CBL的重組菌E.colipCS1,大規模發酵后通過硫酸銨鹽析、DEAE-Sepharose Fast Flow柱層析和Phenyl-Sepharose HP柱層析三步純化,最終從10 L大腸桿菌發酵液中純化獲得150 mg CBL,但是并未對其酶學性質進行研究。
2.3 重組CBL的酶學性質
2.3.1 最適溫度及溫度穩定性
取一定量的CBL酶液分別在不同溫度(25~55 ℃)下反應20 min,測定產物丙酮酸的生成量,計算不同溫度下CBL的活性,結果如圖3所示。

圖3 溫度對CBL酶活的影響
由圖3可知,CBL的最適反應溫度為35 ℃。溫度在35~45 ℃時酶反應活性較高;當溫度超過45 ℃時酶活性急劇下降,升至55 ℃時CBL活性降至最大酶活性的29.7%,這可能是由于溫度超過45 ℃后重組CBL變性加快所致。
取一定量CBL酶液分別在20~50 ℃下保溫5 h,測定產物丙酮酸的生成量,計算不同溫度下CBL的活性,結果如圖4所示。

圖4 CBL在不同溫度下的酶活穩定性
由圖4可知,CBL在20~35 ℃下較穩定,隨著溫度的升高,穩定性逐漸下降,超過40 ℃時酶失活速度加快,當溫度升至50 ℃時,相對酶活下降至32.2%。因此,在35 ℃下使用CBL酶催化反應最有效,且不宜將酶液長期放置在30 ℃以上環境。Gentry-Weeks等[9]由博德特氏菌(Bordetella)發酵得到的CBL在40 ℃以下較穩定。Alting等[10]從乳酸乳球菌(Lactococcuslactis)中純化的CBL在60 ℃以下比較穩定,60 ℃以上酶活性急劇下降,70 ℃時幾乎完全失活。因此,來自博德特氏菌和乳酸乳球菌的CBL熱穩定性均優于來自大腸桿菌的CBL,尤其是來自乳酸乳球菌的CBL具有很高的熱穩定性。
2.3.2 最適pH值及pH值穩定性
取一定量CBL酶液分別在pH值5.0~10.0條件下反應20 min,測定產物丙酮酸的生成量,計算不同pH值下CBL的活性,結果如圖5所示。

圖5 pH值對CBL酶活的影響
由圖5可知,重組酶在堿性條件下(pH值8.0~10.0)活性較高,在pH值8.0的條件下反應活性最高,在酸性溶液中(pH值<7.0)活性較低,在pH值5.0的條件下活性幾乎為零。Alting等[10]從乳酸乳球菌中純化的CBL在pH值5.0~5.5之間只有10%~15%的活性,在pH值7.5~8.5之間反應活性最高,在pH值>8.5時活性急劇下降。
取一定量CBL酶液分別在pH值5.0~10.0條件下于4 ℃保溫10 h,測定產物丙酮酸的生成量,計算不同pH值下CBL的活性,結果如圖6所示。
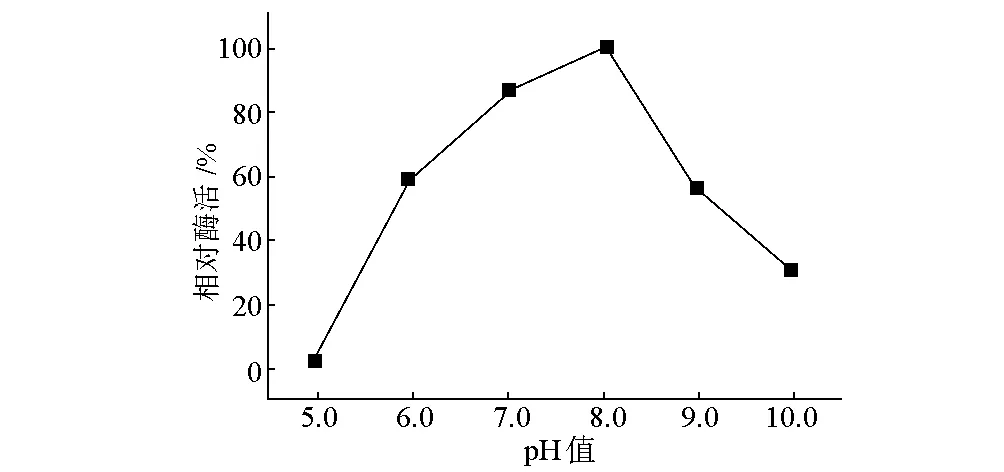
圖6 CBL在不同pH值下的酶活穩定性
由圖6可知,與保溫前酶活力相比,重組酶在pH值6.0~9.0的條件下均能保持50%以上的活性,在pH值8.0的緩沖溶液中最穩定,保溫10 h后仍能保留92%酶活力。但CBL在酸性條件下極易失活,在pH值5.0的緩沖溶液中保溫10 h后酶完全失活。這可能是在酸性條件下CBL的結構不穩定所致。
2.3.3 動力學常數
測得重組CBL的KmL-cystathionine值為3.78 mmol·L-1,VmaxL-cystathionine值為0.928 mmol·L-1·h-1。文獻中沒有發現對其它物種來源的CBL動力學常數的測定。
3 結論
構建了能高效表達CBL的重組菌E.coliBL21(pETDuet-1-CBL),可溶性CBL的表達量達18 mg·L-1,占到菌體可溶性總蛋白的23%,破碎后上清液經一步親和層析純化得到CBL,回收率為71%,純度達到94%,純化后的CBL單位酶活為134.6 U·mg-1。在純化的CBL溶液中加入5%甘油可以有效地防止凍融過程中CBL發生聚沉。重組酶的最適反應溫度為35 ℃,酶活性穩定的溫度范圍為20~35 ℃。重組酶的最適反應pH值為8.0,4 ℃下在pH值8.0的緩沖溶液中保溫10 h酶穩定性最高。重組CBL的KmL-cystathionine值為3.78 mmol·L-1,VmaxL-cystathionine值為0.928 mmol·L-1·h-1。建立了基于CBL催化反應產物丙酮酸與2,4-二硝基苯肼顯色原理測定CBL酶活性的新方法。本研究結果為利用酶催化法測定Hcy的含量奠定了基礎。
[1] 鄧爭榮,楊貴琦,陳新義.同型半胱氨酸與高血壓病、冠心病的相關性[J].西安交通大學學報(醫學版),2002,23(5):468-469.
[2] 潘峰,孫瑋,張青,等.高效液相色譜法測定血漿中同型半胱氨酸[J].氨基酸和生物資源,2010,32(4):55-57.
[3] Nekrassova O,Lawrence N S,Compton R G,et al.Analytical determination of homocysteine:A review[J].Talanta,2003,60(6):1085-1095.
[4] Ivanov A V,Luzyanin B P,Moskovtsev A A,et al.Determination of total homocysteine in blood plasma by capillary electrophoresis with mass spectrometry detection[J].J Anal Chem,2011,66(3):317-321.
[5] Hung V W-S,Kerman K.Gold electrodeposition on carbon nanotubes for the enhanced electrochemical detection of homocysteine[J].Electrochem Commun,2011,13(4):328-330.
[6] 胡曉冰,林標聲,楊生玉,等.測定丙酮酸發酵生產產量的幾種化學方法的比較[J].糧油化工,2010,(12):165-168.
[7] 王偉偉.診斷工具酶的制備及其穩定性的研究[D].南京:南京理工大學,2006.
[8] Laber B,Clausen T,Huber R,et al.Cloning,purification,and cr-ystallization ofEscherichiacolicystathionineβ-lyase[J].FEBS Lett,1996,379(1):94-96.
[9] Gentry-Weeks C R,Keith J M,Thompson J.Toxicity ofBordetellaaviumβ-cystathionase toward MC3T3-E1 osteogenic cells[J].J Biol Chem,1993,268(10):7298-7314.
[10] Alting A C, Engels W J M, Schalkwijk S V, et al.Purification and characterization of cystathionineβ-lyase fromLactococcuslactissubsp.cremorisB78 and its possible role in flavor development in cheese[J].Appli Environ Microbiol,1995,61(11):4037-4042.

