粘紅酵母ATP:檸檬酸裂解酶基因的克隆表達和酶學性質
趙 檢,王旭穎,王茂淋,鄭世學,喻子牛,張吉斌
(華中農業大學 農業微生物學國家重點實驗室 微生物農藥國家工程研究中心,湖北 武漢 430070)
ATP:檸檬酸裂解酶(ATP:Citrate lyase,ACL,EC 2.3.3.8)廣泛存在于藻類、植物和動物中,在少量的原核生物或古細菌中也會存在[1]。ATP:檸檬酸裂解酶是脂肪酸合成途徑外的一個關鍵酶,能催化檸檬酸裂解生成乙酰輔酶A和草酰乙酸,從而完成脂肪酸輔酶A的合成。研究表明,當微生物油脂積累量超過其生物量的20%時都會具有ACL活性,但尚未發現不同酵母和真菌中油脂積累的程度和ACL的活性具有明確的定量關系[2]。
通過對真菌基因組序列的分析表明,大部分的真菌都存在acl基因,但是在酵母菌亞門[解脂耶氏酵母(Yarrowialipolytica)除外]中卻明顯地缺失了。在一些酵母和霉菌中ACL是由兩個基因編碼的,這兩個基因是分開存在的,有的存在于兩個不同的染色體上,有的存在于同一染色體上不同的位置,并且它們編碼的方向也會存在差異,而在另外一些真菌和哺乳動物體內ACL卻是由一個基因編碼的[3]。不同菌種的ACL蛋白的結構也不盡相同,Shashi等[4]從瘦弱紅酵母(Rhodotorulagracilis)中提取純化了ACL蛋白,研究表明該酶分子量為520 kDa,由4個120 kDa大小的亞基組成。Adams等[5]從構巢曲霉(Aspergillusnidulans)中純化了ACL蛋白,該酶是一種六聚體結構,由3個70 kDa和3個55 kDa的亞基蛋白組成。
有關acl基因的克隆研究最早始于1990年,Elshourbagy等[6]首次克隆了動物體內的acl基因。為了了解原核生物ACL分子水平的作用機制,Kanao等[7]對細菌的ACL作用機制進行了酶動力學研究,確定了磷酸化作用位點、活性抑制劑等因素。所有原核、真菌、哺乳動物和植物等的acl基因序列都包含幾個高度的保守區,這些保守區都是ACL起催化作用的位點,如ATP-、CoA-、草酰乙酸鹽結合位點以及檸檬酸合成酶作用位點等。Kim等[8]從綠硫菌(Chlorobiumtepidum)中克隆得到了編碼ACL兩個亞基的基因,并且將其分別在大腸桿菌E.coliBL21 (DE3)中進行了表達和酶活分析,結果表明兩個亞基對全酶的催化活性都起著重要的作用。目前還沒有克隆表達產油微生物acl基因的報道,因此,篩選分離出產油微生物的acl基因,利用基因工程實現對其表達量的調控,提高酶活性,進而提高微生物甚至是油料作物的產油能力,成為了新的研究熱點。
作者從高產油粘紅酵母中克隆ATP:檸檬酸裂解酶基因的兩個亞基基因acl1和acl2,在畢赤酵母中進行誘導表達和酶活驗證,以獲取更高的ACL酶活力,并對其酶學特性進行了研究,為提高油料作物油脂含量提供了新的轉基因材料。
1 實驗
1.1 材料與試劑
粘紅酵母 (Rhodotorulaglutinis)31596,中國農業科學院油料作物研究所;PichiapastorisGS115,自行保藏;pPICZαA表達載體由國家海洋局第三海洋研究所惠贈;pMD18-T,Takara公司。
E.Z.N.A.TMYeast RNA Kit,Omega公司;AxyPrepTMDNA Gel Extraction Kit、AxyPrepTMPCR Cleanup Kit,Axygen公司;RevertAidTMFirst Strand cDNA Synthesis Kit,Fermentas公司;T4 DNA連接酶及限制性內切酶(EcoRⅠ、XbaⅠ、KpnⅠ和PmeⅠ)、 Ex TaqTMPolymerase、RNase A,Takara公司。
1.2 方法
1.2.1 RNA的提取
首先將甘油管內保存的粘紅酵母劃線至YPD平板上長出二代單菌落,然后挑取單菌落接種到YPD液體培養基中28 ℃培養過夜,待菌體長到一定濃度(OD600≈1.2)后,離心收集菌體,采用E.Z.N.A.TMYeast RNA Kit試劑盒提取總RNA,具體操作見試劑盒說明書。將提取好的RNA進行0.8%的瓊脂糖凝膠電泳檢測,然后于-80 ℃保存。
1.2.2acl1和acl2基因的擴增
根據在NCBI中查找的和粘紅酵母親緣關系最近且同為油脂酵母的模式菌解脂耶氏酵母 (Yarrowialipolytica)CLIB122的acl基因的兩個亞基acl1 (CR382131.1)和acl2 (CR382130.1) 的序列(分析表明均無內含子),分別設計帶有酶切位點的特異性引物:ACL1-F/ACL1-R和ACL2-F/ACL2-R,引物序列見表1,引物由上海英駿公司合成。
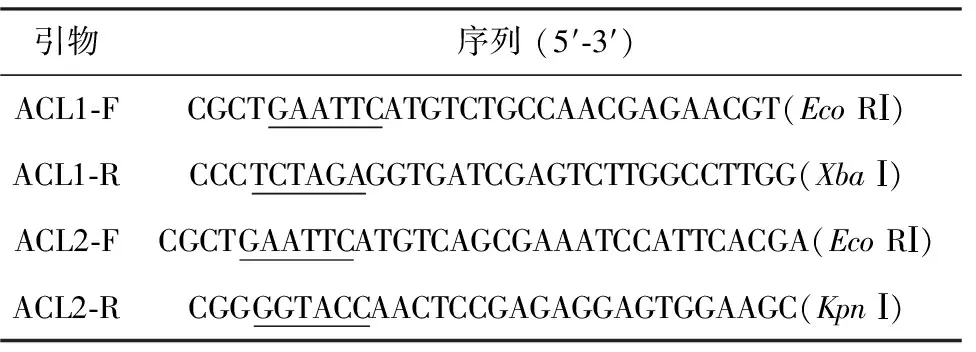
表1 實驗所需引物
以提取的粘紅酵母RNA為模板進行反轉錄PCR,按照試劑盒說明書進行操作,第二輪PCR體系為:94 ℃變性5 min;94 ℃變性45 s,55 ℃退火45 s,72 ℃延伸90 s,30個循環;72 ℃保溫10 min。將擴增得到的目的基因片段送上海英駿公司進行測序驗證。
1.2.3 重組質粒pPICZαA-acl1和pPICZαA-acl2的構建
將擴增得到的acl1基因片段和pPICZαA載體分別用EcoRⅠ和XbaⅠ雙酶切,acl2基因片段和pPICZαA載體分別用EcoRⅠ和KpnⅠ雙酶切,然后回收目的片段分別進行連接,得到重組質粒pPICZαA-acl1和pPICZαA-acl2。
1.2.4 電轉化畢赤酵母GS115
將構建好的重組載體pPICZαA-acl1和pPICZαA-acl2分別用PmeI線性化,然后將10~20 μL線性化質粒分別加入到80 μL畢赤酵母GS115感受態細胞中,混勻后冰上靜置5 min,放入0.2 cm電轉杯電轉(電轉參數:2.0 kV)約5 ms,然后立即加入1 mL冰浴的山梨醇,30 ℃靜置1 h,最后取100 μL轉化液,涂布YPDS (300 μg·mL-1Zeocin)平板,將YPDS板置于30 ℃培養箱中培養2~3 d,直至長出菌落。挑取單菌落,進行菌落PCR驗證,瓊脂糖凝膠電泳分析結果。
1.2.5 目的蛋白的誘導表達和純化
篩選出陽性克隆子后,先對其進行小量甲醇誘導表達,SDS-PAGE檢測表達情況,具體操作步驟如下:挑取YPDS平板上的陽性單克隆接種于50 mL BMGY培養基中,30 ℃、搖床培養2~3 d;收集培養液,4 ℃、8000 r·min-1離心15 min,取沉淀(盡量將上清除盡),向其中加入40 mL含有0.5%甲醇的BMMY培養基,重新在30 ℃誘導培養;為補償甲醇的揮發損失,每24 h補加甲醇,使菌液中的甲醇濃度保持在0.5%;每隔24 h取樣,4 ℃、8000 r·min-1離心15 min,收集菌體,SDS-PAGE檢測蛋白;誘導4~5 d后,4℃、8000 r·min-1離心15 min,收集菌體,SDS-PAGE檢測蛋白。然后大量表達目的蛋白,表達產物用金屬(Ni2+)螯合瓊脂糖凝膠柱進行純化,收集的純化產物分別以紫外分光光度法和SDS-PAGE測定蛋白濃度和純度。
1.2.6 酶活分析
ACL活性的測定采用傳統方法:蘋果酸脫氫酶偶聯法[9]。通過實時測定NADH在340 nm處吸光度的減少,確定ACL相對酶活性。
2 結果和討論
2.1 全長基因的克隆及序列分析
以粘紅酵母RNA為模板通過RT-PCR擴增得到acl基因的兩個亞基,經0.8%的瓊脂糖凝膠電泳檢測,所得產物大小分別約為2.0 kb (acl1) 和1.5 kb (acl2)(圖1)。擴增得到的產物測序,將序列結果提交NCBI通過Blast分析比對,所擴增的acl1基因片段與GenBank中登錄的YarrowialipolyticaCLIB122 (CR382131.1)、AspergillusnigerCBS (001394018.2)、Penicilliumchrysogenum(AM920436.1)的DNA序列中的acl1基因序列同源性分別為100%、92%、73%,acl2基因片段與GenBank中登錄的YarrowialipolyticaCLIB122 (CR382130.1)、AspergillusnigerCBS(XM 001394020.2)、Magnaportheoryzae(XM 370223.1)的DNA序列中的acl2基因序列同源性分別為100%、76%、69%,表明已成功擴增獲得粘紅酵母的acl1和acl2基因序列。通過軟件分析表明,acl1基因序列長1953 bp,不含內含子,理論蛋白分子量為71 kDa,等電點為8.0;acl2基因序列長1494 bp,不含內含子,理論蛋白分子量為54 kDa,等電點為5.6。
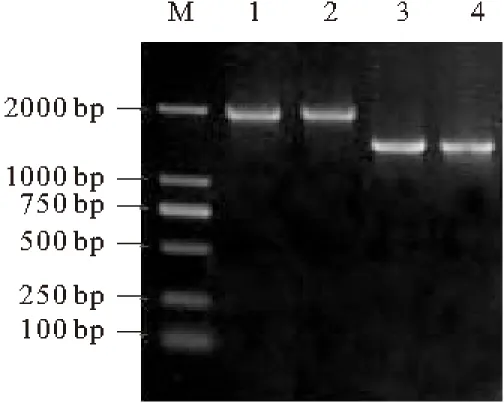
M. DNA Marker 1,2.粘紅酵母acl1 3,4.粘紅酵母acl2
2.2 重組載體pPICZαA-acl1和pPICZαA-acl2的構建和鑒定
重組載體的構建如圖2所示。將重組載體pPICZαA-acl1用EcoRⅠ和XbaⅠ雙酶切、pPICZαA-acl2用EcoRⅠ和KpnⅠ雙酶切,0.8%瓊脂糖凝膠電泳分析結果如圖3所示。
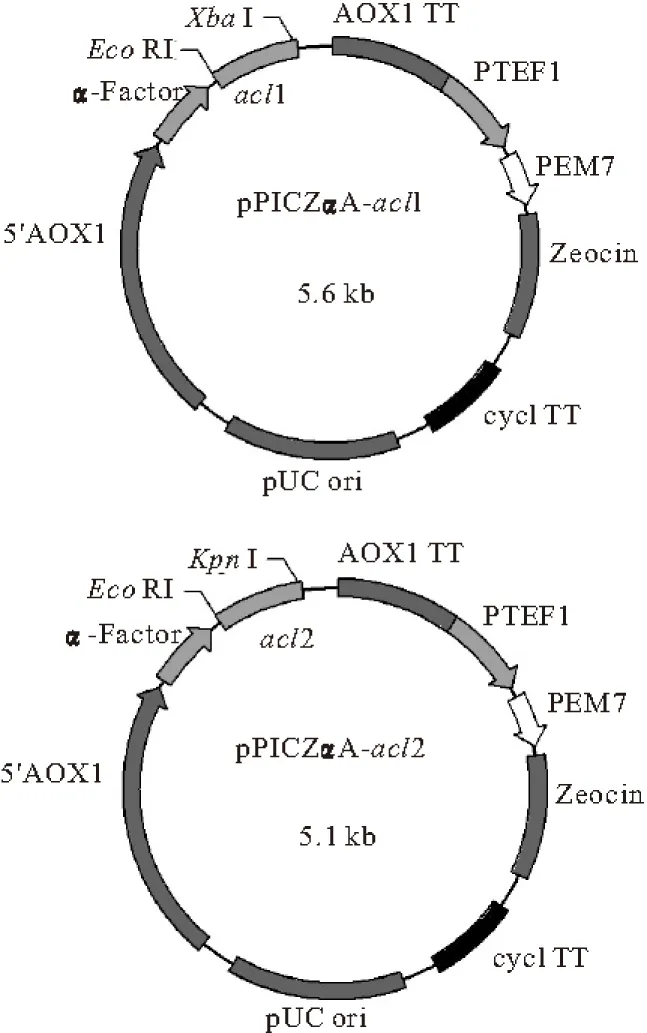
圖2 重組載體pPICZαA-acl1和pPICZαA-acl2的構建
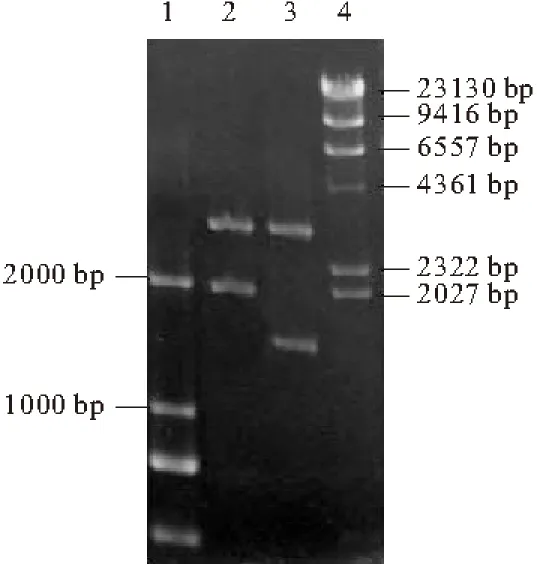
1,4. DNA Marker 2. Eco RⅠ和XbaⅠ雙酶切pPICZαA-acl1
由圖3可知,pPICZαA-acl1經雙酶切產生約2.0 kb和3.5 kb的條帶,pPICZαA-acl2經雙酶切產生約1.5 kb和3.5 kb的條帶,與預期相符。對重組子的目的片段進行測序驗證,讀碼框完全正確,不存在突變位點。
2.3 重組蛋白的純化
對純化產物進行SDS-PAGE分析,結果見圖4。

M.蛋白 Marker 1.純化的ACL1蛋白 2.純化的ACL2蛋白
由圖4可知,兩個亞基蛋白ACL1和ACL2的分子量分別約為66 kDa和55 kDa。純化后的ACL1和ACL2亞基蛋白的濃度分別達到1.34 mg·mL-1和1.6 mg·mL-1,可用于后續實驗操作。
2.4 酶活檢測及最佳酶反應條件的確定
分別對粘紅酵母的單個亞基的酶比活力進行了測定,結果見圖5。
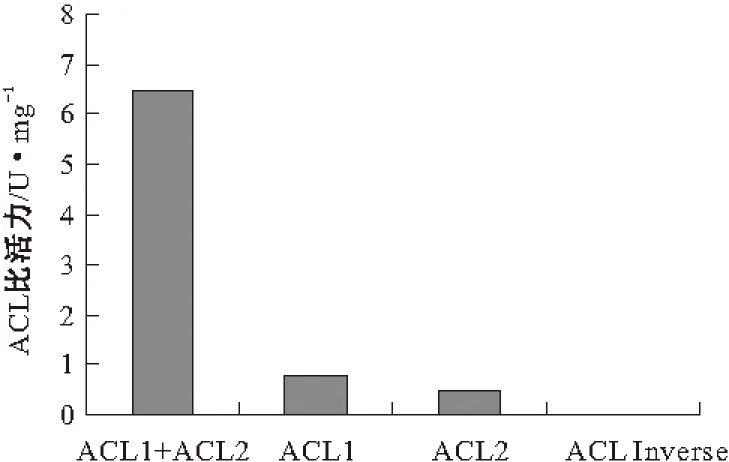
圖5 ACL全酶和各亞基的酶比活力
由圖5可知,單個亞基進行酶活測定時的酶比活力不到1.0 U·mg-1,說明全酶要發揮最大作用,就必須將其兩個亞基所含有的所有催化作用位點都聚齊,缺失一個都會嚴重影響其酶活力。
粘紅酵母的ACL1和ACL2不同質量比混合對酶比活力的影響見圖6。

m(ACL1)∶m(ACL2)
由圖6可知,ACL1和ACL2質量比在1∶1混合時全酶的比活力達到最大,為6.5 U·mg-1,比原始酵母提高了近10%。
將兩種亞基按照最佳質量比混合,保證一定濃度,分別考察酶反應的pH值、反應溫度和反應時間對全酶酶比活力的影響,結果見圖7。
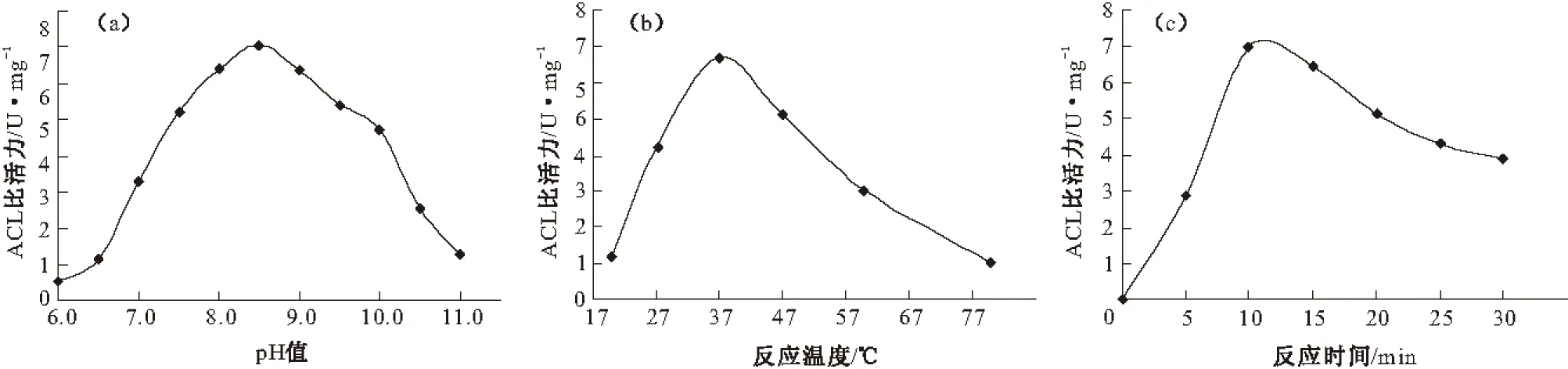
圖7 反應條件對全酶酶比活力的影響
由圖7可知,全酶的最佳反應pH值為8.5(圖7a),偏酸或者偏堿都會影響酶活力;最佳反應溫度約為37 ℃(圖7b),過高的溫度會降低酶活力,說明該酶不耐高溫,保存的時候需要超低溫保存且時間不宜過長;最佳反應時間約為10 min(圖7c),適當延長反應時間對酶活力的影響很小。
2.5 討論
多數報道選用細菌來源的基因,表達后的ACL蛋白酶活力都比較低,如Kanao等[10]從泥生綠菌(Chlorobiumlimicola)中克隆得到aclBA進行大腸桿菌表達,表達后蛋白的酶比活力為3.5 U·mg-1。Langlade等[11]從植物白羽扇豆(Lupinusalbus)中克隆得到aclA和aclB,并分別進行了酵母表達,表達后蛋白的酶比活力為5.3 U·mg-1。目前還沒有克隆表達產油微生物acl基因的報道。本研究采用粘紅酵母作為基因克隆材料,成功克隆出acl基因,在畢赤酵母(本身不存在acl基因[12])中進行誘導表達后,ACL蛋白的酶比活力最高達6.5 U·mg-1,比在粘紅酵母本身(比活力為5.88 U·mg-1[4])提高了近10%。結果還表明,表達后的粘紅酵母ACL酶反應的最佳條件不同于酵母的正常生長環境,且全酶要發揮最大的酶活力,其兩個亞基蛋白缺一不可。
總之,可以利用基因工程來對粘紅酵母這類油脂酵母的acl基因表達量進行調控,并提高ACL酶活力。ACL活性的提高可能增加油菜菜籽中的油酸含量[13],因此,油脂酵母可提供新的基因資源,并應用于后續的轉基因植物,從而提高油料作物的油脂含量。
3 結論
從粘紅酵母(Rhodotorulaglutinis)中克隆得到ATP:檸檬酸裂解酶基因兩個亞基acl1和acl2,轉化畢赤酵母(Pichiapastoris) GS115進行誘導表達,通過Ni柱純化目的蛋白,以實時波長掃描對重組蛋白的酶學性質進行測定分析。SDS-PAGE分析表明,兩個亞基ACL1和ACL2的分子量分別為66 kDa和55 kDa。重組蛋白的酶學測定表明:經畢赤酵母表達后,單個亞基酶活性不到1.0 U·mg-1,雙亞基混合后具有較高的酶活性,當混合質量比為1∶1時全酶的酶比活力達到最大,為6.5 U·mg-1,酶反應的最佳條件為:pH值8.5、37 ℃反應10 min。為提高油料作物油脂含量提供了新的轉基因材料。
[1] Hynes M J,Murray S L. ATP-Citrate lyase is required for the production of cytosolic acetyl-CoA and development inAspergillusnidulans[J]. Eukaryotic Cell,2010,9(7):1039-1048.
[2] 劉波,孫艷,劉永紅,等.產油微生物油脂生物合成與代謝調控研究進展[J].微生物學報,2005,45(1):153-156.
[3] Nowrousian M,Kück U,Loser K,et al. The fungalacl1 andacl2 genes encode two polypeptides with homology to the N- and C-terminal parts of the animal ATP-citrate lyase polypeptide[J]. Current Genetics,2000,37(3):189-193.
[4] Shashi K,Bachhawat A K,Joseph R. ATP:Citrate lyase ofRhodotorulagracilis:Purification and properties[J]. Biochimica et Biophysica Acta,1990,1033(1):23-30.
[5] Adams I P,Dack S,Dickinson F M,et al. The distinctiveness of ATP:citrate lyase fromAspergillusnidulans[J]. Biochimica et Biophysica Acta,2002,1597(1):36-41.
[6] Elshourbagy N A,Near J C,Kmetz P J,et al. Cloning and expression of a human ATP-Citrate lyase cDNA[J]. European Journal of Biochemistry,1992,204(2):491-499.
[7] Kanao T,Fukui T,Atomi H,et al. Kinetic and biochemical analyses on the reaction mechanism of a bacterial ATP-Citrate lyase[J]. European Journal of Biochemistry,2002,269(14):3409-3416.
[8] Kim W,Tabita F R. Both subunits of ATP-citrate lyase fromChlorobiumtepidumcontribute to catalytic activity[J]. Journal of Bacterioligy,2006,188(18):6544-6552.
[9] Takeda Y,Suzuki F,Inoue H. ATP citrate lyase (citrate-cleavage enzyme)[J]. Methods in Enzymology,2003,1969(13):153-160.
[10] Kanao T,Fukui T,Atomi H,et al. ATP-citrate lyase from the green sulfur bacteriumChlorobiumlimicolais a heteromeric enzyme composed of two distinct gene products[J]. European Journal of Biochemistry,2001,268(6):1670-1678.
[11] Langlade N B,Messerli G,Weisskopf L,et al. ATP-Citrate lyase:Cloning,heterologous expression and possible implication in root organic acid metabolism and excretion[J]. Plant,Cell and Environment,2002,25(11):1561-1569.
[12] Chāvez-Cabrera C,Flores-Bustamante Z R,Marsch R,et al. ATP-Citrate lyase activity and carotenoid production in batch cultures ofPhaffiarhodozymaunder nitrogen-limited and nonlimited conditions[J]. Applied Microbiology and Biotechnology,2010,85:1953-1960.
[13] 王樹源,陳健美,戚維聰,等.雙低油菜品系含油量與 ACL酶活性的相關性分析[J].中國油料作物學報,2009,31(3):279-284.

