首發抑郁癥患者治療前后的靜息態fMRI研究
孫 軍 劉含秋 孫華平 張俊海 馮曉源 郭 琴 施慎遜
通常腦功能成像主要是由2種狀態即任務狀態與基準狀態相減而得到結果,研究大多以閉目或被動觀察無任務的狀態作為對照進行成像。近年研究發現,在進行任務刺激時,某些腦區活動性減弱,或者說大腦在沒有任務的清醒靜息狀態時也存在功能活動[1-2]。Raichle等[3]首次采用PET測量腦血流量及耗氧量得到所謂靜息狀態下“默認模式”的腦功能網絡。研究發現雖然活動性增強的腦區隨不同的任務刺激而改變,但是活動性減弱的腦區卻比較接近,把這些不同任務引發的信號減低腦區作為基礎狀態或默認狀態。默認模式神經網絡主要包括楔前葉/后部扣帶回皮質及前額葉內側皮質/腹側前部扣帶回皮質等腦區。
fMRI研究靜息態下的腦功能狀態雖然起步較晚,卻已經發展成為功能MRI的一個分支,主要的分析方法有三種:區域性同源(regionalhomogeneity)方法[4]、功能連接性分析[5]和低頻波振幅分析(amplitude of low frequency fluctuation,ALFF)[6]。前兩種分別著重分析區域之內及區域之間時相相近的區域,研究角度主要針對時間同步方面,雖然在顯示較遠腦區間功能連接存在異常的結果比較直觀,但不能直接判斷哪一個腦區是異常的,ALFF則著重測量區域活動性的幅度,可以直接判斷活動異常的腦區。
抑郁癥(major depressive disorder,MDD)患者經常處于悲傷、內疚、自責、無助狀態,這種持久的抑郁狀態對腦的功能狀態產生影響。本研究前提是抑郁癥持久的抑郁狀態造成默認模式神經網絡的異常,經過有效藥物治療后可能好轉。研究通過比較首發MDD患者藥物治療前后的靜息態低頻波幅 (ALFF)的BOLD信號變化,探討其作為生物學指標觀察藥物療效的價值。
方 法
1.研究對象
2006年11月~2007年3月在華山醫院心理咨詢門診就診的13例抑郁癥患者納入研究組,入組標準:①符合美國精神疾病診斷與統計手冊第四版(DSM-Ⅳ)抑郁癥的診斷標準;②年齡20~59歲;③17項漢密爾頓抑郁量表(Hamilton rating scale fordepression,HAMD17)評分≥17分;④首次抑郁發作。均為右利手,排除既往有精神疾病或現患除抑郁癥外的其他精神疾病,排除其他腦部器質性病變或全身系統性疾病所致抑郁。給予選擇性5-羥色胺再攝取抑制劑類藥物(百憂解、來士普、左洛復)治療后 8周,進行同樣檢查及評分。
選取從未患過抑郁癥的14例健康者作為對照組,年齡、性別及教育程度與研究組匹配。均為右利手,排除有精神疾病史或一級親屬中有嚴重精神疾病史;排除神經系統和其他全身器質性疾病。
所有受試者體內均無金屬植入物或沒有M R檢查禁忌證,自愿參加并簽署知情同意書。本研究已獲得華山醫院倫理委員會批準。
2.MRI檢查
所有掃描均使用GE Signa 3.0T磁共振成像系統,鳥籠狀頭部8通道線圈。被試頭部用套墊固定,保持整個掃描期間不動。掃描之前,告知受試者保持清醒、閉目、全身放松狀態,盡量不作任何思考。掃描時可以用話筒與受試者交流并盡量減少機器噪音的影響。在每次掃描開始之前測量受試者呼吸及脈搏是否平穩,結束之后詢問受試者做的如何,是否能夠跟上掃描的指令,保證采集數據的有效性。
常規三平面定位后,行矢狀位T1WI-FLAIR掃描,以前后聯合的連線作為掃描基線,行斜軸位的T1WI(TR/T E=400ms/12ms)掃描。掃描范圍從顱頂至枕骨大孔,層厚5mm,無間隔的連續掃描,獲取24層高分辨率解剖圖像,作為功能掃描的參照圖。功能成像程序,采用單次激發平面回波成像的梯度回波序列GRE-EPI序列,復制T1WI圖像設置,層厚5mm,間隔 0,TR=2000ms,TE=35ms,分辨率64×64,FOV=240mm,進行BOLD fMRI掃描,掃描時間312s,前12s不做數據采集。
3.圖像的分析和處理
將個體原始圖像導入個人電腦工作站,采用MRI-cro軟件(Chris Rorden,http://www.psychology.nottingham.ac.uk/staff/cr1/mricro.html),將原始DICOM圖像轉化成可分析的文件格式,然后使用SPM2(SPM,Wellcome DepartmentofCognitive Neurology, London,UK)軟件及ALFF專用分析軟件(State Key Laboratory of Cognitive Neuroscience and Learning,Beijing Normal University,Beijing,P.R.China)進行分析,在MatLab(Mathworks,Inc.,Sherborn,Mass)上執行操作。
首先原始數據經過SPM 2軟件預處理:步驟包括功能圖像的頭動矯正、空間標準化、體素大小重新采樣與空間平滑步驟(FWHM=10mm)。預處理后,采用ALFF分析軟件使每個體素經過帶寬0.01~0.08低頻濾波去除更低頻率的漂移及高頻噪聲,如呼吸及心跳。濾過后的數據經過傅立葉轉換后得到個人的ALFF圖像。然后采用SPM 進行組內、組間圖像分析,分三組:正常對照組、抑郁癥療前組、抑郁癥療后組。為顯示掃描圖像中ALFF超過全腦平均水平腦區部位,組內分析采用單樣本單向t檢驗,域值為1[7](全腦的ALFF平均水平)。正常組與患者組間比較采用兩樣本t檢驗,治療前后組間比較采用配對 t檢驗,P<0.05,uncorrected,k≥20voxels認為有統計學意義。
結 果
首發MDD患者治療前與正常對照組相比抑郁狀態評分存在明顯差異,經8周治療后癥狀較治療前明顯好轉,表明抗抑郁療效顯著(表1)。
個人及組內圖像分析結果顯示在靜息狀態下,個人的自發低頻波信號分布在大腦灰質區,主要包括楔前葉/后部扣帶回皮質及前額葉內側皮質/腹側前部扣帶回皮質,少量分布在額頂葉背外側區。
正常對照組與MDD患者的比較結果顯示正常人的靜息態神經網絡基于ALFF的BOLD信號較抑郁癥患者明顯增高,主要位于扣帶回膝部、前額葉背內側及右外側額葉,楔前葉/扣帶回后方、右側島葉及小腦;未見MDD比正常對照組信號增高腦區。抑郁癥患者治療前后組比較表明治療前左側前額葉腹內側及腹外側皮質BOLD信號較治療后增高,而治療后右側前額葉腹內側皮質、雙側前額葉背外側皮質、右側眶額葉,右側顳極,雙側扣帶回后部等廣泛區域BOLD信號較治療前增高(P<0.05,uncorrected,圖 1,表2)。
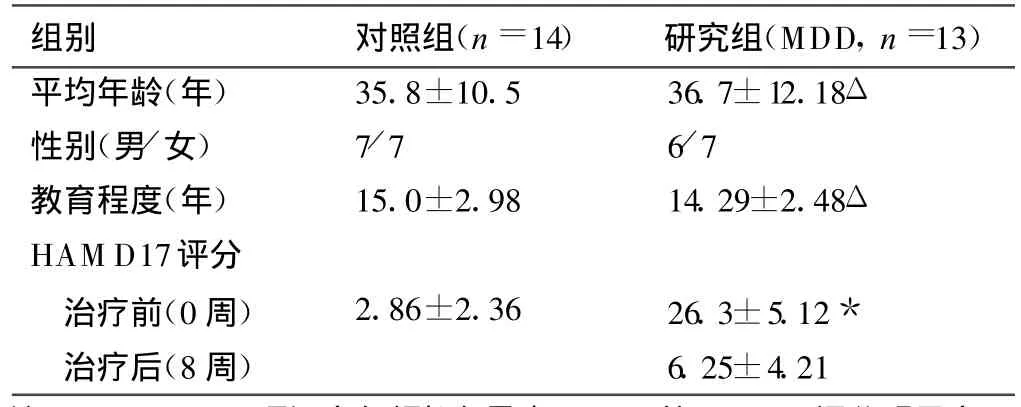
表1 研究組和對照組一般臨床資料
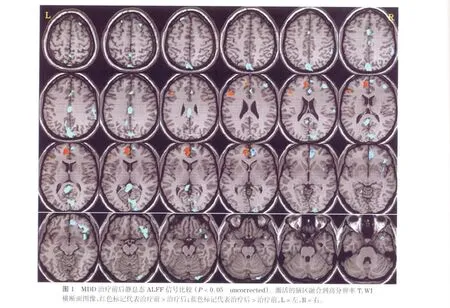
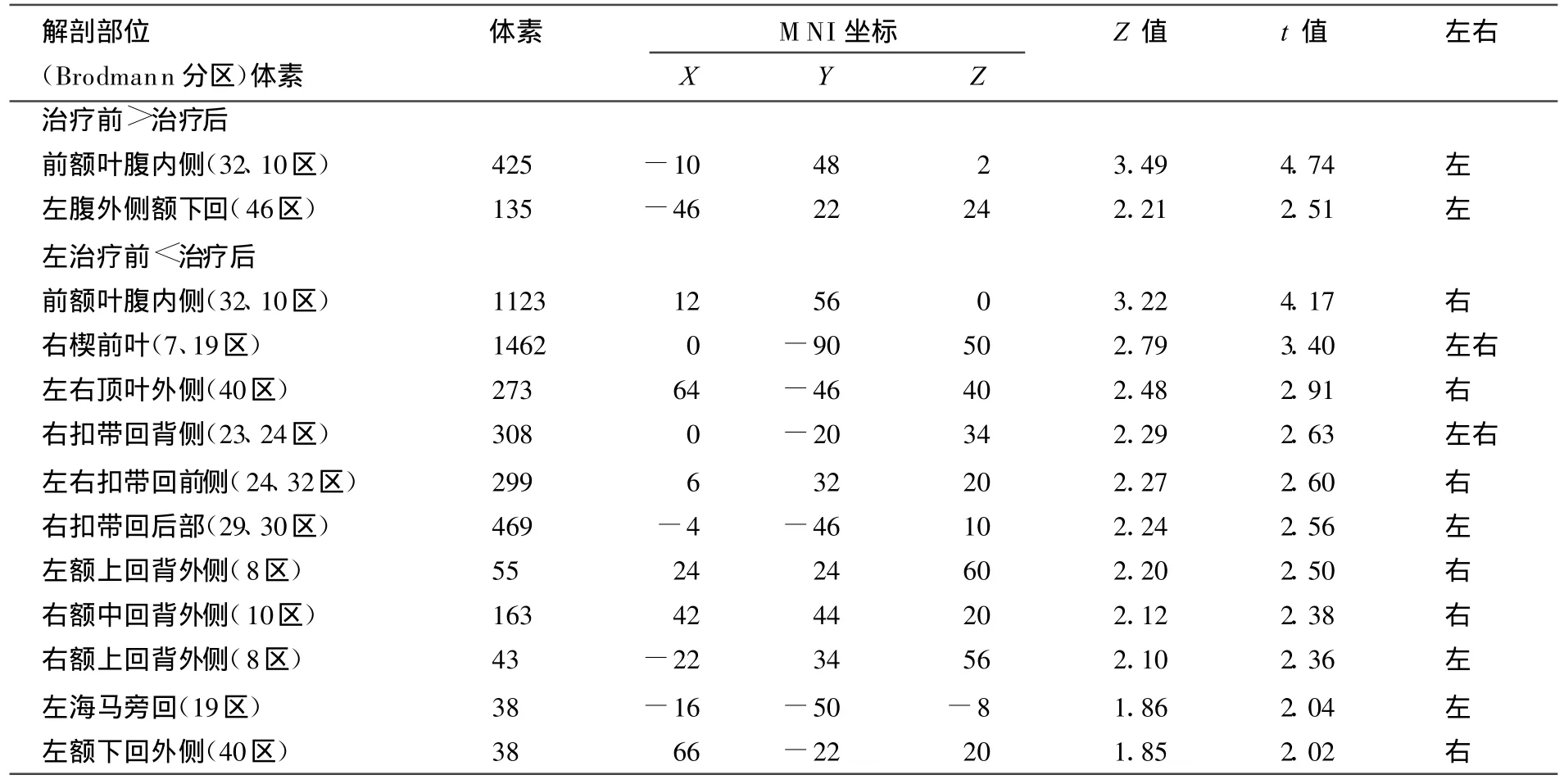
表2 MDD治療前后ALFF信號比較的腦功能區分布(P<0.05,uncorrected)
討 論
采用fMRI研究靜息狀態下抑郁癥的改變報道較少,而且多采用功能連接分析方法[5],結果表明抑郁癥患者的前扣帶回與丘腦之間的連接較正常對照組增強。本研究采用基于ALFF分析方法研究MDD靜息態腦功能未見報道。
本研究個人及組內圖像分析結果顯示在靜息狀態下,個人的自發低頻波信號分布在大腦灰質區,主要包括楔前葉/后部扣帶回皮質及前額葉內側皮質/腹側前部扣帶回皮質,少量分布在額頂葉背外側區,與許多研究結果一致,符合大腦默認模式[3]。大腦默認模式神經網絡是由內而發的思考過程所調節,在刺激態fMRI時常常因為需要被試者注意那些外在刺激進行的認知需要而被抑制[8]。無論PET還是fMRI對靜息態腦功能的研究,都得到比較接近的默認模式的神經網絡。
基于ALFF的靜息態BOLD信號機制尚未完全清楚,一些研究表明可能與自發性神經活動有關[9]。靜息狀態幾乎沒有外界刺激存在,因此這種波被認為是自由的、非受控制的。Biswal等[10]發現腦灰質的低頻波幅度高于白質,Kiviniemi等[11]報道視覺皮質激活的低頻波幅在0.034Hz左右,同步測量靜息閉眼狀態下的腦電圖和BOLD信號表明,α波與視皮質自發BOLD信號呈負相關,因此,ALFF至少部分反映了神經自發性活動[12]。
許多研究顯示抑郁癥患者右側額葉電活動相對增高,左側額葉相對減低,而抑郁癥的特點是右側額葉調節功能紊亂、功能減低或不足。這種矛盾可以用半腦功能側化的理論來解釋:目前認為左側大腦半球用來組織明確簡單的內容,這個過程需要腦區的額外活動來限制目標及事件的自然聯系。右側大腦半球則用來組織模糊復雜的內容,需要有同時捕捉復雜信息的各個因素之間眾多自然聯系的能力。這種能力是保持心理健康、情緒平衡及身體健康的最重要特征。只要這種能力存在,便可以保護人們免受精神疾病包括抑郁癥。健康有創造力的個體在這個過程中不需要額外的皮質生理學激活;而對于抑郁癥患者,由于右側腦半球功能不足,使得抑郁癥患者發現自己處于非常復雜的、充滿矛盾的現實世界,而右側大腦隨之必須在缺少有效機制的情況下處理這種現實。同時,功能不足的右側大腦半球仍然更加敏感地接受復雜和充滿矛盾的現實世界,結果導致右側半球的超負荷運轉、生理學活動增強,造成抑郁癥患者缺少活力、悶悶不樂、郁悶等為主的癥狀。
生理活性的增加與血流的關系如何,并沒有得到明確的結論。PET對靜息態血流分析結果差異較大,Drevets[13]應用PET檢測靜息狀態下抑郁癥患者(發作期)和抑郁癥家族成員以及正常對照組腦血流量和葡萄糖代謝的情況,結果發現抑郁癥患者從左腹外側前額葉皮質到內側前額皮質表面的區域和杏仁核的腦血流量增加。而且在研究中發現只有抑郁發作期的患者有左側前額葉皮質血流和葡萄糖代謝的增加,而處于抑郁緩解期的抑郁癥家族成員則沒有這種改變,從而認為左側前額皮質血流增加是抑郁癥的一種狀態標志;而Mayberg等[14]研究則表明MDD靜息態前額葉皮質活動性較正常對照組減低。對于治療前后比較,研究大多顯示,抑郁癥的嚴重程度與該區的代謝呈正相關,而且隨著治療有效反應代謝的異常增高可以減少到正常范圍。
靜息態fMRI是讓受試者處于清醒、放松、盡量不做任何思考的狀態進行掃描,最大限度消除了外界影響,結果相對穩定、一致。本研究結果表明在靜息狀態下,基于ALFF的BOLD信號MDD患者較正常人明顯減低。經過8周的有效抗抑郁治療后,治療前相對減低右側前額葉腹內側皮質、雙側前額葉背外側皮質、右側眶額葉,右側顳極,雙側扣帶回后部等腦區有所恢復。BOLD信號可以部分反映血流情況,因此本研究顯示抑郁癥患者右側前額葉腹內側皮質、雙側前額葉背外側皮質、右側眶額葉、右側顳極、雙側扣帶回后部等腦區靜息態腦血流減低可能是MDD的一個特征性改變,筆者同時進行的DTI研究結果顯示的FA值減低區主要位于右側腦白質區,兩者具有一致性。由于DTI與靜息態fMRI均為相對客觀的指標,因此可以推斷,抑郁癥患者右側大腦半球的功能紊亂伴隨廣泛區域的腦白質纖維的一致性減低及腦血流的減低。
總之,本研究表明治療有效的首發抑郁癥患者靜息態腦功能區的異常變化是可逆的;基于ALFF的靜息態fMRI可以作為觀察抗抑郁藥物療效的一個相對客觀的生物學指標,為臨床更客觀地動態評價抗抑郁藥物療效開辟一條新的思路。
1.Mazoyer B,ZagoL,Mellet E,et al.Cortical networks for working memory and executive functions sustain the conscious resting state in man.Brain Res Bull,2001,54:287-298
2.Gusnard DA,Raichle ME.Searching for a baseline:functional imaging and the resting humanbrain.Nat Rev Neurosci,2001,2:685-694
3.Raichle ME,MacLeod AM,Snyder AZ,et al.A default mode of brain function.Proc Natl AcadSci USA,2001,98:676-682
4.ZangY,JiangT,Lu Y,et al.Regional homogeneityapproach to fMRI data analysis.Neuroimage,2004,22:394-400
5.AnandA,Li Y,Wang Y,et al.Activity and connectivity of brain mood regulating circuit in depression:a functional magnetic resonance study.Biol Psychiatry,2005,57:1079-1088
6.Lowe MJ,Dzemidzic M,Lurito JT,et al.Correlations in lowfrequencyBOLD fluctuations reflect cortico-cortical connections.Neuroimage,2000,12:582-587
7.Yang H,Long XY,Yang Y,et al.Amplitude of low frequency fluctuation within visual areas revealed byresting-state functional MRI.Neuroimage,2007,36:144-152
8.Gusnard DA,Raichle ME.Searching for a baseline:functional imaging and the resting human brain.Nat Rev Neurosci,20012:685-694
9.McCormick DA.Spontaneous activity:signal or noise.Science,1999,285:541-543
10.Biswal BB,Yetkin FZ,Haughton VM,et al.Functional connectivityin the motor cortex of restinghuman brain usingechoplanar MRI.Magn Reson Med,1995,34:537-541
11.Kiviniemi V,Jauhiainen J,Tervonen O,et al.Slow vasomotor fluctuation in fMRI of anesthetized child brain.Magn Reson Med,2000,44:373-378
12.Logothetis NK,Pauls J,Augath M,et al.Neurophysiological investigation of the basis of the fMRI signal.Nature,2001,412:150-157
13.Drevets WC.Prefrontal cortical-amygdalar metabolism inmajor depression.Ann N Y Acad Sci,1999,877:614-637
14.MaybergHS,Brannan SK,Tekell JL,et al.Regional metabolic effects of fluoxetine in major depression:Serial changes and relationship to clinical response.Biol Psychiatry,2000,48:830-843

