氧化應激損傷反應在冠心病心肌缺血血瘀證中的實驗研究*
王 勇,王思軒,李 春,啜文靜,郭淑貞,趙慧輝,陳建新,余俊達,王 偉
(北京中醫藥大學基礎醫學院藥理室,北京 100029)
本實驗通過冠狀動脈環縮術建立慢性心肌缺血模型,動態全面地觀察各組動物心肌缺血后Cyto C、SOD、MDA、NO及 TNF-α 的變化,探討冠心病慢性心肌缺血血瘀證起病發病的早期病理機制與氧化應激、炎癥、內皮障礙的關系。
1 材料
1.1 動物與分組
動物為中國農業大學育種健康雄性中華小型豬,體重26 kg±5 kg,月齡6~10個月,隨機分為假手術組、模型組2組,動物各12只。
1.2 材料、試劑與儀器
內徑2.75mm的Ameroid縮窄環(Research Instrument SW,USA);安爾碘(上海利康消毒高科技有限公司,批號20050808);鹽酸氯胺酮注射液(江蘇恒瑞醫藥股份有限公司,批號KH050302);Cyto C、SOD、MDA、NO 及 TNF-α 試劑盒(北京華英生物技術研究所)。
2 方法
2.1 中華小型豬冠心病(心肌缺血)模型的建立及證候評價
動物麻醉后輔助呼吸,暴露左冠狀動脈前降支,兩線平移牽引法在第一對角支遠端的前降支主干上放置Ameroid縮窄環,建立慢性心肌缺血模型[5]。術后0~8周對動物進行全面觀察,采集包括舌象在內的詳細四診信息,并通過心電圖、冠脈造影等輔助手段進行評價。根據1986年中國中西醫結合學會活血化瘀專業委員會制訂的血瘀證診斷標準,明確術后4周動物表現為穩定的冠心病(心肌缺血)血瘀證的時間點,并在術后4~8周血瘀證表現呈穩定狀態[1]。
2.2 SOD、MDA、Cyto C、TNF-α 和 NO 的測定
小型豬術前、術后4、8周,行冠狀動脈造影和心功能檢查后,分別在頸部前腔靜脈采血5mL,肝素抗凝(抗凝劑:100μL/5mL全血),血漿用于檢測SOD、MDA、Cyto C、TNF-α 和 NO 水平。樣品在室溫復溶后,采用ELISA法檢測。操作嚴格按照試劑盒說明書。
2.3 統計學處理
用SPSS 11.5軟件進行統計分析,結果以均數±標準差(s)表示。組間比較采用成組t檢驗,組內比較采用單因素方差分析。相關分析采用Pearson法,P<0.05為差異有統計學意義。
3 結果
3.1 一般資料
手術4周后,假手術組動物精神逐漸恢復正常;采進、飲水量增加,被毛整齊,有光澤。模型動物易激惹,不易接近,抓取時反抗劇烈,叫聲高亢、持續時間長,沖撞籠欄,被毛疏松雜亂豎立、無光澤,鼻盤干燥少津,舌質紫暗,前后蹄出現肌膚甲錯等血瘀證候體征。
3.2 病理觀察結果
圖1顯示,大體病理觀察左室腔擴大,左室前壁變薄的改變與超聲心動的結果一致。病理切片HE染色提示,膠原纖維增生、心肌細胞變性、壞死、炎性細胞侵潤等病理改變與心肌缺血的診斷吻合。
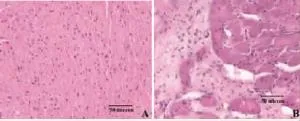
圖1 模型與假手術術后4周心肌組織HE病理切片變化(HE×400)
3.3 4周后舌色變化
表1圖2顯示,采用 Photoshop7.0對數碼相機拍攝的舌質圖片進行分析,R、G、B比的分析結果顯示,與同期假手術組動物相比,模型組動物術后4~8周R比顯著降低(P<0.05),G比、B比顯著升高(P<0.05),提示動物舌色從紅到青紫的演變與肉眼觀察結果一致。
3.4 氧化應激相關指標的變化
表1 0~8周模型組舌尖r、g、b值(s)

表1 0~8周模型組舌尖r、g、b值(s)
注:與同時間點假手術組比較:▲P<0.05
周數 組 別 n r G b 4周 假手術組12 0.47±0.110 0.26±0.041 0.25±0.076模 型 組 12 0.38±0.032▲0.30±0.01▲ 0.32±0.018▲0.30±0.015 8周 假手術組 12 0.43±0.043 0.28±0.024 0.29±0.028模 型 組 12 0.39±0.016▲ 0.31±0.017▲

圖2 假手術與模型組動物術后4周舌色改變
表2顯示,與同期假手術組動物比較,模型組動物抗氧化酶活性下降,表現為 SOD升高16.94%,MDA升高20.32%,差異顯著(P<0.05),并發現作為呼吸鏈上的重要節點分子的Cyto C發生了顯著改變,升高了 50.79%。術后 4周和 8周模型組TNF-α、NO濃度與同期假手術組動物相比差異顯著(P<0.05)。
3.5 氧化應激指標與 TNF-α、NO之間的相關性分析
將 SOD/MDA、Cyto C的濃度與 TNF-α、NO濃度分別進行相關性分析。結果表明,炎癥反應的特征分子TNF-α濃度與Cyto C呈顯著正相關(y=12.804x-12.411,R2=0.9031),與 SOD/MDA 呈顯著負相關(y= -11.702x+38.051,R2=0.992),而作為反映內皮功能重要指標的NO與Cyto C呈負相關(y=-0.1732x+17.319,R2=0.99),與 SOD/MDA 呈正相關(y=0.1386x+11.972,R2=0.8403)。
表2 術后4~8周機體氧化應激相關指標的變化(s)

表2 術后4~8周機體氧化應激相關指標的變化(s)
注:與假手術組比較:▲P<0.05
組別n Cyto C(ng/ml)SOD(pg/ml)MDA(ng/ml)NO(pg/ml)TNF-α(ng/ml)假手術組4周 12 5.67±1.530 103.24±5.348 5.12±0.907 63.47±7.060 1.22±0.760假手術組8周 12 5.20±1.457 100.59±11.146 5.41±0.356 66.03±4.324 1.24±0.338模 型 組4周 12 8.55±1.329▲ 85.75±18.029▲ 5.75±0.910▲ 50.57±6.334▲ 1.67±0.458▲模 型 組8周 12 8.77±2.529▲ 88.97±16.084▲ 5.91±0.697 49.39±7.038▲ 1.61±0.432▲
4 討論
血瘀證是中醫臨床常見證型,已成為中西醫結合學術研究最受國內外關注的領域之一[2]。基礎研究主要集中在血瘀證與炎癥、內皮功能障礙等方面。其中炎癥反應與內皮功能障礙引起相關分子的失衡被認為是血瘀證重要的生物學基礎,TNF-α與NO作為炎癥反應與內皮功能障礙的特異性分子得到了深入的研究。本課題組前期通過數據挖掘的方法提起TNF-α與NO的特征模式診斷血瘀證有很高的準確性,氧化應激作為誘導心血管功能異常的病理機制,與炎癥反應與內皮障礙關系密切,可啟動炎癥或加重炎癥反應,惡化內皮功能,從而成為血瘀證可能的生物學基礎。本實驗通過對冠心病慢性心肌缺血血瘀證模型的動態觀察,對氧化應激在血瘀證早期可能扮演的角色及其與炎癥反應、內皮功能障礙之間的關系進行探討,以期發現氧化應激在血瘀證病理機制中的作用,為血瘀證診斷特征模式的完善提供新的參考指標。
在正常情況下,機體氧化應激反應產生的活性氧簇(ROS)的速度與清除速度保持平衡,血管最主要的ROS是超氧陰離子(·O-2),而抗氧化方面SOD可以歧化·O-2生成H2O。但是當產生的活性氧簇超出抗氧化劑清除能力的時候,就會導致其生物利用度增加,·O-2和NO的反應產物過氧化亞硝酸鹽是強氧化劑分子,使血管舒張因子NO失活,內皮源性NO減少,導致內皮細胞功能障礙,血管收縮性增強,單核細胞浸潤及炎癥[3、4]。由于·O-2半衰期相當短,通常以易于測量的氧化產物 MDA來反映ROS的含量[9],作為機體氧化應激程度的評估。
本研究證實,術后4周模型動物舌色從紅到青紫演變,血液流變學異常,并結合動物宏觀體征與行為學判別為血瘀證[5],而 SOD、MDA、Cyto C 也與血瘀證形成的初期發生了顯著的變化,提示血瘀證初期機體氧化/抗氧化系統失衡,氧化應激反應在早期即參與了血瘀證的啟動與形成[6]。而 Cyto C作為呼吸鏈上的關鍵節點分子出現較早,持續時間長(至8周),升高幅度最大,達到50.79%,且與 SOD、MDA呈線性關系,敏感性較高,故可選為反應氧化應激損傷程度較為理想的觀測指標。
此外實驗顯示,在冠心病心肌缺血血瘀證病證結合動物模型造模成功后,機體同時出現炎癥反應與內皮功能障礙,并與氧化應激損傷程度高度相關。炎癥標志物TNF-α濃度與Cyto C呈強烈正相關,與SOD/MDA呈強烈負相關,而作為反映內皮功能重要指標的 NO與Cyto C呈負相關,與 SOD/MDA呈正相關,說明氧化應激與炎癥反應彼此間相互協調、相互促進,共同作用于血管內皮細胞和其他病理環節,加重內皮功能的惡化,加劇血瘀證的臨床表現。可見,在血瘀證的形成與發展過程中,氧化應激損傷反應與炎癥反應、內皮功能障礙相互作用,互為因果,形成了血瘀證早期可能的內在病理機制,三者之間消長平衡決定了血瘀證可能的證候演變與轉化。通過早期干預氧化應激相應的環節,減輕氧化應激反應的程度,可有效地保護血管內皮功能,降低炎癥反應的水平,改善血瘀證的臨床癥狀,為臨床冠心病血瘀證的治療提供新的干預環節。
[1]郭淑貞,王偉,劉濤,等.小型豬冠心病(心肌缺血)血瘀證模型血液流變學及超聲評價[J].中華中醫藥學刊,2007,25(4):702-706.
[2]劉軍蓮,宋劍南.中醫血瘀證本質研究概況[J].遼寧中醫雜志,2006 ,33(9):1061-1063.
[3]Touyz RM,Schiffrin E L.Reactive oxygen species in vascular biology:implications in hypertension[J].Histochem Cell B iol,2004,122(4):339-52.
[4]洪浩,劉國卿.缺血性腦血管疾病治療的抗氧化應激策略[J].中國藥理學通報,2004,20(1):19-24.
[5]KasugaM Insulin resistance and pancreatic B cell failure[J].JCli Invest,2006,116:1756-1760.
[6]扈新剛,張允嶺,鄭宏,等.氣虛血瘀大鼠模型糖、脂代謝及氧化應激反應研究[J].北京中醫藥大學學報,2009,32(4):249-251.

