慢性腎功能衰竭患者認知功能障礙與血漿HSP70的相關性研究
李建平 趙 中*
(1 蘇州高新區人民醫院神經內科,江蘇 蘇州 215129,2 蘇州市立醫院東區神經內科,江蘇 蘇州 215000)
據國際腎臟病協會統計,慢性腎功能衰竭(chronic renal failure,CRF)自然人群年發病率為98~198人/百萬人口,且每年以8%左右的速度遞增[1]。CKD進行性進展引起腎單位和腎功能不可逆地喪失,導致以代謝產物和毒物潴留、水電解質和酸堿平衡紊亂以及內分泌失調為特征的臨床綜合征稱為慢性腎功能衰竭(CRF),CRF常常進展為終末期腎病(end-stage renal disease,ESRD),CRF晚期稱之為尿毒癥(uremia)。而慢性腎功能衰竭患者存在著記憶力減退、注意力不集中、反應遲鈍、工作效率降低以及思維不靈活、分類概括能力降低等認知能力下降,臨床上發現隨著腎功能的惡化,中樞神經受累的癥狀出現的越來越明顯。尿毒癥性腦病早期表現為注意力不集中、嗜睡、失眠;隨后發生輕度行為異常、記憶力減退、判斷錯誤等癥狀[2],臨床上對此類患者的診斷主要依靠神經影像學及神經心理學,僅有少數研究涉及血液生物化學指標的檢測,其中熱休克蛋白(heat shock protein,HSP)70就是近年來的研究熱點[3],HSP70作為一種重要的應激蛋白,對神經損傷具有保護作用,其中含量變化與腦損傷程度密切相關。本研究旨在探討慢性腎功能衰竭患者認知功能障礙與HSP70的相關性。
1 資料與方法
1.1 研究對象
與2009年8月至2011年6月在本院腎內科入住的慢性腎功能衰竭患者(所選擇患者均符合美國K/DOQI指南CKD5期標準)[4]118例,排除視力、聽力、肢體嚴重功能障礙而不能完成量表檢測的患者,實際納入對象100例。其中男49例(49%),女51例(51%),年齡(58.32±11.12)歲,文化程度為文盲8例(8%),小學44例(44%),中學、中專、大專30例(30%),大學及以上18例(18%)。
1.2 研究方法
1.2.1 神經心理學量表檢查
①調查工具:蒙特利爾認知評估量表 (Montreal Cognitive Assessment,MoCA)[5],該量表是由Nasreddine ZS等編制的專用認知功能篩查工具,包括視空間執行能力、命名、記憶、注意、語言流暢、抽象思維、延遲記憶、定向力方面的認知評估,共計30分,如果受試者受教育年限少于12年者,在測試結果上加1分,校正文化程度的偏倚,得分越高認知功能越好,26分或以上為正常,測試時間約10min。②調查方法:所有調查均由作者本人按照調查要求完成,調查時采用統一調查表和標準化調查用語,對入組患者進行MoCA測試。為避免干擾,所有調查均為單獨與老年人交談測試完成。
1.2.2 分組
按MoCA評分結果分組,MOCA總分≥26分為認知功能正常組(Not Cognitively Impaired, CRF-NCI),共50例,平均年齡(58.86±12.24)歲;MOCA總分<26分為慢性腎功能衰竭伴認知功能障礙組(CRF-CI組),共50例,平均年齡(58.50±12.96)歲。
1.2.3 血液標本收集及HSP70測定
清晨抽取空腹靜脈血2ml,肝素抗凝,1500r/min離心10min,完全分離血漿,保存于-80℃冰箱待測。采用兔抗人HSP70 ELISA 試劑盒(美國Adlitteram Diagnostic Laboratories)檢測血漿HSP70,檢測步驟嚴格按照說明書操作,具體有12個步驟如下。①準備:從冰箱取出試劑盒,室溫復溫平衡30min;②配液:用蒸餾水將20倍濃縮洗滌液稀釋成原倍的洗滌液;③加標準品和待測樣本:取足夠數量的酶標包被板,固定于框架上,分別設置標準品孔、待測樣本孔和空白對照孔,記錄各孔位置,在標準品孔中加入標準品50μL,待測樣本孔中先加入待測樣本10μL,再加樣本稀釋液40μL(即樣本稀釋5倍),空白對照組不加;
④溫育:37℃水浴鍋或恒溫箱溫育30min;⑤洗板:棄去液體,吸水紙上拍干,每孔加滿洗滌液,靜置1min,甩去洗滌液,吸水紙上拍干,如此重復洗板4次;⑥加酶標工作液:每孔加入酶標工作液50μL,空白對照孔不加;⑦溫育:重復④的操作;⑧洗板:重復⑸的操作;⑨顯色:每孔先加入顯色劑A液50μL,再加入顯色劑B液50μL,37℃避光顯色15min;⑽終止:取出酶標板,每孔加終止液50μL,終止反應(顏色由藍色立轉黃色);⑾測定:以空白孔調零,在終止后15分鐘內,用450nm波長測量各孔的吸光值(OD值);⑿計算:根據標準品的濃度及對應的OD值,計算出標準曲線的直線回歸方程,у=-0.0913,Х+0.4421,R2=0.6919,再根據樣本的OD值,在回歸方程上計算出對應的樣本濃度。
1.3 統計分析
所有數據均由SPSS13.0統計軟件包處理。檢測數據采用均數±標準差(±s)表示,定量資料比較采用t檢驗,定性資料比較采用χ2檢驗,相關性分析采用Pearson相關分析和多元線性回歸分析。P<0.05,具有統計學意義。
2 結 果
2.1 一般資料
CRF-NCI組和CRF-CI組患者在性別、年齡、受教育年限以及吸煙、糖尿病、高血壓、高血脂、腦卒中史等方面比較無明顯差異性(P>0.05,表1),具有可比性。
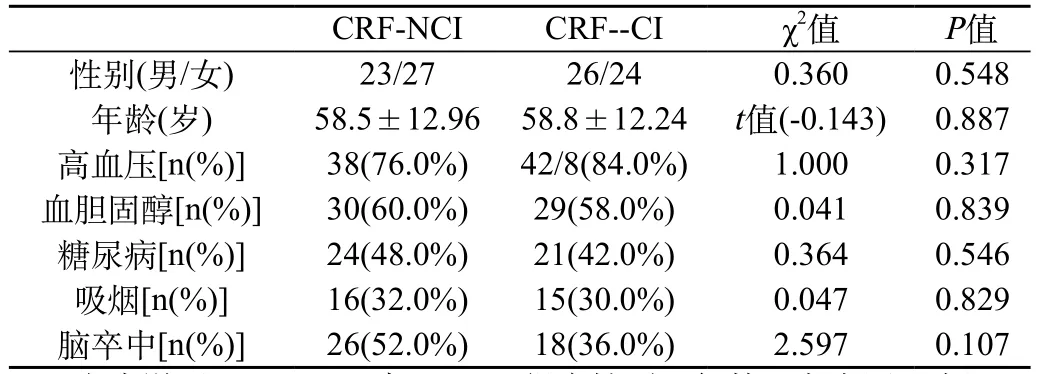
表1 CRF-NCI與CRF-CI組基本臨床特征
上表說明:CRF-NCI與CRF-CI組在性別、年齡、高血壓、血膽固醇、糖尿病、吸煙、腦卒中等方面無統計學差異(P>0.05),具有可比性。
2.2 CRF-NCI組和CRF-CI組患者血漿HSP70濃度比較
在校正性別、年齡、吸煙、受教育程度以及既往疾病史等變量后,CRF-CI組患者HSP70濃度[(17.38 ± 5.38)ng/mL]明顯高于CRFNCI 組[(10.37 ± 2.86)ng/mL](P<0.01),差異具有統計學意義。
2.3 CRF-CI患者血漿HSP70濃度與MoCA分值的相關性
對認知功能障礙組患者血漿HSP70濃度和MoCA評分進行相關性分析后發現,認知功能障礙組患者血漿HSP70濃度和MoCA 得分呈負相關(r=-0.674,P=0.0001)。從圖1可見,有4名患者MoCA評分和血漿HSP70濃度均較低,明顯偏離直線,考慮為偏離較大的變量值。
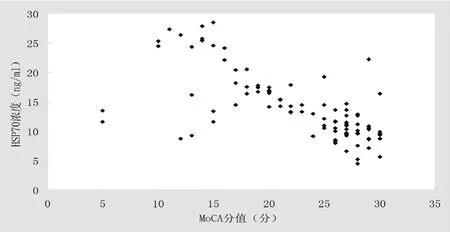
圖1 HSP70濃度和MoCA得分散點圖
2.4 認知功能障礙患者血漿HSP70濃度與各個認知領域的相關性
對認知功能障礙患者各個認知領域的分值與血漿HSP70濃度進行多元線性回歸分析發現,血漿HSP70與患者記憶能力、語言、抽象存在相關性(P<0.05),而與視空間執行能力、命名能力、注意能力和定向能力無相關性,見表2。
CRF-CI組患者HSP70濃度與各個認知領域的相關性:對CRF-CI組患者各個認知領域的分值與血漿HSP70 水平進行多元線性回歸分析發現,血漿HSP70 水平與患者記憶能力、語言、抽象存在相關性(P<0.05),而與其他能力無相關性。具體見表2與表3。
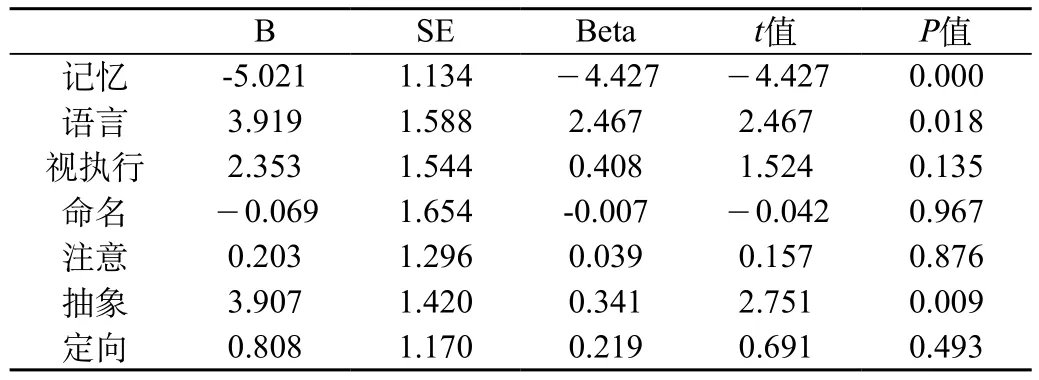
表2 血漿HSP70與患者記憶能力、語言、抽象等關系
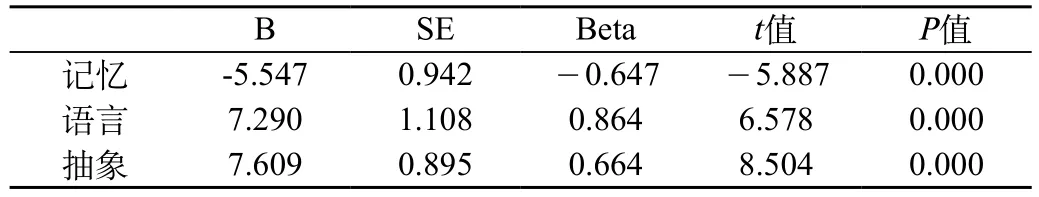
表3 血漿HSP70 水平與患者記憶能力、語言、抽象關系
3 討 論
慢性腎功能不全早期,認知功能的降低常表現為乏力、反應遲鈍等非特異性臨床癥狀,隨著腎功能的惡化,可逐漸出現記憶力減退、注意力不集中、反應遲鈍、思考緩慢、工作效率降低,以及思維不靈活、分類概括能力降低等,且與軀體和心理因素有關。因此,很多學者將腎功能不全看作為認知功能損害和癡呆的獨立危險因素[6-8]。慢性腎功能衰竭患者出現 認知功能損害的主要原因有:①慢性腎功能衰竭患者多伴有高血壓、高血脂及動脈粥樣硬化(包括顱內微血管動脈硬化),而這些因素是引起血管性認知功能損害的主要危險因素[9]。②毒素潴留中毒,肌酐、尿素氮作為小分子量毒物,在腎功能不全時排出減少并在體內蓄積,抑制了參與腦細胞正常代謝活動的酶系統,使其反應速度減慢,從而引起認知功能損害;③電解質紊亂,慢性腎功能不全常伴血鈉和血漿滲透壓降低,因而產生腦水腫,從而產生明顯腦功能障礙。
HSP70主要是在機體遭受各種應激性刺激(包括缺血、缺氧、驚厥、外傷等創傷)后誘導產生的一種熱休克反應蛋白,其表達的強度可在一定程度上反映神經細胞損傷程度及對損傷的耐受性,故是腦損傷較敏感的指標[10]。另有文獻報道[11],HSP70可以通過維持細胞內蛋白質的正常功能,促進氧自由基等有害物質清除,抑制促細胞凋亡蛋白的功能及提高抗凋亡蛋白的表達水平而抑制細胞凋亡發揮其腦保護作用,提示損傷腦區HSP70的高表達既是腦損傷的敏感指標,也可能減輕腦組織損傷而發揮神經元保護作用。而慢性腎功能衰竭患者可有多種因素引起腦損害。因此,慢性腎功能衰竭患者可能導致血漿HSP70濃度升高。
本研究顯示,慢性腎功能衰竭患者HSP70 濃度顯著高于正常對照組(P<0.01),且HSP70 濃度與MoCA 評分呈負相關,即慢性腎功能衰竭患者血漿HSP70濃度越高,MoCA 分值越低,提示HSP70 濃度的改變可以反映慢性腎功能衰竭患者認知功能損害的程度。推測其機制可能為:①慢性腎功能衰竭患者多伴有高血壓、高血脂及動脈粥樣硬化、腦卒中及腦白質疏松,而這些因素是引起血管性認知功能損害的主要原因。研究[12]顯示,血管性認知功能損害患者血漿HSP70濃度升高,且與MoCA評分呈負相關。②研究[13]顯示,HSP70陽性表達主要位于海馬、齒狀回、丘腦、杏仁核及大腦皮質等區,而這些部位是腦認知功能重要的結構基礎,其損害程度與認知功能下幅度相關。③多種因素可導致慢性腎功能衰竭患者出現腦損傷,而HSP70 被認為是損傷后腦組織產生的一種重要的內源性保護因子,其含量變化與腦損傷程度密切相關[14];因此,當慢性腎功能衰竭患者出現腦損害時,損害愈重,認知功能下降愈明顯,HSP70 升高也越顯著。
通過對慢性腎功能衰竭患者各個認知領域的分值與血漿HSP70 濃度進行多元線性回歸分析后發現,這些患者記憶能力、語言、抽象的損害情況與HSP70 的表達呈負相關,這可能是由于慢性腎功能衰竭患者腦功能的損害主要表現為記憶力下降,反應遲鈍,思考緩慢等,且呈進行性加重,所以與HSP70 的濃度變化趨勢存在相關性。至于是否存在其他機制,特別是導致語言功能損害的機制尚需進一步探討。
此外,圖1還可以看到有4個觀察點明顯偏直線 提示這些患者雖認知功能損害嚴重HSP70 的水平并未升高 與上述結論不完全相符考慮其原因可能為 部分患者可能為合并其他類型的認知功能損害。有研究發現阿爾茨海默病患者HSP70 水平表達下降[15]所以對于合并其他認知功能損害的患者HSP70 濃度能與認知功能損害程度不一致 Lee 等[16]研究示 在嚴重缺血的腦組織梗死區神經元和膠質細中無 HSP 表達 提示一些嚴重的腦缺血也可能出HSP 表達的下降。
總之,HSP70 作為一種非特異性細胞保護蛋白質,在慢性腎功能衰竭患者中表達增加,且與記憶功能、語言和抽象思維的損害有關,可以反映慢性腎功能衰竭患者的認知功能損害程度。血漿HSP70 濃度的測定有可能作為觀察慢性腎功能衰竭患者認知功能損害程度的生化指標,這對于慢性腎功能衰竭患者腦功能損害的早期診斷及指導下一步治療具有重要意義。
[1] 王海燕,王梅.慢性腎臟病及透析的臨床實踐指南[M].北京:人民衛生出版社,2003:22-23.
[2] 王吉耀,陳香美.內科學[M].北京:人民衛生出版社,2005.
[3] Hachinski V,Ladecola C,Pctersen RC,et al.National Institute of Neurological Disorders and Stroke-Canadian Stroke Network vascular cognitive impairment harmonization standards[J].Stroke,2006,37(9):2220-2241.
[4] National Kidney Foundation.K/DOQI clinical practice guidelines for chronic kidney disease: evaluation,classif i cation,and stratif i cation[J].Am J Kidney Dis,2002,39(2):S1-266.
[5] Nasreddine ZS,Phinips NA,Bedirian V,et a1.The Montreal Cognitive Assessment,MoCA:a brief screening tool for mild cognitive impairment[J].J Am Geriatr Soc,2005,53(4):695-699.
[6] Kurella M,Chertow GM,Fried LF,et al.Chronic kidney disease and cognitive impairment in the elderly: the health,aging,and body composition study[J].J Am Soc Nephrol,2005,16(7): 2127–2133.
[7] Kurella M,Yaffe K,Shlipak MG,et al.Chronic kidney disease and cognitive impairment in menopausal women[J].Am J Kidney Dis,2005,45(1): 66–76.
[8] Kurella Tamura M,Wadley V,Yaffe K,et al.Kidney function and cognitive impairment in US adults: the Reasons for Geographic and Racial Differences in Stroke (REGARDS) Study[J].Am J Kidney Dis,2008,52(2): 227–234.
[9] Pereira AA,Weiner DE,Scott T,et al.Cognitive function in dialysis patients[J].Am JKidney Dis,2005,45(4): 448–462.
[10] Soncin F,Zhang X,Chu B,et a1.Transcriptional activity and DNA binding of heat shock factor-1 involve phosphorylation on threonine142 by CK2[J].Biochem Biophys Res Commun,2003,303(2):700-706.
[11] Giffard RG,Yenari MA.Many mechamisms for hsp70 protection from cerebral ischemia[J].J Neurosurg Anesthesiol,2004,16(1):53-61.
[12] Lee KS,Chung JH,Oh BH,et al.Increased plasma levels of heat shock protein 70 in patients with vascular mild cognitive impairment[J].Neurosci Lett,2008,436(2):233-236.
[13] Higashi T,Takechi H,Uemura Y,et a1.Differential induction of mRNA species encoding several classes of stress proteins following focal cerebral ischemia in rats[J].Brain Res,1994,650(2):239-248.
[14] Fu ES,Tummala RP.Neuroprotection in brain and spinal cord trauma[J].Curt Opin Anaesthesiol,2005,18(2):181-187.
[15] Malyshev IY,W iegant FA,Mashina SY,et al.Possible use of adaptation to hypoxia in Alzheimer ’s disease:a hy- pothesis[J].Med Sci Monit,2005,11(8):31-38.
[16] Lee SH,Kim M,Yoon BW,et al.Targeted hsp70.1 disruption increases infarcion volume after focal cerebral ischemia in mice[J].Stroke,2001,32(12):2905-2912.

