RRM1表達與上皮性卵巢癌預后的相關性分析
盧飛飛,任婧婧,劉 寧,王黎明,王言奎,孫顯璐
(青島大學醫學院附屬醫院,山東青島 266003)
研究表明,影響卵巢癌預后的因素較多,如手術后分期、組織類型、細胞分化程度、淋巴結是否轉移、腹水中是否有癌細胞、腫瘤細胞減滅術是否滿意等因素均與卵巢癌預后密切相關。本研究就核糖核苷酸還原酶大亞基(RRM1)在上皮性卵巢癌中的表達及其與預后的相關性進行探討。
1 資料與方法
1.1 臨床資料 2004年 6月 ~2008年 12月本院收治原發上皮性卵巢癌患者 62例,年齡 21~75(47.1±13.5)歲,術前均未接受任何治療。組織學分級:高分化 8例、中分化 18例、低分化 36例;病理類型:漿液性腺癌 31例、黏液性腺癌 17例、內膜樣癌 6例、透明細胞癌 8例;FIGO分期:Ⅰ期 21例、Ⅱ期 5例,Ⅲ期 32例、Ⅳ期 4例。其中 57例有詳細隨訪資料(5例失訪),隨訪時間為 4~72個月,平均40.8個月。隨訪截止時間為 2010年 6月,至最后 1次隨訪 42例死亡。
1.2 方法 采用 PV-6000兩步法檢測 RRM1蛋白的表達,每批切片中均設陽性對照片和陰性對照片。免疫組化結果判斷標準參照文獻,采用二級評分法進行,由兩名分子病理醫師判定。每張切片隨機觀察 5個高倍視野,每個視野記數 100個癌細胞,根據染色程度和染色細胞所占百分比進行評分。顯色強度分為 4級:陰性(不著色),弱陽性(著淡黃色),陽性(著棕黃色),強陽性(著棕褐色或者出現粗大的棕褐色顆粒),以 0~3分分別代表不同顯色強度。著色陽性細胞占計數細胞 <5%為 0級(-),5%~25%為 1級 (+),26% ~50%為 2級 (++),>50%為 3級(+++)。用陽性強度評分乘以陽性腫瘤細胞比例評分得到最后的半定量 H值來衡量最終的蛋白表達強度:乘積 >4者為陽性表達(高表達),0~3者為陰性表達(低表達)。
1.3 統計學方法 采用 SPSS17.0分析軟件包,單因素生存分析采用 Kaplan-Meier方法,運用 COX風險比例模型對預后進行單因素、多因素分析。P≤0.05為差異有統計學意義。
2 結果
2.1 RRM1蛋白表達與上皮性卵巢癌臨床病理參數之間的關系 見表1。
2.2 RRM1蛋白表達與上皮性卵巢癌預后的關系RRM1陰性表達組 (23例)5 a累積生存率為13.04%,陽性表達組(39例)5 a累積生存率為35.90%。Kaplan-Meier生存曲線分析顯示,RRM1陽性與陰性表達者生存率比較無統計學差異(χ2=0.155,P>0.05)。 Ⅰ ~Ⅱ期卵巢癌中 RRM1陽性表達者較陰性表達者生存率高(χ2=4.111,P<0.05),Ⅲ ~Ⅳ期卵巢癌中 RRM1陽性表達者較陰性表達者生存率低(χ2=8.947,P<0.05)。
2.3 影響上皮性卵巢癌預后的危險因素 COX模型單因素分析顯示,腹水、FIGO分期Ⅲ ~Ⅳ期、癌組織低分化、淋巴結轉移、殘癌灶直徑≥2 cm、大網膜轉移及 RRM1表達 +低分化在預后分析中具有統計學意義(P均 <0.05)。多因素分析顯示 FIGO分期Ⅲ ~Ⅳ期、淋巴結轉移及 RRM1表達 +低分化為卵巢癌總生存期的獨立危險因素;RRM1表達 +低分化者死亡危險度是非 RRM1表達 +低分化者的4.252倍。見表2。
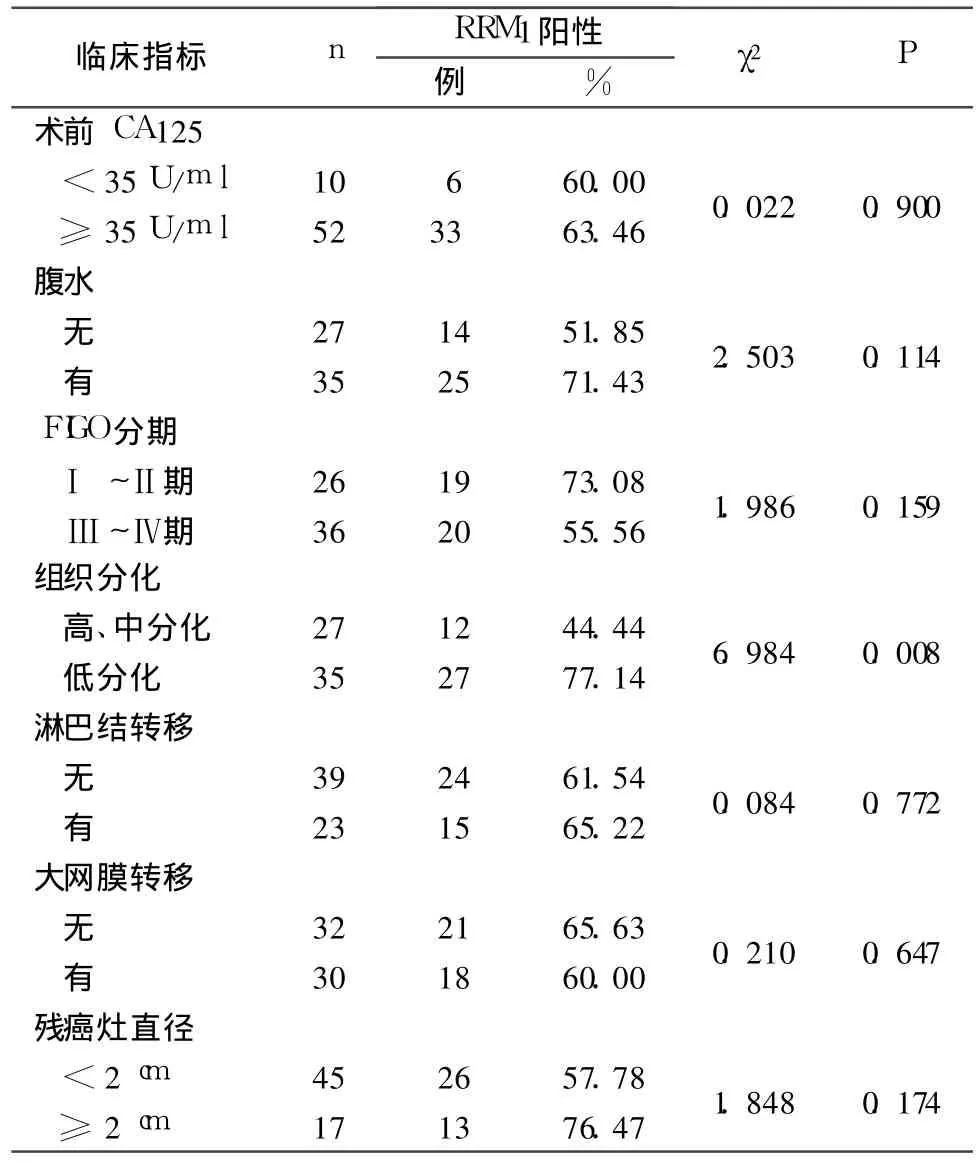
表1 RRM 1蛋白與上皮性卵巢癌臨床病理特征的關系
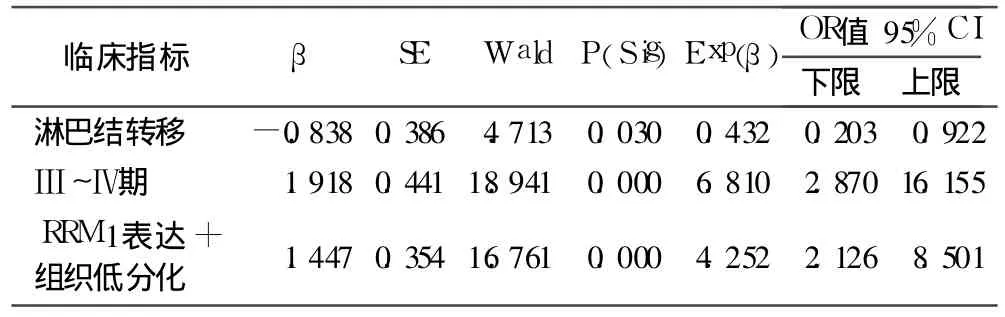
表2 上皮性卵巢癌預后影響因素的多因素COX回歸分析
3 討論
核糖核苷酸還原酶(RR)是 DNA通路中合成和修復的限速酶,腫瘤的形成和生長都和 DNA合成有關。RR由 M1和 M2兩個亞基構成,RRM1是腫瘤抑制基因[1,2]。RRM1可以激發 G2檢測點功能 ,增加 DNA損傷后的修復和凋亡,并可以抑制腫瘤細胞遷移和侵襲。研究報道,RRM1通過產生脫氧核苷酸和誘導磷酸酶和張力蛋白同源物產生來控制細胞增殖,阻止細胞遷移、浸潤和轉移[3]。本研究結果顯示 RRM1蛋白在低分化卵巢癌患者陽性表達率高于高、中分化患者,這表明 RRM1有可能參與了上皮性卵巢癌的發生和發展過程。
有學者認為 RRM1對惡性腫瘤的預后判斷具有一定的臨床價值。本資料中單因素生存曲線分析顯示,在Ⅰ ~Ⅱ期上皮性卵巢癌患者中,RRM1陽性表達者生存率比陰性表達者高,預后較好;而在Ⅲ ~Ⅳ期上皮性卵巢癌患者中,RRM1陽性表達者生存率低,預后較差,該結果與相關文獻研究結果一致[4~7]。其原因可能是 RRM1在腫瘤的不同臨床分期中的作用機制不同。在早期癌癥中 RRM1可能作為一種腫瘤抑制基因阻止細胞遷移、浸潤和轉移,從而出現 RRM1陽性表達者較陰性者預后好;而在晚期癌癥患者中,RRM1可能對一些化療后受損的癌細胞起到修復作用并保護腫瘤細胞逃避化療藥物誘導的凋亡,從而造成 RRM1陽性表達者預后差[8]。文獻報道,RRM1表達不能作為腫瘤患者預后的獨立影響因素[9,10],本研究結果與此一致。COX回歸模型多因素分析,RRM1陽性表達 +癌組織低分化者死亡危險度是非 RRM1陽性表達 +癌組織低分化者的 4.252倍,這表明 RRM1對預后的評價具有一定的指導意義。
綜上所述,RRM1對上皮性卵巢癌的診斷及預后評價具有一定的參考價值。但 RRM1在腫瘤不同臨床分期中的作用機制有待于進一步研究。
[1]Gautam A,Li ZR,Bepler G.RRM1-induced metastasis suppression through PTEN-regulated pathways[J].Oncogene,2003,22(14):2135-2142.
[2]Olaussen KA,Dunant A,Fouret P,et al.DNA repair by ERCC1in non-small-cell lung cancer and cisplatin-based adjuvant chemotherapy[J].N Engl J Med,2006,355(10):983-991.
[3]Bepler G,Zheng Z,Gautam A,et al.Ribonucleotide reductase M1 gene promoter activity,polymorphisms,population frequencies,and clinical relevance[J].Lung Cancer,2005,47(2):183-192.
[4]Zheng Z,Chen T,Li X,et al.DNA synthesis and repair genes RRM1 and ERC-C1 in lung cancer[J].N Engl JMed,2007,356(8):800-808.
[5]Bepler G,Sharma S,Cantor A,et al.RRM1 and PTEN as prognostic parameters for overall and disease-free survival in patients with nonsmall-cell lung cancer[J].J Clin Oncol,2004,22(10):1878-1885.
[6]陳芹,周彩存,張頡.ERCC1、RRM1和 BRCA1在非小細胞肺癌中的表達及預后意義[J].腫瘤,2007,27(09):719-722.
[7]Rosell R,Danenberg KD,Alberola V,et al.Ribonucleotide reductase messenger RNA expression and survival in gemcitabine/cisplatin-treated advanced non-small cell lung cancer patients[J].Clin Cancer Res,2004,10(4):1318-1325.
[8]HenseIM,Weiss A,Sinnhp A,et al.p53 is the strongest predictor of survival in high-risk primary breast cancer patients undergoing high-dosechemotherapy with autologous blood stem cell support[J].Int J Cancer,2002,100(3):290-296.
[9]Souglakos J,Boukovinas I,Taron M,et al.Ribonucleotide reductase subunits M1 and M2 mRNA expression levels and clinical outcome of lung adenocarcin-oma patients treated with docetaxel/gemcitabine[J].Br JCancer,2008,98(10):1710-1715.
[10]Gabriella F,Valentina M,Sara N,et al.Expression of nucleoside transporters,deoxycitidine kinase,ribonucleotide reductase regulatory subunits,and gemcitabine catabolic enzymes in primary ovarian cancer[J].Cancer Chemother Pharmacol,2010,65(4):679-686.

