CXCR7-shRNA慢病毒表達載體對人結腸癌細胞生物學特性的影響
王紅鮮,陶霖玉,齊 柯,向 紅,張好云,馮 鐸,孔 恒,林秋生,陳天文
(廣東醫學院附屬南山醫院,廣東深圳 518052)
研究發現,CXCR7不僅能提高許多腫瘤細胞的生存和生長活力,還能增強其黏附和遷移能力。應用 CXCR7拮抗劑還可抑制實驗動物體內腫瘤的生長和轉移[1],但 CXCR7對人結腸癌細胞生物活性的影響未見報道。本研究以人結腸癌 HT-29細胞系為研究對象,運用 CXCR7-shRNA慢病毒表達載體沉默 CXCR7基因的表達,觀察其對 HT-29細胞的生長和遷移的影響。
1 材料與方法
1.1 材料 人結腸癌細胞 HT-29由中南大學湘雅醫學院細胞中心提供,采用 RPMI 1640和 DMEM完全培養基(均含 10%小牛血清,100 U/ml青霉素和100μg/ml鏈霉素),置 5%CO2的 37℃飽和濕度的培養箱內培養。CXCR7-shRNA慢病毒表達載體根據人 CXCR7序列(GeneBank,NM_020311)設計 siRNA靶點序列,合成 shRNA引物序列[2];陰性無關對照序列的 shRNA重組質粒標準品由 Trono Lab提供。Rabbit anti-CXCR7多克隆抗體、Rabbit anti-GAPDH多克隆抗體及辣根過氧化酶(HRP)標記Goat anti-Rabbit IgG由 Abcam公司提供,RIPA蛋白裂解液(強)、PMSF蛋白酶抑制劑由碧云天生物技術有限公司提供,ECL化學發光試劑盒購自美國Upstate公司。
1.2 方法 ①實驗分組:將人結腸癌細胞 HT-29分成 3組:實驗組:轉染慢病毒 CXCR7-shRNA表達載體;陰性對照組:轉染慢病毒 shRNA陰性對照載體;空白對照組:不予任何處理。②細胞轉染:轉染前 24 h將生長狀態良好的 HT-29細胞接種于 6孔細胞培養板中,當細胞密度為 60%~75%時,實驗組和陰性對照組細胞中分別加入相應的病毒上清液(轉染復數 =感染時病毒/細胞數量 =20),收取轉染效率在 80%以上的目的細胞。③HT-29細胞中CXCR7蛋白表達檢測:采用 Western blot法,以 IODCXCR7/GAPDH計算 CXCR7蛋白的相對表達量。④HT-29細胞增殖能力檢測:采用噻唑藍(MTT)法,取值以各測試孔的 OD值減去本底 OD值為標準。⑤Transwell細胞遷移實驗:在 Transwell下室的DMEM培養液中加入 NIH3T3上清作為遷移誘導因子,在 Transwell上室滴加 200μl 1×104HT-29細胞懸液。將上室置于下室之中,在 37℃溫箱孵育。24 h后取出上室,經 PBS洗滌后,用 4%多聚甲醛固定遷移至上室外表面上的細胞,HE染色,計算遷移細胞數,結果取上、下、左、右、中 5個視野(400×)細胞計數的平均值。
1.3 統計學方法 采用 SPSS13.0統計軟件,結果用±s表示,多組間比較用單因素方差分析,兩組間比較用 S-N-K法。P≤0.05為差異有統計學意義。
2 結果
2.1 HT-29細胞中 CXCR7蛋白表達水平 各組HT-29細胞中 CXCR7蛋白表達見圖1,顯示在以LV-CXCR7-shRNA轉染的實驗組 HT-29細胞中,CXCR7蛋白表達水平均低于陰性對照組和空白對照組(P均 <0.05),而陰性對照組和空白對照組比較無統計學差異(P>0.05),提示慢病毒 CXCR7-shRNA表達載體能有效降低 HT-29細胞中 CXCR7蛋白的表達。
2.2 細胞增殖能力 各組 HT-29細胞分別于接種后第 1~5天每天以 MTT法檢測細胞密度(OD值),見表1,并根據檢測的 OD值繪制細胞的生長曲線(圖 2)。結果顯示實驗組生長曲線較平緩,細胞生長速度較陰性對照組和空白對照組顯著降低(P均 <0.05);陰性對照組細胞生長曲線較空白對照組低平,提示靶向抑制 CXCR7表達有潛在抑制結腸癌細胞增殖的作用,同時慢病毒載體本身也可能存在細胞毒性。
表1 各組不同時間的細胞密度(OD值,±s)

表1 各組不同時間的細胞密度(OD值,±s)
組別 1 d 2 d 3 d 4 d 5 d實驗組 0.436±0.010 0.861±0.043 1.159±0.117 1.612±0.120 1.790±0.112陰性對照組 0.554±0.016 1.090±0.074 1.682±0.085 2.022±0.112 2.120±0.125空白對照組 0.596±0.022 1.200±0.050 1.895±0.083 2.146±0.098 2.213±0.095
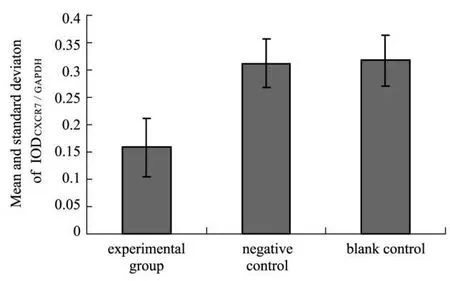
圖1 各組CXCR7蛋白表達水平
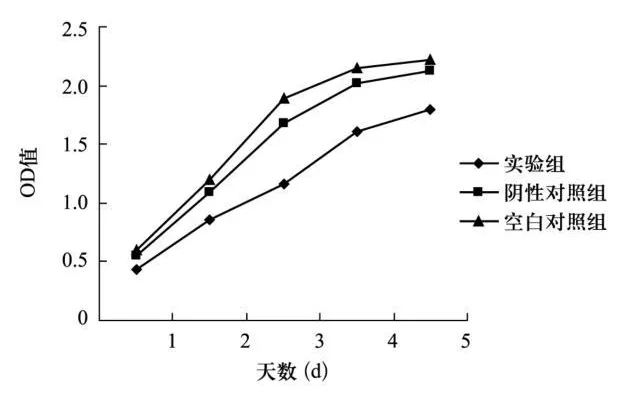
圖2 各組細胞不同時間生長曲線
2.3 Transwell細胞遷移實驗 在 NIH3T3上清趨化作用下,遷移至下室的細胞數目在實驗組、陰性對照組和空白對照組分別為(15.2±2.59)、(26.2±3.83)、(28.0±3.39)個/HP。與陰性對照組和空白對照組比較,實驗組穿透濾過膜細胞數量明顯減少,差異有統計學意義(P均 <0.05)。提示靶向沉默CXCR7的表達明顯抑制人結腸癌細胞 HT-29的遷移運動。
3 討論
腫瘤細胞的生物學特征與腫瘤細胞的惡性行為、轉移能力和轉移特征存在密切的關系,早期腸道腫瘤起源于正常黏膜組織,其上皮細胞異常增殖形成腺瘤,進而穿透黏膜肌層,侵及黏膜下層,發展為惡性腫瘤,大部分的結腸癌是由腺瘤癌變而來[3],腫瘤細胞的異常增殖和遷移是結腸癌發生發展的關鍵步驟,其促進因子可以用來做為臨床藥物治療的靶標。
趨化因子及其受體參與腫瘤的起源、增殖和惡化,尤其是趨化因子 CXCL12及其受體 CXCR4和CXCR7在這一進程中發揮重要作用[4]。CXCR7是2005年 Balabanian等[5]發現的歸巢性趨化因子 CXCL12的高親和受體,既往被命名為孤兒受體RDC1。Miao等[6]研究發現配體活化的 CXCR7能提高腫瘤細胞的生長、黏附和侵襲能力。Wang等[7]采用高密度組織芯片染色技術,觀察到在高侵襲性的前列腺癌組織中 CXCR7表達上調;CXCR7的表達上調除了提高前列腺癌細胞株的存活優勢外,還與增強細胞的黏附和侵襲性相關。進一步研究發現 CXCR7潛在的下游信號 CD44和鈣黏蛋白-11,可能由此提高 PCA細胞侵襲能力。Burns等用一種特異高親和力的小分子 CXCR7拮抗劑能抑制乳腺癌、肺癌的生長和轉移。
本實驗采用重組慢病毒 CXCR7-shRNA表達載體來特異性沉默 CXCR7基因的表達,Western blot檢測結果顯示 CXCR7蛋白的表達明顯下調,表明抑制 CXCR7靶基因的表達成功。MTT及 Transwell細胞遷移實驗的結果表明靶向沉默 CXCR7的表達能引起人結腸癌細胞 HT-29的增殖和遷移活力下降,提示 CXCR7可能通過促進腫瘤細胞的增殖和遷移作用參與結腸癌的生長和轉移。
目前在結腸癌的治療策略中,靶向藥物的研究空前發展,表皮生長因子受體和 VEGF的單克隆抗體西妥昔單抗和貝伐單抗已經進入臨床應用[8],CXCR7與結腸癌的關系密切,具有促進結腸癌細胞生長和遷移的作用,有望成為結腸癌治療新的分子標靶,其作用機制需要更深入的研究。
[1]Burns JM,Summers BC,Wang Y,etal.A novel chemokine receptor for SDF-1 and I-TAC involved in cell survival,cell adhesion,and tumor development[J].J Exp Med,2006,203(9):2201-2213.
[2]王紅鮮,陳道瑾,胡桂.shRNA慢病毒表達載體對人結腸癌細胞CXCR7表達的影響[J].中國普通外科雜志,2009,18(2):156-161.
[3]Tanaka T.Colorectal carcinogenesis:Review of human and experimental animal studies[J].J Carcinog,2009,8(2):5.
[4]Vandercappellen J,Van Damme J,Struyf S.The role of CXC chemokines and their receptors in cancer[J].Cancer Lett,2008,267(2):226-244.
[5]Balabanian K,Lagane B,Infantino S,et al.The chemokine SDF-1/CXCL12 binds to and signals through the orphan receptor RDC1 in T lymphocytes[J].J Biol Chem,2005,280(42):35760-35766.
[6]Miao Z,Luker KE,Summers BC,et al.CXCR7(RDC1)promotes breast and lung tumor growth in vivo and is expressed on tumor-associated vasculature[J].PNAS,2007,104(40):15735-15740.
[7]Wang J,Shiozawa Y,Wang J,et al.The Role of CXCR7/RDC1 as a Chemokine Receptor for CXCL12/SDF-1 in Prostate Cancer[J].J Biol Chem,2008,283(7):4283-4294.
[8]Hegde SR,Sun W,Lynch JP.Systemic and targeted therapy for advanced colon cancer[J].Expert Rev Gastroenterol Hepatol,2008,2(1):135-149.

