多葉苜蓿自交S1代的胚挽救培養(yǎng)
甘 欣 ,魏臻武,2,武自念,楊 云,趙 艷
(1.甘肅農(nóng)業(yè)大學(xué)草業(yè)學(xué)院,甘肅 蘭州 730070; 2.揚(yáng)州大學(xué)動(dòng)物科學(xué)與技術(shù)學(xué)院,江蘇 揚(yáng)州 225009)
栽培苜蓿(Medicagosativa) 是同源四倍體,常異花授粉植物,是一個(gè)雜合的持續(xù)分離的群體,且每個(gè)個(gè)體的遺傳基礎(chǔ)都不同[1]。在選育特異性狀的苜蓿新品種時(shí),多代自交可以得到含有多葉性狀純合個(gè)體,提高育種的效率。而在自交常規(guī)育種下,存在著嚴(yán)重的自交衰退現(xiàn)象,導(dǎo)致合子胚未發(fā)育成熟就中途敗育,自交結(jié)實(shí)率僅為2.2%~6.6%[1-5],給苜蓿自交系育種工作帶來很大困難。
隨著現(xiàn)代生物工程技術(shù)的發(fā)展,利用胚挽救技術(shù),在合子胚敗育之前進(jìn)行離體培養(yǎng),使其發(fā)育成成熟的胚,最終得到完整的植株[6-9]。該技術(shù)已在小麥(Triticumaestivum)、無核葡萄(Vitisvinifera)、花生(Arachishypogaea)、棗(Ziziphusjujuba)、百合(Liliumbrownii)等植物的雜交育種和胚培養(yǎng)方面開展了相關(guān)研究[7-11]。在苜蓿研究方面,McCoy[12]成功應(yīng)用胚珠培養(yǎng)技術(shù)獲得了苜蓿種間雜交后代的胚培苗。 Bauchan[13]分別對(duì)蝸牛苜蓿(M.scutellata)和紫花苜蓿進(jìn)行了胚挽救的研究,觀察了苜蓿不同時(shí)期胚珠的發(fā)育過程。結(jié)果發(fā)現(xiàn),苜蓿幼胚的發(fā)育時(shí)期以及不同的激素水平都是影響胚挽救效率的重要因素,并且得到了大量的胚挽救苗。這充分說明借助胚挽救技術(shù)進(jìn)行苜蓿特異性狀自交系育種具有廣闊的前景。
本研究對(duì)苜蓿多葉性狀自交系的實(shí)生種胚進(jìn)行離體培養(yǎng),探討了不同取材時(shí)期、不同單株、不同濃度的6-BA(6-芐氨基嘌呤)和KT(激動(dòng)素)對(duì)苜蓿胚挽救的影響,以期為苜蓿胚挽救育種提供依據(jù),并為苜蓿特異性狀自交系結(jié)實(shí)率低等方面的研究提供有效的解決途徑。
1 材料與方法
1.1供試材料 從84個(gè)不同來源苜蓿品種(系)中,根據(jù)分子標(biāo)記多態(tài)性和田間性狀,篩選600個(gè)優(yōu)良特異單株進(jìn)行移栽,通過3年田間選擇,從中篩選多葉性狀表現(xiàn)優(yōu)良的單株自交,獲得多葉自交系。將自交后代S1于2007年9月種植于揚(yáng)州大學(xué)實(shí)驗(yàn)農(nóng)牧場(chǎng),經(jīng)2年觀測(cè)從成活的80個(gè)單株中選取了3株多葉表達(dá)穩(wěn)定,且多葉率高的S1代單株。單株號(hào)為MFS5、MFS42、MFS46(表1)。
1.2試驗(yàn)方法
1.2.1自交方法 苜蓿自交試驗(yàn)于2009年5月14日在揚(yáng)州大學(xué)實(shí)驗(yàn)農(nóng)牧場(chǎng)進(jìn)行,對(duì)3個(gè)自交S1代單株整株罩蚊帳隔離,選取健康枝條上的小花序,摘除已授粉和花序頂端未成熟的花蕾,將剩余小花剝蕾自交后用蠟紙紙袋套上,掛牌標(biāo)記。每個(gè)單株分別做400個(gè)花序,授粉10 d后去袋。
1.2.2苜蓿敗育率調(diào)查 在自交授粉后40 d,對(duì)自交系3個(gè)單株進(jìn)行敗育率調(diào)查[7,12-16]。隨機(jī)選取莢果100粒,重復(fù)3次,順莢果螺旋方向剖開,用鑷子剝出幼胚,凡幼胚干癟,皺縮或種殼內(nèi)空的,皆視作敗育,并統(tǒng)計(jì)敗育率。

表1 3份苜蓿自交系試材的植物學(xué)特征

1.2.3材料滅菌與接種 從授粉后20 d開始,每隔5 d采集,將采集到的材料暫保存于4 ℃冰箱。接種前用自來水將莢果沖洗30 min,然后用70%乙醇浸潤(rùn)30 s,無菌水沖洗3次,在無菌環(huán)境下用0.1%的升汞浸泡20 min,無菌水漂洗5次。用剪刀順莢果螺旋方向剪開,用手術(shù)刀和鑷子剝掉種皮,挑出幼胚接種到培養(yǎng)基上,每個(gè)培養(yǎng)皿接種12粒。
1.2.4苜蓿胚挽救最佳時(shí)期的選擇 從自交授粉后20 d開始,每隔5 d采集莢果,到授粉40 d結(jié)束。滅菌后,剝出幼胚,將其接種在MS+0.5 mg/L IAA+0.05 mg/L 6-BA基本培養(yǎng)基上,蔗糖30 g/L,瓊脂7 g/L,pH值5.8~6.1。每個(gè)材料接種10皿,12粒/皿。接種后將培養(yǎng)皿放入25 ℃的暗培養(yǎng)箱中暗培養(yǎng)3~5 d后轉(zhuǎn)入溫度為25 ℃、光強(qiáng)1 500~2 000 lx、光照時(shí)間16 h/d、濕度35%的培養(yǎng)箱內(nèi)培養(yǎng),2周后統(tǒng)計(jì)胚的萌發(fā)情況。
1.2.5苜蓿胚挽救激素水平設(shè)置 采集胚挽救最佳時(shí)期的材料,分別接種于10種培養(yǎng)基上,培養(yǎng)基的配方如下:以MS+0.5 mg/L IAA,蔗糖為30 g/L,瓊脂7 g/L,pH值5.8~6.1為基本培養(yǎng)基。分別添加5個(gè)不同梯度水平的6-BA (0.01、0.03、0.05、0.07、0.09 mg/L)和5個(gè)不同梯度水平的KT(0.01、0.03、0.05、0.07、0.09 mg/L)于培養(yǎng)基中;每種培養(yǎng)基接種10皿,12粒/皿。接種后將培養(yǎng)皿放入25 ℃的暗培養(yǎng)箱中培養(yǎng)2~3 d后轉(zhuǎn)入溫度為25 ℃、光強(qiáng)1 500~2 000 lx、光照時(shí)間16 h/d、濕度35%的培養(yǎng)箱內(nèi)培養(yǎng)。
1.2.6幼胚愈傷組織的誘導(dǎo)及不定芽的分化 將萌動(dòng)的苜蓿幼胚轉(zhuǎn)接到MS+2.0 mg/L 2,4-D+0.1 mg/L 6-BA,蔗糖30 g/L,瓊脂6.5 g/L,pH值5.8~6.1的培養(yǎng)基上。接種后放入溫度為25 ℃、光強(qiáng)1 500~2 000 lx、光照時(shí)間16 h/d、濕度35%的培養(yǎng)箱內(nèi)培養(yǎng)。20 d后調(diào)查愈傷組織的誘導(dǎo)率。從生長(zhǎng)旺盛且較致密的愈傷組織中切取不同顏色和質(zhì)地,直徑為1 cm的小塊接種于MS+1.0 mg/L KT+0.1 mg/L 6-BA+0.3 mg/L NAA的分化培養(yǎng)基上光培養(yǎng),調(diào)查愈傷組織分化率。


2 結(jié)果與分析
2.1參試材料的植物學(xué)差異 對(duì)多葉自交系單株進(jìn)行植物學(xué)觀察發(fā)現(xiàn),MFS5多葉性狀明顯,多葉率為93%,5~7片,7片葉居多,羽狀,花淺紫色,半直立。MFS42多葉性狀較為明顯,多葉率為58%,4~9片葉,7片葉較多,羽狀,匍匐,花紫色。MFS46多葉率為73%,4~5片,4片葉多,多為掌狀,半直立,生長(zhǎng)后期易倒伏,花色黃紫色。其中以MFS5,多葉表達(dá)率最高。經(jīng)2年田間觀測(cè)表明,以上材料多葉率較高且多葉性狀均能穩(wěn)定表達(dá),可用于多葉苜蓿自交系的繼續(xù)選育和雜交親本的配置,是自交系中較優(yōu)良的單株。
2.2敗育率的調(diào)查情況 苜蓿自交后胚的敗育機(jī)理相當(dāng)復(fù)雜,不同基因型、生長(zhǎng)條件以及成熟期都對(duì)胚敗育產(chǎn)生影響[14,17-18]。通過幼胚形態(tài)特征觀察發(fā)現(xiàn),正常的幼胚飽滿,顏色多為鮮綠色或淡綠色;而敗育的幼胚一直處于干癟、體積較小的狀態(tài),通常表現(xiàn)為褐色或黑色。結(jié)果表明,在授粉后40 d,苜蓿的敗育率達(dá)到最高值。參試材料中,MFS5單株的敗育率為28.84%;MFS42單株的敗育率為43.26%;敗育率最高的材料為MFS46單株,達(dá)40.67%。
2.3不同取材時(shí)期對(duì)胚挽救的影響 為進(jìn)一步確定多葉苜蓿自交系幼胚挽救的最佳取樣時(shí)期,從授粉后20~40 d,每隔5 d取幼胚進(jìn)行離體培養(yǎng)。培養(yǎng)結(jié)果顯示,3個(gè)多葉苜蓿自交系單株在不同取材時(shí)期幼胚均能萌發(fā),但不同時(shí)期的幼胚萌發(fā)差異較大(圖1)。采集授粉后20 d的材料褐化比較嚴(yán)重,萌發(fā)率較低,平均萌發(fā)率為28.09%;授粉后30 d接種,各材料幼胚萌發(fā)率均達(dá)到最高值,平均為46.71%,明顯高于其他各取材時(shí)期。此時(shí)進(jìn)行胚挽救培養(yǎng)可以獲得最佳效果;授粉后40 d胚挽救效率最低,萌發(fā)率僅為12.16%,此時(shí)的胚處于綠色狀態(tài),很難啟動(dòng)萌發(fā),大部分已處于生理成熟期。綜合分析,授粉后30 d進(jìn)行胚挽救培養(yǎng),胚的萌發(fā)率達(dá)到最高值,且此時(shí)接種胚不易出現(xiàn)褐化,相對(duì)其他時(shí)期萌發(fā)啟動(dòng)早,約3~4 d后即可萌發(fā),幼胚呈深綠色,為最佳取材時(shí)期。
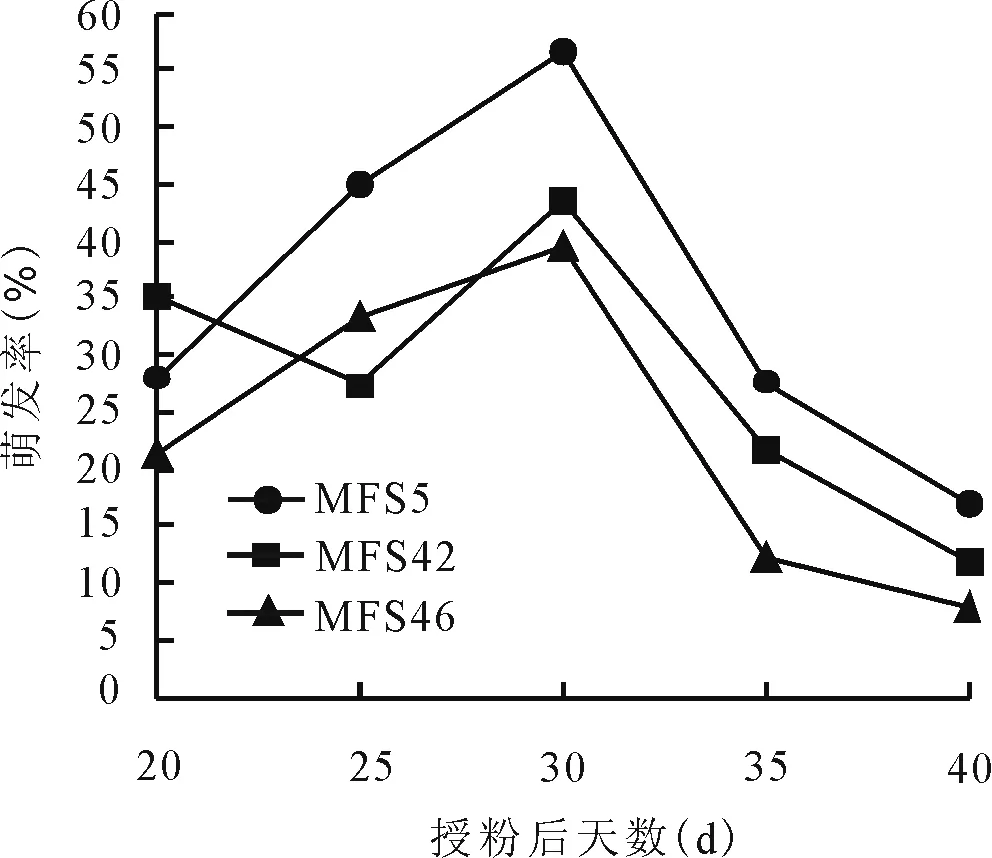
圖1 不同取樣時(shí)間對(duì)苜蓿胚挽救萌發(fā)率的影響
2.4不同激素水平對(duì)幼胚挽救的影響 分別取3個(gè)自交單株在授粉后30 d的幼胚,接種于10種激素水平組合下的培養(yǎng)基上。以MS為基本培養(yǎng)基,在吲哚乙酸(IAA)保持0.5 mg/L不變的情況下,附加不同濃度的KT、6-BA 組合研究激素對(duì)苜蓿幼胚萌發(fā)的影響。
2.4.1細(xì)胞分裂素KT對(duì)幼胚萌發(fā)的效應(yīng) 在不同KT質(zhì)量濃度下,3個(gè)苜蓿自交單株的幼胚都能萌發(fā)。當(dāng)KT質(zhì)量濃度為0.01~0.03 mg/L時(shí),3份材料的胚萌發(fā)率都隨著濃度的升高而增加。當(dāng)KT為0.03 mg/L時(shí),各材料胚萌發(fā)率均達(dá)到最大值,分別為MFS5單株 40.13%,MFS42單株38.5%,MFS46單株37.2%;但當(dāng)KT質(zhì)量濃度增加到大于0.03 mg/L時(shí),萌發(fā)率開始下降,0.03~0.09 mg/L時(shí),幼胚萌發(fā)率與KT質(zhì)量濃度的增加成反比。KT質(zhì)量濃度為0.09 mg/L時(shí),3份材料萌發(fā)率都達(dá)到不同程度的最低值,其中MFS5單株的萌發(fā)率最低,僅為15.42%(圖2)。
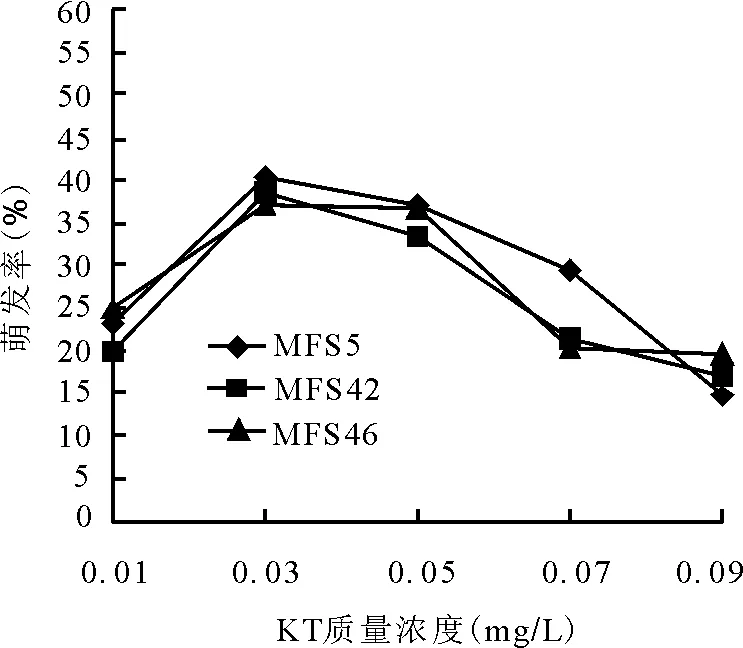
圖2 不同質(zhì)量濃度KT對(duì)苜蓿胚挽救萌發(fā)率的影響
2.4.2細(xì)胞分裂素6-BA對(duì)苜蓿幼胚萌發(fā)的效應(yīng) 在6-BA濃度梯度下,各材料也都能萌發(fā)。0.01~0.07 mg/L時(shí),3份材料幼胚萌發(fā)率與6-BA質(zhì)量濃度的增加成正比。在0.01 mg/L時(shí),各材料萌發(fā)率均為所有處理的最低值,MFS5單株16.63%,MFS42單株17.3%,MFS 46單株18.23%。當(dāng)6-BA質(zhì)量濃度達(dá)到0.07 mg/L時(shí),各個(gè)材料均達(dá)到各自萌發(fā)率的最大值,MFS5單株53.34%,MFS42單株46.53%,MFS46單株43.37%(圖3)。但當(dāng)6-BA質(zhì)量濃度高于0.07 mg/L,6-BA對(duì)萌發(fā)率逐漸出現(xiàn)抑制作用。萌發(fā)率隨著6-BA質(zhì)量濃度的增加而逐漸降低。且當(dāng)6-BA質(zhì)量濃度為0.01 mg/L時(shí),3個(gè)材料的幼胚都發(fā)育遲緩,MFS5單株接種7 d后才出現(xiàn)萌發(fā),并且胚萌發(fā)后出現(xiàn)生長(zhǎng)停滯的現(xiàn)象。
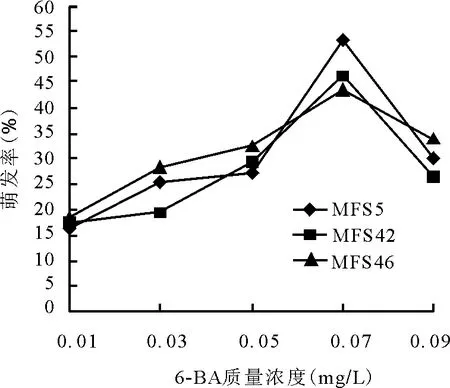
圖3 不同質(zhì)量濃度6-BA對(duì)苜蓿胚挽救萌發(fā)率的影響
對(duì)比6-BA和KT的結(jié)果發(fā)現(xiàn),對(duì)于胚萌發(fā)添加6-BA要優(yōu)于添加KT。苜蓿幼胚培養(yǎng)的最佳組合為:MS+0.5 mg/L IAA +0.07 mg/L 6-BA,蔗糖30 g/L,瓊脂7 g/L,pH值5.8~6.1。
2.5幼胚愈傷組織的誘導(dǎo)及不定芽的分化 將萌動(dòng)的幼胚轉(zhuǎn)入誘導(dǎo)愈傷培養(yǎng)基上,20 d后發(fā)現(xiàn)卷曲的子葉、葉緣及葉背處都形成愈傷組織,其愈傷組織結(jié)構(gòu)大多呈現(xiàn)為淺黃色致密團(tuán)狀,還有少數(shù)膨松水漬狀和白色沙粒狀等,20 d后統(tǒng)計(jì),愈傷平均誘導(dǎo)率分別為MFS5 91.77%、MFS42 80.34%、MFS46 83.85%。然后將形成的愈傷組織每15~18 d繼代培養(yǎng),等長(zhǎng)到愈傷直徑為1 cm左右時(shí)轉(zhuǎn)入分化培養(yǎng)基上,統(tǒng)計(jì)愈傷組織分化率以MFS5最高為88.89%,其次為MFS46 87.58%,MFS42較低為77.92%。
3 討論
苜蓿胚敗育是一個(gè)極其復(fù)雜的生物學(xué)過程,苜蓿自花授粉后,經(jīng)雙受精作用而形成的合子和胚胎在發(fā)育過程中會(huì)出現(xiàn)夭亡的現(xiàn)象,其敗育的比率高于異花授粉[1,19]。關(guān)于苜蓿胚胎發(fā)育過程和敗育機(jī)理前人已有報(bào)道,早在1935年,Cooper[20]第1次對(duì)苜蓿的幼胚發(fā)育過程進(jìn)行了描述。Rosellini等[18]分別對(duì)9個(gè)苜蓿群體的每個(gè)單株的胚珠敗育情況進(jìn)行調(diào)查,發(fā)現(xiàn)苜蓿的胚珠敗育率為4%~26%。金洪等[15]對(duì)敖漢苜蓿(M.sativacv.‘Aohan’)授粉受精及幼胚的發(fā)育過程進(jìn)行研究,發(fā)現(xiàn)經(jīng)過受精作用幼胚細(xì)胞開始分裂分化,到第22天便形成了具有幼胚根、幼胚軸、幼胚芽和子葉的完整幼胚。幼胚的整個(gè)形成過程可分為3個(gè)階段:球狀幼胚形成期、子葉形成期、幼胚各部分發(fā)育成熟期。導(dǎo)致自交敗育的原因,除與兩性器官的不親和或不相適應(yīng)有關(guān)外,也可能是一種近親繁殖效應(yīng)的結(jié)果[1]。紫花苜蓿自交結(jié)實(shí)率的高低就主要取決于它們各自近親繁殖的程度,植物材料雜合性降低也是造成受精后合子或胚珠敗育的原因之一[21]。本研究對(duì)多葉苜蓿自交系授粉后40 d進(jìn)行胚敗育率調(diào)查得出自交系單株平均胚敗育率為37.59%,與前人研究的苜蓿自交受精后胚珠敗育的百分率為34.4%[1]的結(jié)論相近。
苜蓿的敗育時(shí)期,確定胚接種的最佳取材時(shí)期是決定苜蓿胚挽救能否成功的前提條件。苜蓿自花不孕有一個(gè)特點(diǎn),即幼胚自花受精后,種子敗育的頻率很高[1]。Bauchan[13]對(duì)苜蓿胚珠發(fā)育過程以及接種時(shí)間的研究表明,當(dāng)紫花苜蓿胚珠發(fā)育為心形胚期(授粉后8~12 d)和魚雷形胚期(授粉后12~16 d)時(shí),生長(zhǎng)最好,萌發(fā)率為31%。所以接種時(shí)期太早,胚尚處于發(fā)育早期,很難培養(yǎng)成功;接種時(shí)間太晚,胚的發(fā)育率降低,甚至?xí)驍∮鴮?dǎo)致試驗(yàn)失敗。本研究對(duì)于3個(gè)自交單株的胚挽救過程中發(fā)現(xiàn),其幼胚胚齡在自交授粉后30 d胚的萌發(fā)率最高,為最佳取材時(shí)期。此時(shí)各個(gè)單株萌發(fā)率都比較高。
McCoy[12,16]研究了多年生苜蓿及一年生苜蓿雜交胚珠挽救技術(shù),發(fā)現(xiàn)基本培養(yǎng)基為SH效果較好。Bauchan[13]對(duì)蝸牛苜蓿和紫花苜蓿胚挽救,證明MS和SH培養(yǎng)基適合于胚挽救,還研究了不同激素組合對(duì)于苜蓿胚珠萌發(fā)的影響;試驗(yàn)證明添加0.05 mg/L IAA和0.05 mg/L 6-BA在MS中對(duì)胚珠萌發(fā)最為有利。從本研究可以看出,在MS培養(yǎng)基中,當(dāng)IAA的質(zhì)量濃度一定時(shí)(0.5 mg/L),分別加入了不同質(zhì)量濃度水平的6-BA和KT,對(duì)苜蓿胚挽救效力進(jìn)行比較,添加6-BA的培養(yǎng)效果要比添加KT好,結(jié)果培養(yǎng)基的最佳激素質(zhì)量濃度配比是:IAA 0.5 mg/L,6-BA 0.07 mg/L。培養(yǎng)基在幼胚生長(zhǎng)發(fā)育過程中提供其所需的碳源和營(yíng)養(yǎng)物質(zhì),而激素主要作用是調(diào)節(jié)滲透壓[22]。IAA 0.5 mg/L,6-BA 0.07 mg/L較其他不同激素組合效果好的原因,可能是能夠更好的提供苜蓿幼胚生長(zhǎng)發(fā)育所需的滲透壓。
在促進(jìn)萌發(fā)過程中,萌發(fā)的幼苗應(yīng)及時(shí)轉(zhuǎn)入增殖分化培養(yǎng)基中才能防止褐化,愈傷組織在增殖過程中生長(zhǎng)良好,70~90 d后產(chǎn)生膨松帶有綠色芽點(diǎn)的愈傷組織,最終分化成苗。進(jìn)一步提高分化率的同時(shí)縮短愈傷組織分化時(shí)間是有待繼續(xù)研究的問題。
[1] 洪紱曾,盧欣石,高洪文.苜蓿科學(xué)[M].北京:中國(guó)農(nóng)業(yè)出版社,2009:216-231.
[2] Armstrong J M.Cytological studies in alfalfa polyploids[J].Canadian Journal of Botany,1954,32(4):531-542.
[3] 劉淑明.苜蓿的開花習(xí)性及其雜交技術(shù)的研究[J].中國(guó)草地,1996(2):7-10.
[4] 姜華,畢玉芬.紫花苜蓿花粉和胚珠與種子產(chǎn)量的關(guān)系[J].云南農(nóng)業(yè)大學(xué)學(xué)報(bào),2008,23(3):334-338.
[5] 姜華,畢玉芬.紫花苜蓿花粉活力和柱頭可授性的研究[J].草業(yè)科學(xué),2009,26(9):105-107.
[6] 閆愛玲,張國(guó)軍,徐海英,等.葡萄不同倍性品種間雜交幼胚挽救及鑒定[J].西北農(nóng)業(yè)學(xué)報(bào),2008,17(3):223-226.
[7] 賀佳玉,李云,姜金仲,等.植物胚敗育機(jī)理及其離體培養(yǎng)挽救技術(shù)之研究進(jìn)展[J].中國(guó)農(nóng)學(xué)通報(bào),2008,24(1):141-146.
[8] Ramming D W,Emershad R L.In-ovule embryo culture of seeded and seedlessV.viniferaL.[J].Horticultural science,1982,17(3):487-492.
[9] Cain D W,Emershad R L,Tarilo R E.In-ovule embryo culture and seedling development of seeded and seedless grapes (V.viniferaL.)[J].Vitis,1983,22(1):9-14.
[10] 余桂榮,尹鈞,郭天財(cái),等.小麥幼胚培養(yǎng)基因型的篩選[J].麥類作物學(xué)報(bào), 2003,23(2):14-18.
[11] 杜學(xué)梅,李登科,王永康,等.棗胚培技術(shù)體系的建立[J].園藝學(xué)報(bào),2005,32(3):496-499.
[12] McCoy T J.Interspecific hybridization ofMedicagosativaL.andM.rupestrisMB.using ovule-embryo culture[J].Canadian Journal of Genetics and Cytology,1985,27:238-245.
[13] Bauchan G R.Embryo culture ofMedicagoscutellataandM.sativa[J].Plant Cell, Tissue and Organ Culture,1987(10):21-29.
[14] 吳素琴,張自和.紫花苜蓿植株群體花序花朵數(shù)及莢內(nèi)種子數(shù)的數(shù)量特征分析[J].草業(yè)學(xué)報(bào),2003,12(5):77-80.
[15] 金洪,李造哲,吳永敷,等.敖漢苜蓿授粉受精及胚胎發(fā)育過程的研究[J].中國(guó)草地,1999(6):1-10.
[16] McCoy T J, Smith L Y.Interspecific hybridization of perennialMedicagospecies using ovule-embryo cultur [J].Theoretical and Applied Genetics,1986,71:772-783.
[17] 呂林有,魏臻武,趙艷,等.苜蓿自交親和性、授粉方式及后代性狀分離的研究[J].草業(yè)科學(xué),2009,26(4):33-36.
[18] Rosellini D, Ferranti F, Veronesil F.Ovule sterility and seed set in alfalfa[A].Proceeding of the Conference:The alfalfa Genome[C].Wisconsin:Madison,1999:1-4.
[19] 張愛勤,朱進(jìn)忠.苜蓿結(jié)實(shí)格局及其影響因素的研究[J].新疆農(nóng)業(yè)大學(xué)學(xué)報(bào),2005,28(4):l5-19.
[20] Cooper D C.Macrosporogenesis and embryology ofMedicago[J].Journal of Agricultural Research,1935,51:471-477.
[21] Bola nos-Aguilar E D, Huyghe C, Julier B.Genetic variation for seed yield and its components in alfalfa (Medicagosativa) populations[J].Agronomie,2000,20:333-345.
[22] Raghavan V, Srivastava P S.Embryo culture[A].In:Johri B F.Experimental embryology of vascular plants[C].New York:Springer-Verlag,1982:195-230.

