小葉錦雞兒SSR-PCR體系優化及應用
韓永增,王 贊,高洪文
(1.蘭州大學草地農業科技學院,甘肅 蘭州 730020; 2.中國農業科學院北京畜牧獸醫研究所,北京 100193)
小葉錦雞兒(Caraganamicrophylla)為豆科錦雞兒屬多年生飼用灌木,多分布于中國東北及內蒙古、河北、山西、陜西等地,蒙古、西伯利亞也有分布[1]。因其耐干旱、低溫,能抗風沙,再生力強,耐瘠薄等特性而成為良好的飼用灌木和生態保護先鋒植物。微衛星DNA(Microsatellite DNA)Simple sequence repeats(SSR), 是一種基于DNA長度多態性的分子標記技術,具有共顯性、高度可重復性及多態性豐富等優點,是構建遺傳連鎖圖譜、研究群體遺傳學、進行分子標記輔助育種、系譜分析和法醫鑒定的理想工具[2-7]。目前國外已經應用該技術對很多物種進行了遺傳多樣性及遺傳結構分析研究[8-11],國內在牧草上也有部分應用[12-13],但在小葉錦雞兒上應用SSR標記的研究卻很少[14]。其主要原因就是缺少用于小葉錦雞兒SSR分子標記的引物,而本研究所采用的引物為中國農業科學院北京畜牧獸醫研究所牧草資源研究室自行開發的SSR引物,并利用正交試驗設計,對模板DNA、Mg2+、dNTP、引物和Taq DNA聚合酶濃度進行五因素四水平優化篩選,從而建立高效、穩定的小葉錦雞兒SSR-PCR反應體系,為SSR標記在錦雞兒屬植物的遺傳多樣性分析、遺傳圖譜構建、種質資源鑒定、親緣關系分析及分子育種等研究工作奠定基礎。
1 材料與方法
1.1材料 供試材料為24份小葉錦雞兒種質資源,由中國農業科學院北京畜牧獸醫研究所牧草種質庫提供,1號為體系優化模板,其他均為檢測模板(圖1)。
1.2方法
1.2.1DNA提取及檢測 DNA提取技術采用CTAB法從小葉錦雞兒種子中進行提取[15],用1%瓊脂糖電泳檢測其質量,用UNICO UV-2000型分光光度計檢測其濃度,所有DNA樣品稀釋到50 ng/μL。
1.2.2反應體系優化 針對模板DNA、Mg2+、dNTP、引物、Taq酶等5種影響因素進行L16(45)正交實驗(表1和表2)。引物為中國農業科學院北京畜牧獸醫研究所牧草資源研究室開發的“S1-25”(待發表),由上海英駿生物技術有限公司合成。反應條件為:94℃預變性10 min;94℃變性45 s,65℃復性1 min,72℃延伸1 min,10個循環,每循環的復性溫度遞減1℃;94℃變性45 s,55℃復性1 min,72℃延伸1 min,30個循環;72℃延伸10 min,4℃保存[16]。PCR擴增產物用8%聚丙烯酰胺分離及銀染檢測[17]。
1.2.3優化體系的最終確定 在正交試驗的基礎上又做了Mg2+和Taq DNA聚合酶的四水平完全正交試驗,以確定最佳的反應體系,其設計見表3和表4。結果用1%瓊脂糖電泳檢測。
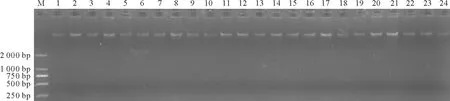
圖1 小葉錦雞兒種子DNA電泳圖
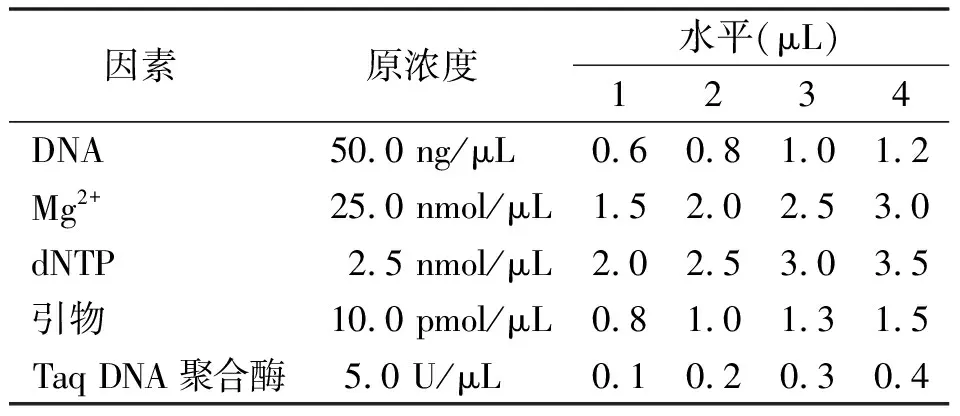
表1 SSR-PCR體系的正交設計因素及水平
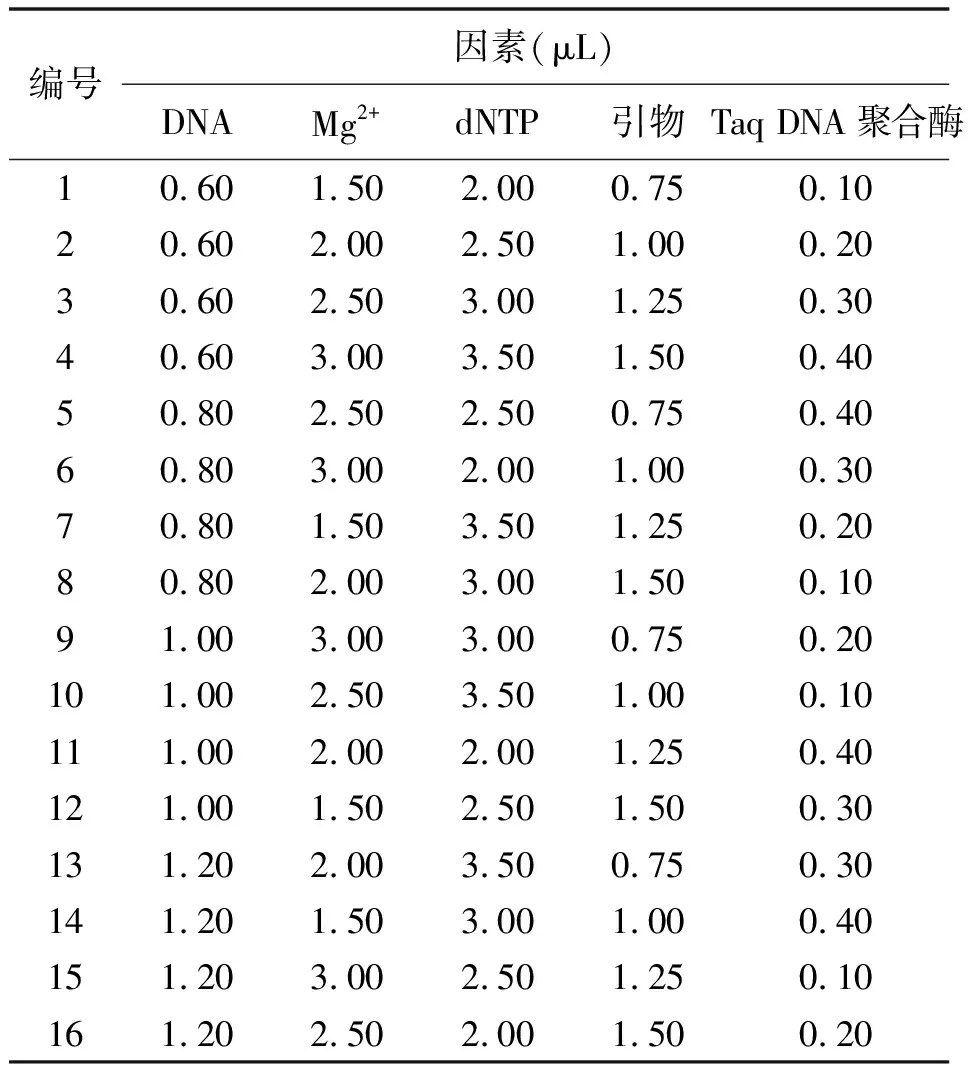
表2 SSR-PCR體系正交試驗設計[L16(45)]
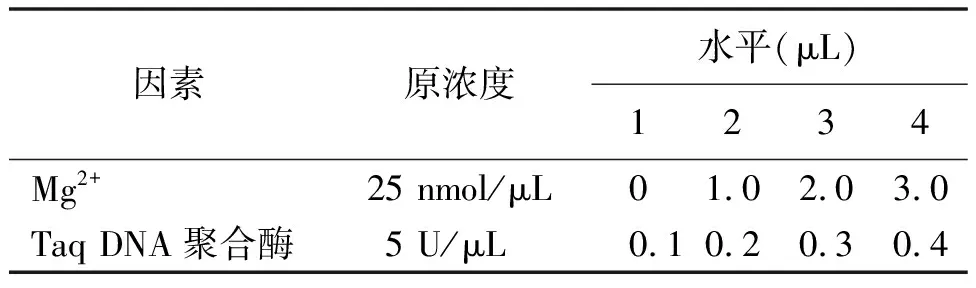
表3 Mg2+和Taq DNA 聚合酶的四水平
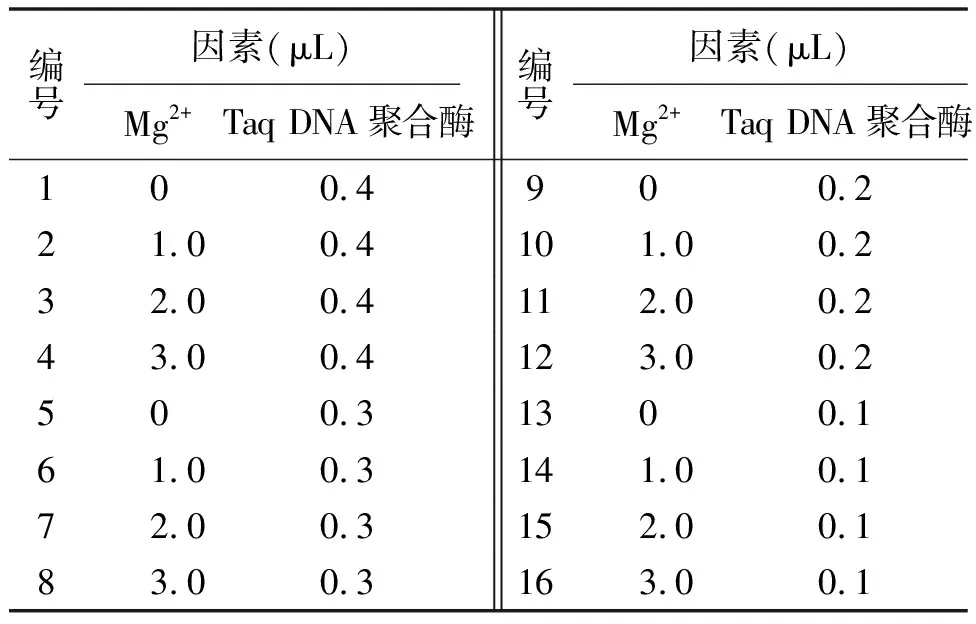
表4 Mg2+和Taq DNA聚合酶完全正交設計
2 結果與分析
2.1DNA提取質量 用CTAB法提取的小葉錦雞兒基因組DNA完整,無降解,且無RNA殘留。用紫外分光光度計檢測,OD260/OD280值符合SSR分子標記的要求(圖1)。
2.2SSR-PCR正交設計結果及分析 根據SSR-PCR正交試驗結果(圖2)可以清晰地看出,這16個組合中,7、8兩組條帶清晰明亮且沒有雜帶,而這兩組只有DNA的量是相同的,所以要確定其他影響因素的量還要經過進一步的分析。依據前人研究[18]可知,引物與模板結合后在Taq酶作用下進行延伸,Taq DNA聚合酶是Mg2+依賴性酶,受Mg2+濃度的影響,而Mg2+又受dNTP的拮抗作用。所以,現在只需將dNTP與引物的量固定,設計Mg2+與Taq酶的完全正交試驗即可得到最佳的優化體系。出于成本考慮,本試驗選擇dNTP水平較低的第8組合作為基礎。從Mg2+與Taq酶的完全正交試驗結果可以看出(圖3),Taq酶的量對體系影響不顯著,而Mg2+的量對體系影響十分顯著。因表4第15組合與表2第8組合完全相同,所以可以確定條帶最亮的第12組合為最佳體系,即:40 ng模板DNA,3 mmol/L Mg2+,300 μmol/L dNTP,0.6 μmol/L引物,1 U DNA聚合酶,1×Buffer,加dd H2O至25 μL。
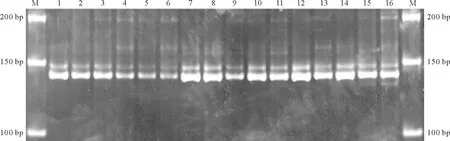
圖2 SSR-PCR正交設計擴增結果
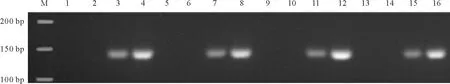
圖3 Mg2+和Taq DNA聚合酶完全正交設計擴增結果
2.3優化體系應用 利用優化的PCR體系對其余種質資源進行擴增,條帶清晰明亮且特異性強(圖4),證明此體系具有較好的穩定性和可重復性,同時也表明小葉錦雞兒種質資源具有較高的遺傳多樣性,可以應用該優化體系對其進行多樣性分析研究。應用本優化體系對自行開發的其他SSR引物進行PCR篩選,共得到有效擴增引物37對,根據其多態信息含量(polymorphism information content,PIC)可知,多態性引物21對(56.8%)(其部分結果見圖5),證明此體系也具有較好的廣泛應用性。
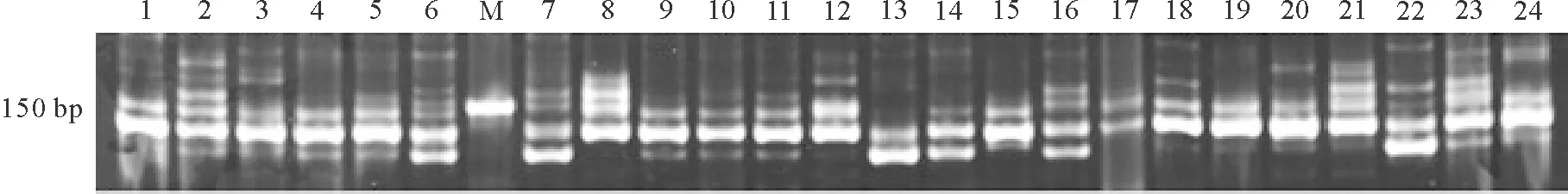
圖4 優化體系對所有小葉錦雞兒種質資源的擴增結果

圖5 引物S1-13對所有小葉錦雞兒種質資源的擴增結果
3 討論
隨著分子標記技術的不斷發展完善,SSR標記也因具有很多優良特性而被廣泛應用,尤其是在優良牧草上的應用將更加深入。因影響SSR-PCR的因素很多,且各個因素相互影響[18],所以應用正交設計這一實用工具將大大提高工作效率。通過本研究優化出的擴增體系表現出良好的穩定性和廣泛性,可為今后的科研工作提供參考。
本研究表明,Mg2+的濃度對SSR-PCR體系的影響十分明顯,這與前人的結論一致[19],因此在本研究中參照張麗芳等[20]SSR優化方法再設計一組二因素四水平完全隨機試驗,逐個優化其他反應成分以確定最佳的反應組合。本次SSR-PCR體系的優化從更多方面進行開展,能為今后的科研工作提供幫助。但還有些不足,如PCR儀的不同對體系的影響,聚丙烯酰胺凝膠的濃度對產物的分離效率及不同的點樣量對分離效果的影響等問題還有待進一步研究。
本研究所選的PCR程序為Gharghani等[16]的程序,而這一類型的程序在不同的物種當中已有廣泛的應用,如韓香婷[21]、曹永國[22]、Tang等[23]分別在大白菜(Brassicapekinensis)、玉米(Zeamays)及資源冷杉(Abiesziyuanensis)中都應用此類程序完成了SSR分子標記工作。該程序的優點是不改變任何參數即可將不同引物進行擴增,大大節省了退火溫度的檢測時間和成本。該類程序可為今后的SSR標記工作提供幫助。
依據優化的PCR體系對所設計的SSR引物進行篩選,結果有5對(11.63%)得到擴增,但沒有一致性,也與目的片段相差很大,有1對(2.32%)沒有擴增產物,其原因可能為設計引物時所選用的序列為基因突變的片段,另外也有可能是測序過程中的堿基錯誤影響了引物設計,進而影響了PCR擴增。本研究共得到多態性引物21對,其余引物也可能存在多態性,只是因為用于檢測的個體數較少而沒有表現出多態性,這些引物的多態性檢測將在今后的工作中進行。
4 結論
1)采用正交設計和完全正交試驗優化了小葉錦雞兒SSR-PCR反應體系,其最適的反應體系為(25 μL):40 ng模板DNA,3 mmol/L Mg2+,300 μmol/L dNTP,0.6 μmol/L引物,1 U Taq DNA聚合酶,1×Buffer。
2)利用上述優化體系對小葉錦雞兒種質資源進行檢測,證明該體系具有較好的穩定性和可重復性;應用該體系對自行開發的SSR引物進行篩選,得到有效擴增引物37對,其中多態性引物21對,占56.8%,證明該體系具有廣泛的應用性。
[1] 趙一之.小葉、中間和檸條三種錦雞兒的分布式樣及其生態適應[J].生態學報,2005,25(12):3411-3414.
[2] 雷天剛,何永睿,吳鑫,等.柑橘栽培品種(系)DNA 指紋圖譜庫的構建[J].中國農業科學,2009,42(8):2852-2861.
[3] 王麗俠,程須珍,王素華,等.利用SSR 標記分析小豆種質資源的遺傳多樣性[J].中國農業科學,2009,42(8):2661-2666.
[4] 段艷鳳,劉杰,卞春松,等.中國88個馬鈴薯審定品種SSR指紋圖譜構建與遺傳多樣性分析[J].作物學報,2009,35(8):1451-1457.
[5] 王軍.生物技術與葡萄遺傳育種[J].中國農業科學,2009,42(8):2862-2874.
[6] 蔣益敏,李體琛,蒙成,等.利用SSR標記鑒定玉米雜交種南校18號種子純度[J].廣西農業科學,2009,40(5):464-467.
[7] 解新明,盧小良.SSR和ISSR標記及其在牧草遺傳與育種研究中的應用前景[J].草業科學,2005,22(2):30-37.
[8] Cao Q J,Lu B R,Xia H,etal.Genetic diversity and origin of weedy rice (Oryzasativaf.spontanea) populations found in north-eastern China revealed by Simple Sequence Repeat (SSR) markers[J].Annals of Botany,2006,98:1241-1252.
[10] Matsumoto A,Uchida K,Taguchi Y,etal.Genetic diversity and structure of natural fragmentedChamaecyparisobtusapopulations as revealed by microsatellite markers [J].Journal of Plant Research,2010,123:689-699.
[11] Tsuda Y,Kimura M,Kato S,etal.Genetic structure ofCerasusjamasakura,a Japanese flowering cherry,revealed by nuclear SSRs:implications for conservation[J].Journal of Plant Research,2009,122:367-375.
[12] 孫建萍,袁慶華.利用微衛星分子標記研究我國16份披堿草遺傳多樣性[J].草業科學,2006,23(8):40-44.
[13] 謝文剛,張新全,馬嘯,等.中國西南區鴨茅種質遺傳變異的SSR分析[J].草業學報,2009,18(4):138-146.
[14] 郭強,時永杰,魏臻武,等.河西走廊14種錦雞兒遺傳多樣性SSR分析[J].草地學報,2008,16(3):227-233.
[15] 徐博.內蒙古東部野生小葉錦雞兒遺傳多樣性研究[D].北京:中國農業科學院,2009.
[16] Gharghani A,Zamani Z,Talaie A,etal.Genetic identity and relationships of Iranian apple (Malus×domesticaBorkh.) cultivars and landraces,wild Malus species and representative old apple cultivars based on simple sequence repeat (SSR) marker analysis[J].Genetic Resources and Crop Evolution,2009,56:829-842.
[17] 吳宗懷.紫花苜蓿、雜花苜蓿和黃花苜蓿SSR分子標記分析[D].呼和浩特:內蒙古農業大學,2007.
[18] 王志勇,郭海林,劉建秀.正交設計優化狗牙根SSR-PCR 反應體系[J].分子植物育種,2007,5(S1):201-206.
[19] 張阿英.中國紫花苜蓿(MedicagosativaL.)地方品種SSR分析[D].哈爾濱:東北農業大學,2002.
[20] 張麗芳,魏臻武,楊占花.蒺藜苜蓿SSR反應體系優化及在一年生苜蓿種質鑒定中的應用[J].草地學報,2007,15(5):429-436.
[21] 韓香婷.大白菜抗軟腐病性狀的SSR分子標記分析[D].北京:首都師范大學,2006.
[22] 曹永國.SSR標記在玉米雜種優勢及遺傳圖譜中的應用研究[D].北京:中國農業科學院,2000.
[23] Tang S Q,Dai W J,Li M S,etal. Genetic diversity of relictual and endangered plantAbiesziyuanensis(Pinaceae) revealed by AFLP and SSR markers[J].Genetica,2008,133:21-30.

