體外培養癲癇細胞模型中整合素α2表達的變化☆
蘇婕吳原吳月娟馬美剛唐玉蘭余璐劉云李佳荃
·論 著·
體外培養癲癇細胞模型中整合素α2表達的變化☆
蘇婕*吳原*吳月娟*馬美剛*唐玉蘭*余璐*劉云*李佳荃△
目的 探討體外培養癲癇細胞模型中整合素α2(integrin α2)的動態表達變化及意義。方法 體外培養至第7天的乳鼠海馬神經元分成對照組和實驗組,實驗組利用“無鎂細胞外液”體外培養3 h制備體外癲癇神經元細胞模型,免疫細胞化學法和逆轉錄聚合酶鏈反應(reverse transcription-polymerase chain reaction,RT-PCR)法測定對照組及實驗組造模后12 h,24 h,48 h三個時間點的integrin α2蛋白及mRNA的相對表達變化。結果 造模24 h后神經網絡遷移,呈 “網格樣”改變;integrin α2蛋白相對表達:平均光密度值(mean integrated optical density,mean IOD)對照組為(0.033±0.005),實驗組12 h(0.084±0.033),24 h(0.076± 0.018),48 h(0.077±0.006),實驗組均高于對照組(P<0.05),在造模后12-48 h表達量維持在兩倍以上;RT-PCR結果示對照組integrin α2與β-actin光密度值(optical density,OD)之比為(0.316±0.039),實驗組12 h(0.435±0.067),24 h(0.453±0.046),48 h(0.515±0.054),不同時間實驗組與對照組相比,integrin α2 mRNA表達均顯著提高(P<0.05)。結論 Integrin α2在體外培養乳鼠海馬癲癇神經元中表達增加,推測integrin α2可能參與了細胞持續自發性放電后神經網絡的重組過程。
整合素α2 神經網絡 無鎂液 癲癇細胞模型
癲癇的發病機制尚未完全明確,目前神經網絡學說正受到普遍關注[1]。研究證實,難治性癲癇患者中,一系列的細胞外基質(extracellular matrix,ECM)分子表達呈上調趨勢,并誘發齒狀回苔蘚纖維出芽,形成異常突觸聯系[2-3]。而整合素(integrins)是層粘連蛋白 (laminin)等ECM分子的主要受體之一,參與了多種正常細胞及腫瘤細胞的遷移過程[4]。Integrins是由α和β組成的異二聚體結構,integrin α2是α亞單位的亞型之一。本實驗通過建立小鼠難治性癲癇細胞模型,并以正常體外培養的神經元為對照組,對integrin α2的蛋白和mRNA表達水平進行檢測,探討其與神經元異常網絡形成的關系及在難治性癲癇發病機制中的作用。
1 材料與方法
1.1 研究對象 選用出生24 h內的昆明小鼠,雌雄不限,由廣西醫科大學動物中心提供。
1.2 細胞模型制備
1.2.1 細胞培養 分離并剪碎雙側海馬組織,0.125%胰酶37℃消化20 min。含血清培養液中止消化,輕柔吹打,細胞篩過濾,離心后棄上清,以5~7 ×105的密度接種在底部放有0.01%多聚賴氨酸包被過的蓋玻片的6孔培養板中,2 mL/孔。37℃、5% CO2細胞培養箱內培養24 h后全量換為無血清培養液 (NEUROBASALTM-A Medium+B27,Gibco)繼續培養。第7天采用神經元特異性神經絲蛋白(Neurofilament-200,NF-200)多克隆抗體 (1∶500,Santa Cruz)對細胞進行鑒定及神經元純度計算。
1.2.2 模型構建 分為對照組及實驗組。參照Sambati法[5],實驗組第7天用無鎂細胞外液培養3 h后恢復無血清培養液繼續培養。無鎂細胞外液(mmol/L):NaCl 145、KCl 2.5、HEPES 10、CaCl22、glucose 10、glycine 0.002,pH 7.2。對照組全量換液一次。
1.3 Integrin α2蛋白表達檢測 將對照組及實驗組12 h,24 h,48 h細胞爬片取出采用鏈霉菌抗生物素蛋白-過氧化物酶連接法免疫染色,一抗為兔抗小鼠integrin α2多克隆抗體(1∶200,Santa Cruz),采用羊抗兔生物素化二抗(1∶200,北京中杉),隨機圖像采集,image pro plus6.0圖像分析軟件測量棕黃色陽性表達區的mean IOD。
1.4 Integrin α2 mRNA表達檢測 提取對照組及實驗組12 h,24 h,48 h細胞總RNA,逆轉錄后PCR:integrin α2,上游序列:5′-GGCTTTAATGATGT GATTGTCG-3′,下游序列:5′-GGGTTATCTTAGCA TCCTTGTTG-3′,產物長度:328 bp(上海生工);內參β-actin上游序列:5′-ATCCACGAAACTACCTTC AA-3′,下游序列:5′-ATCCACACGGAGTACTTGC-3′,產物長度:200 bp(Invitrogen)。退火溫度57℃30 s,循環數30。電泳后進行OD測定。
1.5 統計學方法 采用SPSS 13.0進行多組間統計分析,數據用x±s表示,采用完全隨機設計的單因素方差分析檢驗,檢驗水準α=0.05。
2 結果
2.1 細胞形態及神經元鑒定 神經元接種24 h后完全貼壁,部分長出短小突起。第7天,胞體增大、飽滿,呈橢圓形或三角錐形,分布較均勻,表面光滑,折光性強,突起相互連接,交織成網絡。無鎂液處理3 h,神經元形態及神經網絡光鏡下均未見明顯變化。恢復無血清培養液培養24 h,細胞遷移,神經網絡出現“網格樣”變化,隨時間延長,部分神經元胞體相互聚集融合,神經網絡的“網格”樣變化更為明顯(圖1A,B)。
經NF免疫染色后,胞漿和突起染成棕色的細胞為神經元,神經元純度接近90%(圖2)。
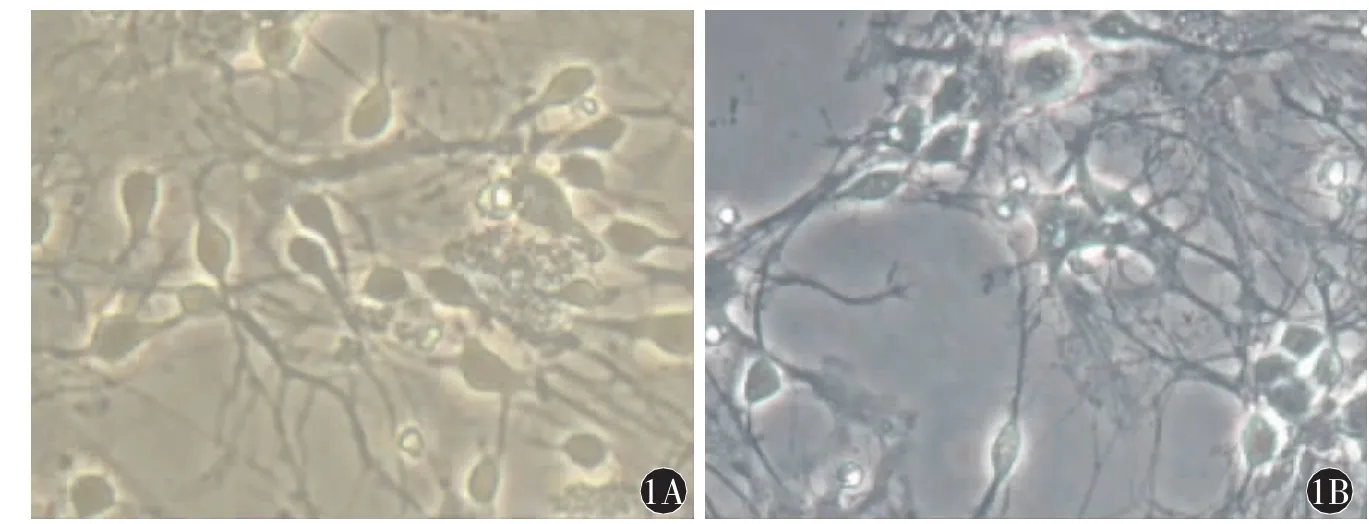
圖1 細胞形態。A:對照組分離培養7 d的海馬神經元(200×);B:實驗組24 h的海馬神經元(200×),細胞遷移,網絡重組
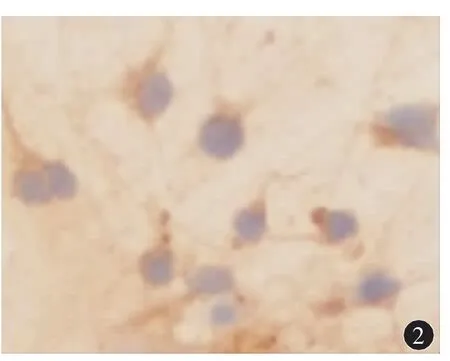
圖2 神經元鑒定NF-200免疫染色(200×)
2.2 Integrin α2蛋白表達的比較 各組細胞爬片中軸突與胞漿均有integrin α2的蛋白表達,以軸突部位的表達更為顯著。與對照組相比,實驗組各時間點蛋白表達顯著增加,12 h即達到峰值,其后時間組一直維持在較高水平,差異有統計學意義(P<0.05)(見表1及圖3)。
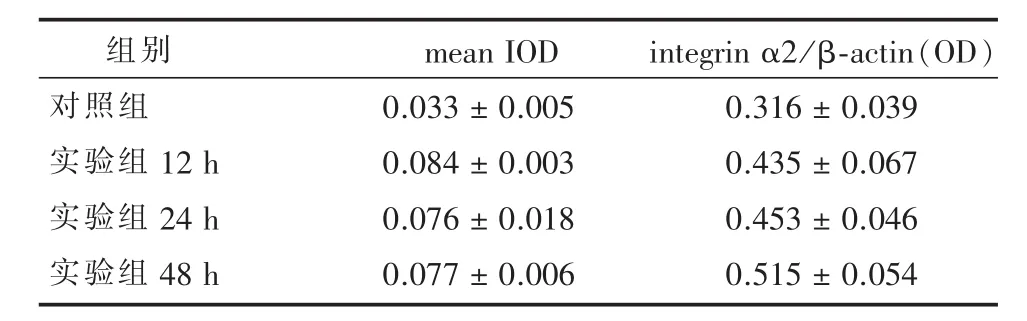
表1 各組小鼠海馬神經元integrin α2蛋白表達mean IOD值及mRNA表達
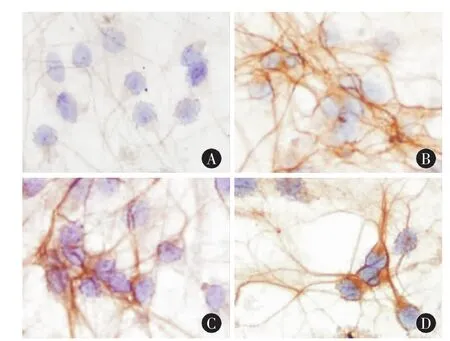
圖3 神經元integrinα2蛋白表達 A:對照組(400×);B:實驗組12 h(400×);C:實驗組24 h(400×);D:實驗組48 h(400×)
2.3 Integrin α2 mRNA表達的比較 實驗組各時間點與對照組相比integrin α2 mRNA表達均增加(P<0.05),差異有統計學意義(P<0.05),說明無鎂液處理后神經元integrin α2 mRNA處于高表達水平(見表1及圖4)。
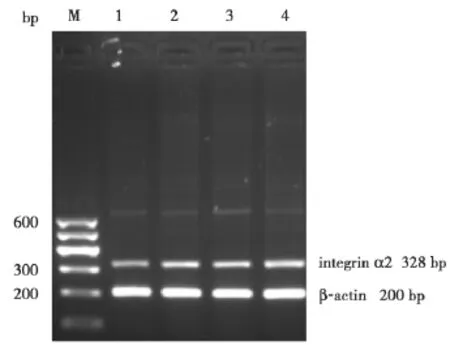
圖 4 各組小鼠海馬神經元 integrin α2 mRNA電泳結果。M:Marker;1:對照組;2:實驗組12 h;3:實驗組24 h;4:實驗組48 h
3 討論
神經網絡學說[1]認為,癲癇狀態下,神經元異常放電誘使苔蘚纖維出芽,神經網絡的重組導致耐藥性難治性癲癇的形成[6]。近期研究觀察到匹羅卡品致癇大鼠海馬微清蛋白中間神經元數目變化及軸突出芽[7],反復驚厥閾下癇樣放電也能導致海馬齒狀回顆粒細胞樹突改變[8]。Integrins胞外區結合配體分子,胞內區與細胞骨架蛋白相連,將胞內外信號進行整合,在細胞黏附、增殖、分化、侵襲、遷移、凋亡等行為起著重要的調節作用[9]本研究構建癲癇細胞模型后不僅觀察到神經元發生遷移,胞體聚集,神經網絡出現“網格樣”改變,而且檢測出癲癇神經元細胞integrin α2蛋白及mRNA表達均增高,蛋白表達以軸突部位的改變最為顯著。提示integrin α2可能參與了神經網絡的重組行為。其表達增高的原因一方面可能由于ECM中integrin配體分子表達上調所致。有研究表明在人類難治性癲癇患者海馬腦組織發現laminin表達增高[10]。laminin是ECM分子家族中integrin的配體分子之一,在病理狀態下,由于長期自發性反復性放電導致累積性神經元損傷,反應性增生的膠質細胞及神經元可釋放大量促進神經再生的因子如laminin等其他ECM分子,刺激神經細胞突起的生長,以修復損傷的部位[11]。因此當大量的配體分子結合到細胞表面時,不僅促使integrin受體分子聚集,也誘導細胞表達更多的受體分子以完成損傷的修復。另一方面神經元的凋亡也能促使integrin表達增高。機體中細胞團聚在一起,緊密黏附于ECM,形成行使功能和賴以生存的局部微環境。由于癲癇反復發作,細胞壞死及細胞外微環境發生改變,細胞脫離細胞黏附基質,失去細胞間聯結,引起失巢性凋亡[12]。Integrin與配體結合后將誘導產生促進細胞生存的信號,增強細胞間及細胞與ECM的粘附,并同時促進細胞運動,轉移細胞,防止失巢性凋亡的發生。若細胞所在微環境不含有相應的配體與之結合,integrin在胞漿內的尾部便會通過啟動半胱天冬酶-8(caspase-8),誘使細胞發生凋亡[13]。所以癲癇狀態下,laminin等ECM分子表達上調能達到間接抑制凋亡修復損傷的目的,可能為機體調控手段之一。
癲癇發病機制復雜,本研究在癲癇細胞模型中觀察到神經元發生遷移并檢測到integrin表達顯著增高,提示其表達量的變化直接或間接的通過介導細胞粘附與遷移影響著神經網絡的重組,并可能參與了神經細胞抗凋亡調控。研究integrin介導的信號轉導途徑也有利于開展integrin靶向藥物的研究,阻斷integrin介導的信號轉導作用有望干擾神經元遷徙與生長,打破神經元網絡重組,進而減緩控制了癲癇的發作。
[1] 黃紹平,李丹.難治性癲癇的發病機制研究進展及前景展望[J].臨床兒科雜志,2009,(11):1001-1004.
[2]Heck N,Garwood J,Loeffler JP,et al.Differential upregulation of extracellular matrix molecules associated with the appearance of granule cell dispersion and mossy fiber sprouting during epileptogenesis in a murine model of temporal lobe epilepsy[J].Neuroscience,2004,129(2):309-324.
[3]Wu Y,Wang XF,Mo XA,et al.Expression of laminin beta1 in hippocampi of patients with intractable epilepsy[J].Neurosci Lett,2008,443(3):160-164.
[4] 鄒彩艷,文飛球,陳亦欣,等.整合素α2β1對神經母細胞瘤細胞侵襲遷移的影響[J].中國當代兒科雜志,2008,10(3):386-390.
[5]Sombati S,Delorenzo RJ.Recurrent spontaneous seizure activity in hippocampal neuronal networks in culture[J].J Neurophysiol,1995,73(4):1706-1711.
[6] 王學峰.難治性癲癇概念、組成、發病機制研究[J].中國當代醫學,2001,12(7):57-59.
[7] 龍莉莉,肖波,宋延民,等.匹羅卡品致癇大鼠的海馬PV中間神經元數目變化及其軸突出芽[J].中國神經精神疾病雜志,2011,37(1):15-19.
[8] 向陽,王慶松,鄭宇.反復驚厥閾下癇樣放電致海馬齒狀回顆粒細胞樹突改變[J].中國神經精神疾病雜志,2009,35(4):223-227.
[9]Harburger DS,Calderwood DA.Integrin signalling at a glance[J].J Cell Sci,2009,122(Pt 2):159-163.
[10]Wu Y,Wang XF,Mo XA,et al.Expression of laminin beta1 in hippocampi of patients with intractable epilepsy[J].Neurosci Lett,2008,443(3):160-164.
[11]Ransom B,Behar T,Nedergaard M.New roles for astrocytes(stars at last)[J].Trends Neurosci,2003,26(10):520-522.
[12]Douma S, Van Laar T, Zevenhoven J, et al.Suppression of anoikis and induction of metastasis by the neurotrophic receptor TrkB[J].Nature,2004,430(7003):1034-1039.
[13]黃文林.信號轉導[M].北京:人民衛生出版社,2005,241-247.
The expression of integrin α2 in the hippocampal neuronal culture model of epilepsy.
SU Jie, WU Yuan,WU Yuejuan,MA Meigang,TANG Yulan,YU Lu,LIU Yun,LI Jiaquan.Department of Neurology,the First Affiliated Hospital,Guangxi Medical University,Nanning 530021,China.Tel:0771-15356735.
Object To investigate the expression of integrin α2 and explore its role in the hippocampal neuronal culture model of epilepsy.Methods The hippocampal neurons were isolated from 1-day mouse and cultured in vitro.On the 7th day,the neurons were divided into control group and experimental groups.In experimental groups, 3 h Mg2+-free treatment was utilized to mimic status epilepticus injury in vitro.The immunohistochemical staining and RT-PCR were used to detect the protein and mRNA expression levels of integrinα2 in control and experimental groups.Results Neuronal cells migrated and formed“grid-like”network after Mg2+-free treatment.The average optical densities(mean integrated optical density,mean IOD)of integrin α2 protein expression were 0.033±0.005 in control group and 0.084±0.033,0.076±0.018 and 0.077±0.006 at 12,24 and 48 h after Mg2+-free treatment.The protein expression levels of integrin α2 in experimental groups were significantly higher compared with control groups(P<0.05).The protein expression levels of integrin α2 maintained twp folds of normal value during 12-48 h after Mg2+-free treatment.RT-PCR showed that the ratio of optical densities of integrin α2 and β-actin was in control groups,0.316±0.039,0.435±0.067,0.453±0.046 and 0.515±0.054 at 12,24 and 48 h after Mg2+-free treatment.Both of protein and mRNA expression levels of integrin α2 increased significantly in experimental groups at any point-in-time compared with the control group(P<0.05).Conclusions The integrin α2 expression increases in the hippocampal neuronal culture model of epilepsy, suggesting that integrin α2 may participate in epilepsy-induced network reorganization.
integrin α2 neural network Mg2+-free Cculture model of epilepsy
R742.1
A
2010-11-20)
(責任編輯:李 立)
☆ 國家自然科學基金(編號:30960111)
* 廣西醫科大學第一附屬醫院神經內科 (南寧 530021)
(E-mail:wuyuan90@126.com)
△ 廣西醫科大學實驗中心

