腦梗死非溶栓治療出血性轉化的MR分型與預后相關性研究
卑貴光,李松柏,馬 虹,程志亮,蔣寶國,李 響
(1.沈陽軍區202醫院放射科,遼寧 沈陽 110812;2.中國醫科大學附屬第一醫院放射科,遼寧 沈陽 110001;3.中國醫科大學附屬第四臨床學院放射科,遼寧 沈陽 110025;4.大連醫科大學附屬第二臨床學院放射科,遼寧 大連 116014)
急性缺血性腦梗死發病24h內進行溶栓治療是廣為使用的治療手段,但梗死后自然出血及繼發于溶栓治療的腦內出血給臨床醫生決定是否采取溶栓治療帶來了難解的困惑[1-2],因此臨床上采用非溶栓性治療方法的比例逐漸增加。國內外學者的研究多集中在血管內rt-PA治療與安慰劑治療的對照方面。腦梗死出血性轉化(Hemorrhagic transformation,HT)的分類普遍采用CT影像作為依據,在HT分型與預后相關性方面的研究結果中存在著嚴重的分歧。核磁共振(MR)是目前最優異的神經系統檢查手段,對于急性梗死及出血的檢出及范圍的正確判定是CT所不及的,而目前國內外尚無關于非溶栓性治療腦梗死HT的MR研究報道,本研究利用MR對不同部位、不同范圍非溶栓性治療的腦梗死病例進行分析及跟蹤,并與發病3個月后預后的相關性進行分析,以求確定更加利于判斷預后的HT的MR分型方法。
1 材料與方法
1.1 一般資料
收集2007年10月~2009年11月在沈陽軍區202醫院就診的421例急性腦梗死病例,其中男263人(62.5%),女158人(37.5%),年齡21~92歲,平均68歲。所有患者于發病后1~12h內來院進行頭部CT平掃檢查,除外單純顱內出血性病變,經臨床確診為腦缺血性病變而收入院行非血管內溶栓治療,全部患者于發病后3~7d行頭顱MR檢查,其中彌散加權(DWI)圖像上沒有高信號的病例不列為研究對象。
1.2 檢查方法
CT掃描使用 Philips Tomoscan AV螺旋 CT機,掃描參數:120kV,175mA,2.0s,FOV 250mm,層厚7.0mm,矩陣320×320。
MR掃描使用GE Signal 1.5T MR機,掃描序列及參數:T1WI,TR/TE=400ms/15ms;T2WI,TR/TE= 4000ms/85ms;層厚 5.0mm,層間隔 1.5mm,FOV 240mm×180mm,矩陣320×256,NEX 2。DWI,B值1000,TR/TE=10000ms/3000ms,層厚5.0mm,層間隔1.5mm,FOV 240mm×210mm,矩陣 128×128,NEX 1,在3個方向上施加擴散梯度,掃描時間40s。T2*WI,GRE序列,TR/TE=500ms/15ms,層厚5.0mm,層間隔1.5mm,翻轉角20°,FOV 240mm×210mm,矩陣256×192,NEX 1。
所有CT及MR資料由2名不知患者病情的放射學專家進行獨立評判。
1.3 治療方案
所有患者依據臨床需要、患者及家屬知情同意權所做的選擇來采取不同的非血管內溶栓治療方法,包括脫水、抗血小板、擴張血管、營養神經、清除自由基、降纖等,并對基礎疾病進行相關治療。
1.4 HT的確定標準
發病后首次CT未發現腦內急性出血,復查MR發現腦內不同范圍DWI高信號梗死病灶內的短T1信號病灶或等T1短T2信號病灶或GRE序列低信號灶(對照CT除外鈣化)。
1.5 梗死面積測量及HT分類
梗死面積的測量采用Functiontool軟件,測量DWI上高信號病灶面積,大面積梗死定義為梗死灶面積大于3.0cm2并累及2個以上解剖學部位的大血管主干供血區。
HT的MR分類方法綜合Adams腦梗死分類標準[3]及歐洲急性中風學會(ECASS)HT分類方法[1],制定初步分型標準:Ⅰ級,梗死灶面積小于1.5cm2,伴有點狀、融合淤點狀或皮質出血(非血腫性);Ⅱ級,梗死灶位于前循環單一供血區域,面積為 1.5~ 3.0cm2,伴有非血腫性出血;Ⅲ級,梗死灶位于腦干或小腦,面積為1.5~3.0cm2,伴有非血腫性出血;Ⅳ級,大面積腦梗死,伴有非血腫性出血,無占位效應;Ⅴ級,大面積腦梗死,伴有血腫形成,有占位效應。
1.6 預后評估
對患者3個月后的恢復情況進行面對面的檢查(386例)或電話問答(35例),預后評估標準依據修訂的Rankin量表(mRs)分為預后良好及預后不良,其中預后良好為mRs 0~2,預后不良為mRs 3~5或死亡。
1.7 統計分析
對伴有HT的腦梗死患者的MR分型與預后相關性進行單因素分析,并進行χ2檢驗。
所有數據應用SPSS 13.0軟件包進行分析。
2 結果
MR分型方法修訂前,421個研究對象中 (表1),31人出現HT(7.4%),其中Ⅰ級 (圖1)1人(0.24%),Ⅱ級(圖2)9人(2.1%),Ⅲ級(圖3)4人(0.95%),Ⅳ級(圖4)14人(3.3%),Ⅴ級(圖5)3人(0.7%)。HTⅢ級(P=0.01)、Ⅳ級(P=0.003)和Ⅴ級(P=0.001)增加了預后不良的危險性,而Ⅰ級 (P= 0.24)和Ⅱ級(P=0.45)與預后不良的危險性無關。
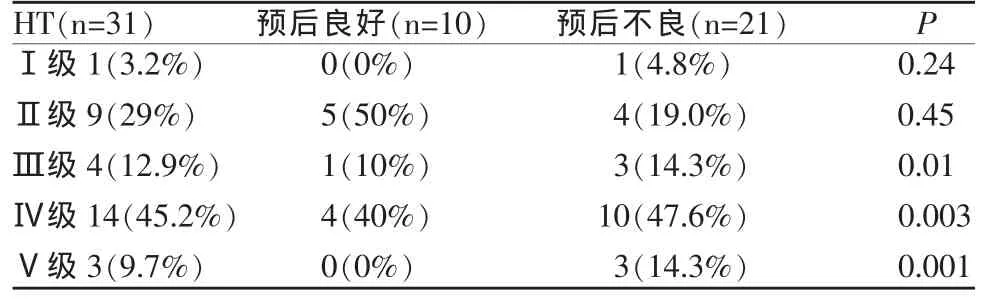
表1 修訂前HT的MR分型與預后
MR分型方法修訂后(表2),Ⅰ級(圖1,2)10人(2.34%),Ⅱ級(圖3)4人(0.95%),Ⅲ級(圖4,5)17人(4%)。HTⅡ級(P=0.01)、Ⅲ級(P=0.003)與預后不良顯著相關,而Ⅰ級(P=0.33)與預后不良的危險性無關。

表2 修訂后HT的MR分型與預后
3 討論
3.1 腦梗死與HT的CT及MR研究方法比較
對于梗死后出血的影像學分型,現在國際上普遍接受的是ECASS及美國國立神經疾病及卒中研究所(The National Institute of Neuro-logical Disorders and Stroke,NINDS)[4]的分型標準,這兩種分型方法都采取了CT的系列資料作為分型依據,對靜脈內rt-PA治療組與安慰劑治療組進行對照研究,研究對象多只局限于單一大血管病變 (尤其是大腦中動脈)或大面積梗死患者,忽略了包括腦干梗死等小梗死灶的研究,這也是導致不同研究中心的研究結果之間差異較大的原因[5-6]。但是大部分學者們都認為血腫型HT應該作為臨床治療安全性的臨界點,臨床應將研究重點放在如何避免或者減少血腫-2型的發生[7-9]。

CT圖像一直以來都作為急性腦梗死的首選檢查手段,但CT檢查技術本身存在的局限性使得一部分腦梗死病例并不能得到及時而準確的診斷,它不能準確區分急性梗死與慢性缺血(脫髓鞘),因此對于一些白質區的低密度慢性缺血灶,很可能被誤判為急性梗死;對于小腦及腦干的急性梗死灶,由于顱底骨偽影的干擾,也不易準確判定。在我們的研究中,腦干和/或小腦發生梗死或其它部位梗死合并腦干和/或小腦梗死的病例占30.2%(127/421),其中58例(45.7%)預后不良,都高于以往研究的發生率,說明現有CT分型方法明顯存在病例統計方面的不足,從而直接影響了研究結論的科學性。而MR技術則可以很好地彌補以上不足,DWI可以準確區分急性腦梗死和慢性缺血灶,我們的研究將DWI上存在高信號病灶作為入選病例標準,保證了所有研究對象的急性腦梗死診斷的準確性,同時發生于小腦及腦干的急性梗死灶也不會遺漏,使得我們的研究較之以往的同類CT研究在病例入選方面更具科學性。而MR在急性腦出血的檢出方面也越來越接近CT的敏感性,尤其是GRE序列、磁敏感序列等的應用,使得MR對于急性梗塞及出血的診斷價值越來越高。
3.2 HT的MR分型與預后
現有研究已經證明,梗死面積是決定預后的重要因素,大面積腦梗死產生的繼發性腦水腫會導致嚴重的中線移位,進而導致顳葉溝回疝、小腦扁桃疝等,文獻報道病死率為30%~80%,存活者也會產生神經功能嚴重缺損,生活質量低下[10]。因此我們將梗死面積與梗死后出血兩者綜合考慮,制定出關于非溶栓治療的HT的MR分型標準,在我們的研究中,早期HT發生率為7.4%(31/421),其中僅0.7%(3/421)發生梗死后血腫形成,說明血腫發生率較低,但血腫與預后不良相關,這與現有研究結論相符。
HT分類應該以梗死面積為依據還是應該把發病部位考慮在內?本研究認為,腦的各部位功能分區明確,腦組織損傷部位的不同,或許將決定預后的好與壞,尤其是腦干這樣集中了呼吸、循環等重要生命中樞,并且是所有神經傳導束通過的器官,很小面積的梗死或出血就可能導致嚴重的神經功能不良或死亡。
在我們的研究中,初步分型標準中Ⅰ級和Ⅱ級HT都與預后不良不相關,因此可以將它們合并考慮;HTⅢ級、Ⅳ級和Ⅴ級都增加了預后不良的危險性,說明繼發于大面積梗死或腦干及小腦梗死的HT是決定預后的關鍵因素,這符合由于梗死后腦水腫形成及HT加重腦水腫形成的病理過程。腦干及小腦梗死的HT,因其發病部位的特殊性以及與預后的明顯相關性,仍可以作為獨立的一型進行研究。而原自定義分型標準中Ⅳ級和Ⅴ級都與預后不良相關,出血的形態不影響對預后的判定,也可以合并考慮。因此我們最終將原自定義HT的MR分型簡化為3級:Ⅰ級,前循環腦內梗死面積小于3.0cm2,伴有點狀、斑片狀或皮質出血;Ⅱ級,梗死位于腦干或小腦,伴有點狀、斑片狀或皮質出血;Ⅲ級,前循環大面積腦梗死,伴有不同程度的出血。該分型方法綜合考慮了梗死面積、部位及出血形態,經過大樣本數據的統計研究證明與預后的相關性良好(表2),應該對急性腦梗塞非溶栓治療具有一定的指導意義,但是該分型方法尚需進行多中心大樣本的檢驗。
[1]Fiorelli M,Bastianello S,von Kummer R,et al.Hemorrhagic transformation within 36 hours of a cerebral infarct:relationships with early clinical deterioration and 3-month outcome in the European Cooperative Acute Stroke Study I (ECASS I)cohort[J]. Stroke,1999,30(11):2280-2284.
[2]楊勇,于臨源,趙曉東.大面積腦梗死治療的臨床研究[J].中國實用醫藥,2009,6(4):66-67.
[3]Adams HP Jr,Bendixen BH,Kappelle LJ,et al.Classification of subtype ofacute ischemic stroke.Definitions foruse in a multicenter clinical trial.TOAST.Trial of Org 10172 in Acute Stroke Treatment[J].Stroke,1993,24(1):35-41.
[4]The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group.Tissue plasminogen activator for acute ischemic stroke[J].N Engl J Med,1995,333(24):1581-1587.
[5]Trouillas P,von Kummer R.Classification and pathogenesis of cerebralhemorrhagesafterthrombolysisin ischemic stroke[J]. Stroke,2006,37(2):556-561.
[6]Aleu A,Mellado P,Lichy C,et al.Hemorrhagic complications after off-label thrombolysis for ischemic stroke[J].Stroke,2007, 38(2):417-422.
[7]DzialowskiI,Pexman JH,BarberPA,etal.Asymptomatic hemorrhage after thrombolysis may not be benign:prognosis by hemorrhage type of the Canadian alteplase for stroke effectiveness study registry[J].Stroke,2007,38(1):75-79.
[8]Molina CA,Alvarez-Sabín J,Montaner J,et al.Thrombolysisrelated hemorrhagic infarction:a markerofearly reperfusion, reduced infarctsize,and improved outcome in patientswith proximal middle cerebral artery occlusion[J].Stroke,2002,33(6): 1551-1556.
[9]Khatri P,Wechsler LR,Broderick JP.Intracranial hemorrhage associated with revascularization therapies[J].Stroke,2007,38(2): 431-440.
[10]Lo RS,Cheng JO,Wong EM,etal.Handicap and its determinants of change in stroke survivors:one-year follow-up study[J].Stroke,2008,39(1):148-153.

