茉莉花愈傷組織誘導及懸浮細胞培養
莊哲煌,蔡漢權,陳丹生
(韓山師范學院生物系,廣東潮州,521041)
茉莉花愈傷組織誘導及懸浮細胞培養
莊哲煌,蔡漢權,陳丹生
(韓山師范學院生物系,廣東潮州,521041)
以茉莉花(Jasminum sambac)花瓣為外植體在不同培養基上誘導出愈傷組織,通過對其類型的篩選從中選擇疏松愈傷組織進行懸浮培養后,初步建立懸浮細胞培養系。結果表明,不同激素可誘導出疏松型(CA)、泥狀型(CB)和綠色塊狀型(CC)愈傷組織,其分化方向也不同。用CA型和CB型愈傷組織均能建立懸浮細胞培養系,其中以泥狀愈傷組織為起始材料較佳,大約11 d可建立初步的懸浮細胞培養系。
茉莉花;愈傷組織;懸浮細胞培養
茉莉花 (Jasminum sambac)屬木犀科素馨屬植物,常綠攀緣灌木,茉莉鮮花瓣中含芳香油0.2%~0.3%,主要成分是苯甲醇及其酯類,可以制作香精并應用于日常化妝品、洗滌用品和食用香精中[1]。因市場需求提高,從而帶動了人們對茉莉花的栽培和香精油提取的研究,如《茉莉栽培淺談》[2]、《茉莉花的化學成分》[3],其產品市場已趨成熟。但是,目前各種提取方法都需將整朵花進行破壞,茉莉花香精油提煉效率較低[1]并受季節限制,制約了茉莉香精提取業的發展。如果能運用細胞工程手段,利用細胞大量培養及代謝產物分離,提高茉莉花香精油的提取效率,同時避免盛花季節對工業生產帶來的影響,那么將對今后茉莉花的生產與利用具有重要的意義。
通過懸浮細胞培養產生代謝產物以促進工業化生產,是現代生物工程技術迅速發展的一個方向。目前至少已在200種植物上生產500種以上的有用成分[4],如白雪芳等[5]、蔡漢權等[6]、林龍云等[7]、李玲等[8]、Chen等[9]、Liang等[10]、Tang等[11]分別在三尖杉、羅勒、太子參、野葛、煙草(tobacoo)、苦楝樹(neem tree)、人參(panax ginseng)等植物的懸浮培養中闡述了愈傷組織的形成、懸浮培養系的建立及其產物的研究。茉莉花組織培養方面的研究很少,江明等[12]在1994年報道了《大花茉莉的組織培養和植株再生》,而茉莉花瓣誘導愈傷組織及其懸浮細胞培養則未見報道。因此本文通過研究茉莉花花瓣誘導愈傷組織和建立茉莉花懸浮細胞培養系的方法,為進一步應用于原生質體分離、細胞培養、次級代謝產物生產等研究打下基礎。
1 材料與方法
1.1 試驗材料
茉莉花(Jasminum sambac)花苞內層的花瓣。
1.2 試驗方法
①取材和消毒 從校園花圃采集茉莉花花苞,將整個花苞連同花托、花柄一起剪下,于肥皂水中浸泡30 min。接種前將花托去掉、整個花苞置于0.1%的HgCl2溶液中浸泡8 min,后將花苞撈出,用無菌水清洗3~4次,置于無菌吸水紙上。接種時將花苞切開,除去外2層花瓣,取內部花瓣平貼于培養基上,每瓶接種3~4個花瓣。
②愈傷組織的誘導 將花瓣接入誘導培養基(BK1、BK2、BK3、BK4、BK5、BK6),誘導出愈傷組織后選擇BK5培養基繼代培養2 w。調整激素配比,用分化培養基(F1、F2、F3、F4、Y1、Y2、Y3、Y4)誘導并篩選各種類型的愈傷組織。
誘導培養基BK1:MS+6-BA 0 g/L+NAA 0 g/L;BK2:MS+6-BA 0.2 g/L+NAA 0.2 g/L;BK3:MS+6-BA 0.5 g/L+NAA 0.2 g/L;BK4:MS+6-BA 1 g/L+NAA 0.2 g/L;BK5:MS+KT 1 g/L+2,4-D 1 g/L;BK6:MS+KT 1 g/L+2,4-D 2 g/L。繼代培養基BK5:MS+KT 1 g/L+2,4-D 1 g/L。分化培養基F1:MS+KT 0.5 g/L+2,4-D 0.2 g/L;F2:MS+ KT 0.5 g/L+2,4-D 0.5 g/L;F3:MS+KT 0.5 g/L+2,4-D1 g/L;F4:MS+KT 0.5 g/L+2,4-D 2 g/L。Y1:MS+6-BA 0.2 g/L+NAA 0.2 g/L;Y2:MS+6-BA 0.5 g/L+NAA 0.2 g/L;Y3:MS+6-BA 1 g/L+NAA 0.2 g/L;Y4:MS+6-BA 2 g/L+ NAA 0.2 g/L。

表1 誘導培養基上愈傷組織的誘導情況
培養基配制條件:附加蔗糖30 g,瓊脂9.2 g/L,pH值5.8~6.0,121℃高壓滅菌20 min。
外植體培養條件:溫度23~27℃,光照強度1 500 lx,光周期12 h/d。
③茉莉花花瓣懸浮細胞系的建立 經過分化培養基的培養,愈傷組織出現了不同的生長、分化情況,其中F3培養基能誘導出泥狀愈傷組織。將F3培養基去除瓊脂,其液體培養基F5作為懸浮細胞的培養基。
F5:MS+KT 0.5 g/L+2,4-D 1 g/L的液體培養基,其蔗糖濃度為30 g/L,pH值5.8~6.0,配制后分裝于100 mL三角錐形瓶中,每瓶裝培養基20 mL,121℃滅菌20 min,備用。
將CA、CB和CC 3種類型的愈傷組織分別接入F5培養基,接種量為每瓶0.3~0.5 g,每種材料接種8瓶。將其在超凈工作臺上無菌接種后置于搖床上進行液體振蕩培養,培養條件為溫度28℃,弱光150 lx,光周期12 h/d,振蕩速度為120 r/min。接種5 d后第一次鏡檢,并進行繼代,即吸取渾濁但無較大組織塊的液體培養基接入新鮮F5培養基繼代培養,直至形成分散、快速生長的懸浮細胞系。
2 結果與分析
2.1 愈傷組織的誘導與分化結果
①不同誘導培養基上愈傷組織的誘導茉莉花瓣在BK1~BK66種培養基的誘導下,開始出現變化,20 d后統計其愈傷組織的誘導數,結果見表1。
BK1~BK4這4種培養基中的花瓣于12 d后開始出現膨大,瓣沿出現顆粒狀鼓起,后顏色由白轉黃,停止變化,最終啟動失敗,無愈傷組織出現。
表1中BK5于10~12 d后開始出現乳白色愈傷組織,且細胞擴展迅速。BK6于15 d后開始出現白色愈傷組織,擴展速度一般。而將BK5繼代10~12 d后接入8種分化培養基進行誘導,愈傷組織出現綠色、黃綠色、淺綠色、乳白色、黃白色和褐色;塊狀、泥狀、粒狀等不同分化類型(表2)。在繼代過程中,CA型與CB型部分出現黃色分泌物(圖1),初步推測為其代謝產物,這與本試驗的研究目的與方向相符。也由此說明,激素類型的選擇與搭配對愈傷組織的誘導有顯著影響,KT與2,4-D的組合明顯優于6-BA與NAA的組合。BK5:MS+KT 1 g/L+2,4-D 1 g/L是茉莉花瓣愈傷組織誘導的適宜培養基。

圖1 愈傷組織產生的黃色代謝產物
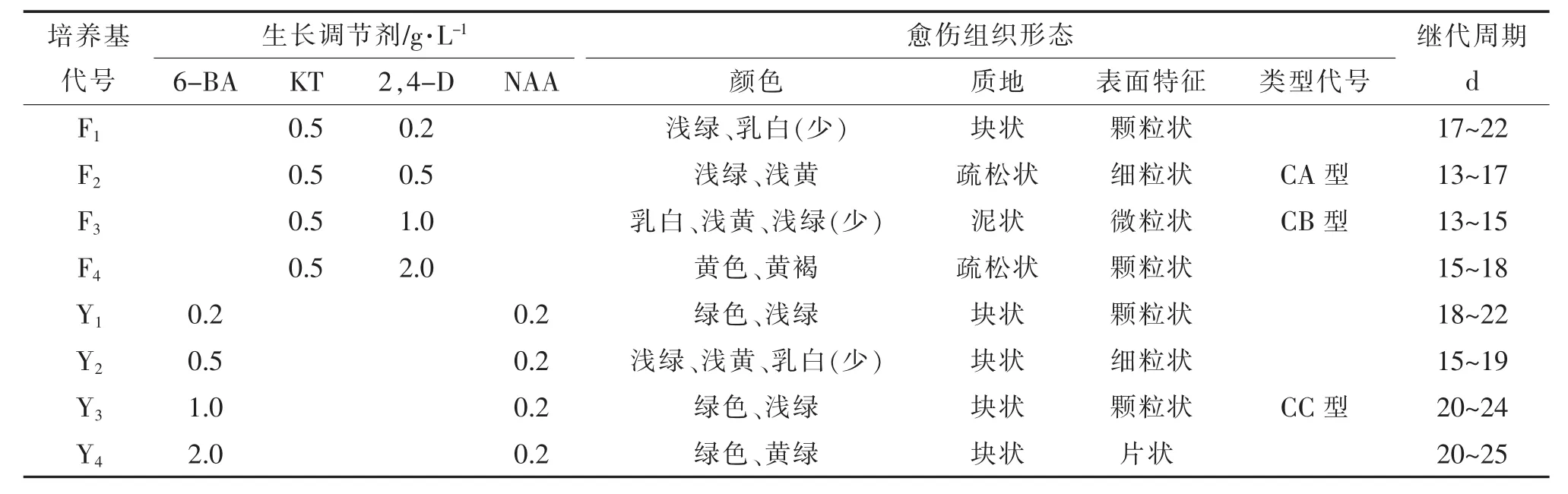
表2 不同培養基下愈傷組織的分化情況

圖2 CB型愈傷組織涂片:分散的單細胞及小細胞團

圖3 CB型懸浮細胞:分散性良好

圖4 CB型懸浮細胞:分散性好,分裂快
②愈傷組織類型的分化。選擇BK5培養出的愈傷組織,接入8種分化培養基中進行誘導,經過30 d進行統計,結果出現CA型、CB型和CC型3種具有代表性的愈傷組織(表2)。
CA型為疏松型愈傷組織,以黃色為主,少數淺綠色、松散易夾碎,含有一定水分,亦稱沙狀。
CB型為泥狀愈傷組織,以乳白色為主,表面濕潤。其細胞活力強、生長迅速,非常松散,含水分最多。繼代培養時在固體培養基上將其平鋪攤開,再挑去大塊的愈傷組織,經過2~3次繼代后就能得到微粒狀愈傷組織,即是泥狀。將此愈傷組織在玻片上作涂片,可見單細胞及小細胞團(圖2)。
CC型為塊狀愈傷組織,綠色或黃綠色,難夾碎需用刀切開,水分很少,表面有綠色顆粒狀突起,有誘導芽的能力,試驗過程中已從CC型愈傷組織誘導出根。
3種愈傷組織相比,CB型愈傷組織最為松散,適合作為建立懸浮細胞系的起始材料,CA型和CC型則作為對比材料。
由此可見,激素類型和濃度對愈傷組織的生長、分化有明顯影響,低濃度(F1,Y1)下愈傷組織生長慢,繼代周期較長,狀態為粒狀和塊狀;高濃度(F4,Y4)下愈傷組織易出現變褐、變硬等老化現象。說明F3:MS+KT 0.5 mg/L+2,4-D 1 mg/L適宜愈傷組織培養及分化。
2.2 茉莉花愈傷組織類型對懸浮細胞系建立的影響
分別將已繼代的CA型、CB型和CC型愈傷組織接入20 mL的F5培養液,每瓶0.3~0.5 g,比較愈傷組織類型對懸浮細胞建立的影響。
結果表明,在接入CB型愈傷組織5 d后,懸浮液中有較多的單細胞和小細胞團出現。此時,盡量避免大塊愈傷組織,吸取部分渾濁液接入相同的新鮮培養液繼續振蕩培養,6 d后可獲得分散性良好的懸浮細胞系(圖3)。鏡檢表明,CB型愈傷組織所建立的懸浮細胞系需時較短,大概11 d,細胞分裂快、分散性好,整體生長迅速(圖4)。相比較之下,接入CA型愈傷組織振蕩培養5 d后,懸浮液的主要組成還是細胞團,繼代5 d后再鏡檢,才看到少數的單細胞和較多的小細胞團。而CC型愈傷組織是塊狀愈傷組織,只能切取其表面的顆粒狀愈傷組織接入,培養10 d后鏡檢,只出現極少的小細胞團,再經過10 d的培養,也只能得到少數的幾個單細胞,培養液中依舊為大塊培養物,懸浮培養失敗。
由此可見,愈傷組織類型對建立懸浮細胞系有明顯影響,CA型和CB型愈傷組織均可建立懸浮培養系,以CB型培養基為佳,而CC型為塊狀愈傷組織,不適合作為懸浮培養的起始材料。
3 小結與討論
3.1 影響愈傷組織成功誘導的因素
本試驗能成功誘導出愈傷組織,進而完成后邊一系列試驗,與培養基激素密切相關,同時外植體的取材和消毒也十分重要。
①培養基激素類型 呂冬霞等[13]認為,多數情況下,單獨使用2,4-D就可以成功誘導愈傷組織的發生,但容易受濃度高低的影響。生長素和細胞分裂素對保持愈傷組織的快速生長是非常必要的,特別是二者有效結合時,能更強烈地刺激愈傷組織的形成。本試驗證明,激素類型的選擇與搭配對愈傷組織的誘導有顯著影響,KT與2,4-D的組合是成功誘導愈傷組織形成的關鍵。而從2,4-D濃度的選擇及結果來看,與張素勤等[14]對非洲菊葉片愈傷組織的誘導試驗結果相同,誘導愈傷組織因生長素種類不同,所需濃度也不同。2,4-D以1.0 mg/L誘導效果最好,濃度升高,產生的愈傷組織量減少,而濃度降低,誘導率則下降。
②取材與消毒 在采集茉莉花花苞時,應盡量選擇膨大的即將開放的色澤乳白或米黃,無破損或裂縫的花苞,若破損或裂縫易受到污染或因消毒而被破壞。幼小花苞的花瓣容易枯萎或褐變,不宜作為外植體。消毒過后要用無菌水沖洗徹底,避免切開花苞后殘余消毒液對內層花瓣的傷害,導致外植體褐變或枯萎。
3.2 茉莉花懸浮細胞系建立的關鍵因素
本試驗能在10~11 d成功建立茉莉花懸浮細胞系,原因在于誘導出了CB型泥狀愈傷組織。CB型愈傷組織松散度高,細胞分裂快、生長快,是建立懸浮細胞系的較佳材料。另一個成功因素則是選擇了合適的培養基。液體培養基F5是從F3培養基去掉瓊脂而來,而F3培養基培養出了泥狀愈傷組織,說明其成分適合泥狀愈傷組織的生長,因此,F5也適用于懸浮培養中繼續培養泥狀愈傷組織,讓其更松散地生長和分裂。
3.3 CA型、CB型產生的黃色物質
在CA型、CB型愈傷組織的繼代、培養過程中,部分組織塊切口出現黃色物質,經鏡檢并非外侵細菌,因此初步推測為其次生代謝產物,由細胞分泌出來。當然,在建立懸浮細胞系的過程中,液體培養基本是無色透明的,在接入愈傷組織5~6 d后亦會變渾濁同時淡黃化。這種現象除細胞團的增多外,也與分泌出的黃色物質融于培養基中有關。這些次生代謝物是不是試驗最終想得到的茉莉花油,其含量又如何,有待進一步的研究和檢驗。
[1]張新發,肖希和,丁冬.茉莉花香料的提取及其應用的研究[J].武漢工業學院學報,2000(1):18-20.
[2]房兆軍.茉莉栽培淺談[J].農業知識,2004(2):33.
[3]劉海洋,倪偉,袁敏惠,陳昌祥.茉莉花的化學成分[J].云南植物研究,2004(6):687-690.
[4]曹有龍,許興,趙軍,等.麻黃愈傷組織細胞的懸浮培養[J].應用與環境生物學報,2000,6(1):36-38.
[5]白雪芳,王靖楣,卜宗式,等.三尖杉懸浮細胞的培養及抗癌生物堿的產生[J].中國生化藥物雜志,1999,20(3):139-142.
[6]蔡漢權,賴鐘雄,林珊珊,等.羅勒(Ocimum basilicum)懸浮細胞系的建立與保持[J].熱帶作物學報,2006,27(1):44-48.
[7]林云龍,周以飛,潘大仁.太子參細胞懸浮培養及其皂苷含量分析[J].熱帶亞熱帶植物學報,2005,13(6):499-504.
[8]張春榮,李玲.野葛幼葉細胞懸浮培養生產葛根素等異黃酮類化合物的研究[J].中草藥,2003(7):653-657.
[9]Chen H M,Yan C H,Jiang X F,et al.Apoptosis in suspension culture of tobacco cells induced by heat shock[J].Chinese Science Bulletin,1999,12:1 101-1 106.
[10]Liang J,Wei G,Lv Q,et al.Cell suspension culture of neem tree[J].Chinese Forestry Science and Technology, 2003,2:16-21.
[11]Tang W,Wu J Y,Zhang L M.Influences of plant growth regulators,basal media and carbohydrate levels on cell suspension culture of panax ginseng [J].Journal of Northeast Agricuitural University,1995,1:62-65.
[12]江明,謝文申.大花茉莉的組織培養和植株再生[J].植物生理學通訊,1994,30(6):436-437.
[13]呂冬霞,曲長福.植物生長調節劑對愈傷組織培養的影響[J].北方園藝,2004(5):68.
[14]張素勤,鄒志榮,耿廣東,等.培養基和植物激素對非洲菊葉片愈傷組織誘導的研究[J].西北農林科技大學學報:自然科學版,2004,32(10):29-32.
Jasminum sambacCallus Induction and Suspension Cell Culture
ZHUANG Zhehuang,CAI Hanquan,CHEN Dansheng
(Department of Biology,Hanshan Normal University,Chaozhou,Guangdong 521041)
Petals of Jasminum sambacwere induced and cultured callus on the media with different phytohormones concentration.The preliminary stable suspension culture system was established after choosing the loose callus from different types for cell suspension culture.The results indicated that different phytohormones could form three types of callus,CA, CB and CC which had diverse polarization direction.Both the CA and CB callus could be used as initial materials for establishing suspensions,and it took about 11 days to establish cell suspensions from the better callus,CB callus.
Jasminum sambac;Callus;Cell suspension culture
10.3865/j.issn.1001-3547.2011.08.007
韓山師范學院重點科研項目(2005-413545)
莊哲煌(1984-),男,助教,本科,從事植物組織培養的教學與研究工作,電話:0768-2317422,E-mail:zzh@hstc.edu.cn
2011-03-15

