動脈瘤性蛛網膜下腔出血血管內栓塞后D-dimer濃度變化與預后的關系
王運良 曾志磊 尹紅蕾 韓 冰 張 輝 劉亞軍 婁季宇
1)解放軍第一四八中心醫院神經內科 淄博 255300 2)鄭州大學第二附屬醫院神經內科 鄭州 450014
動脈瘤性蛛網膜下腔出血(SAH)是一種嚴重危害人類健康,發病率和病死率較高的疾病。動脈瘤破裂時,出血使血管外基質收縮引起凝血和纖溶系統活化,血漿凝血酶濃度增高并產生一系列的活化物,如凝血酶抗凝血酶復合物和凝血酶原片段1+2等,尤其是纖維蛋白降解產物D-dimer與臨床分級較差和預后不良有關[1]。SAH與動脈瘤填塞后血漿D-dimer濃度升高也可做為遲發性腦缺血和腦梗死的預測因素,但對D-dimer能否做為預后不良的獨立危險因素還不清楚[2]。我們的研究從2003-01~2008-12共6年時間,對發病48 h內在我院和鄭州大學第二附屬醫院神經內科住院的204例SAH并進行血管內栓塞治療的病人資料進行收集,選擇凝血和纖溶系統的參數-血漿D-dimer做為觀察指標,在手術當天早晨和動脈瘤填塞后10~14 d分別檢測血漿D-dimer濃度,3個月時根據格拉斯哥預后評分和CT隨訪發生腦梗塞做為預后不良的判斷指標,觀察D-dimer濃度增高是否為導致預后不良的危險增加、存活者發生永久性腦缺血損害的獨立危險因素。
1 資料和方法
1.1 病例選擇 這項研究共選擇204例動脈瘤性SAH病人,其中男105例,平均年齡(51.3±3.8)歲(22~74歲);女99例,平均年齡(50.6±4.3)歲(25~72歲)。出血后48 h內入住我科并進行動脈瘤栓塞,入院后對以前病史、生活習慣和健康狀況對患者本人或家庭成員進行調查。在204例病人中,65例病人(31.86%)有高血壓史,出血前血壓>140/90 mm Hg或使用抗高血壓藥物治療,15例病人(7.35%)血壓>160/95 mm H g,5例病人(2.45%)患有糖尿病,13例(6.37%)患有冠心病,40例病人(19.6%)在SAH前有使用非甾體類抗炎藥的病史。
1.2 方法 按照WFNS分級評分,對每一病人入院時臨床狀態和血液標本進行評估,在出血后48 h內填塞動脈瘤,入院后給予靜脈滴注尼莫地平并持續21 d,有缺血癥狀時給予常規的高壓、高容及抗血管痙攣的治療。手術前后每6 h給予地塞米松5mg,連續使用6 d。入院當天完成神經系統檢查,以逐漸發生的局部神經缺損或未知原因的意識障礙加重判定為遲發性腦缺血(格拉斯哥昏迷評分運動反應減少≥1分)。在入院當天、術后第1天、出院和3個月時進行常規CT掃描,如出現臨床癥狀惡化重復掃描。按照Fisher分級對SAH的出血量進行分類,26例病人(12.74%)為中到嚴重出血,81例(40%)顯示輕度腦室內出血(IVH)。按照格拉斯哥預后評分(GOS)和改良的Rankin量表對3個月時臨床結果進行評估。SAH后3個月時CT掃描隨訪發現174例病人(85.3%)顯示大腦半球片狀低密度區,16例病人隨訪脫失,12例病人在隨訪期間死亡。D-dimer濃度測定,清晨收集血液標本注入含有抗凝劑的聚丙烯試管內,按照與血液1∶9比例加入3.2%枸櫞酸鈉,嚴格按照說明書要求定量膠乳法測定D-dimer濃度(Roche Diagnostics GmbH),批內和批間變異系數<8.3%。
1.3 統計分析 應用WSPSS10.0統計程序軟件包對所有參數進行統計分析,數值以ˉx±SD表示。SAH的臨床結果和D-dimer濃度的分組變量由重復檢測ANOVA比較,不同組間的變異以Odds和95%C表示,應用邏輯回歸分析預后不良和CT掃描發現的缺血性損害,P<0.05差異有統計學意義。
2 結果
研究發現,SAH預后不良組與預后良好組相比,血漿D-dimer濃度明顯升高,手術當天D-dimer濃度分別為(1 368±298)μg/L和(1 129±166)μg/L,隨SAH時間延長D-dimer濃度明顯下降,但14 d時預后不良組仍明顯高于預后良好者,2組分別為(756±144)μg/L和(356±73)μg/L(P<0.001)。D-dimer濃度升高可能與患者年齡較大、服用抗高血壓藥物及抽煙有關,因抽煙病人較非抽煙者年輕(見表1)。入院時WFNS和IVH分級也與D-dimer濃度和臨床結果有一定關系,其中D-dimer濃度可能與早期再出血、入院時Fisher分級和血糖升高有關。D-dimer濃度升高也提示腦積水發生率增加,分級差的患者常需要腦室分流治療。早期D-dimer濃度與遲發性腦缺血無明顯的相關性,14 d時D-dimer濃度升高提示遲發性腦缺血發生率增加。盡管臨床癥狀的嚴重程度與D-dimer濃度無關,但腦缺血病人D-dimer濃度明顯高于非缺血者(見表2)。
多變量分析研究發現,Fisher分級、再出血和血糖升高與預后不良的關系下降,因這些變量與患者年齡和IVH或ICH的發生明顯相關。預后不良最明顯的危險因素是患者年齡、IVH或ICH、D-dimer濃度和WFNS分級>1級,同時性別、高血壓、出血或手術期間短暫或永久性近端動脈阻塞時間、SAH出血量也是預后不良的預測因素。CT隨訪發現,早期D-dimer濃度不是缺血性損害或癥狀性遲發性腦缺血的危險因素,3個月時CT發現缺血性損害的明顯危險因素是入院時WFNS分級>1級、早期CT發現厚層出血、蛛網膜下腔局部血塊和高血壓史(見表3)。
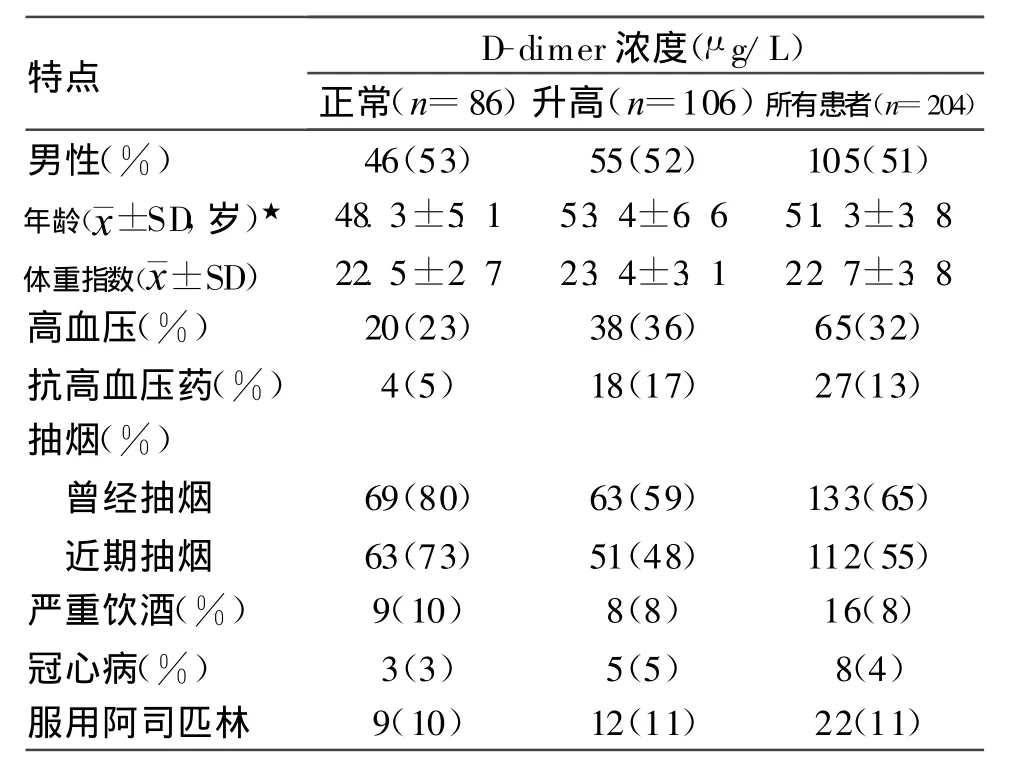
表1 SAH病人手術當天血漿D-dimer濃度特點
正常D-dimer值<500μg/L,體重指數以/kg/m2表示
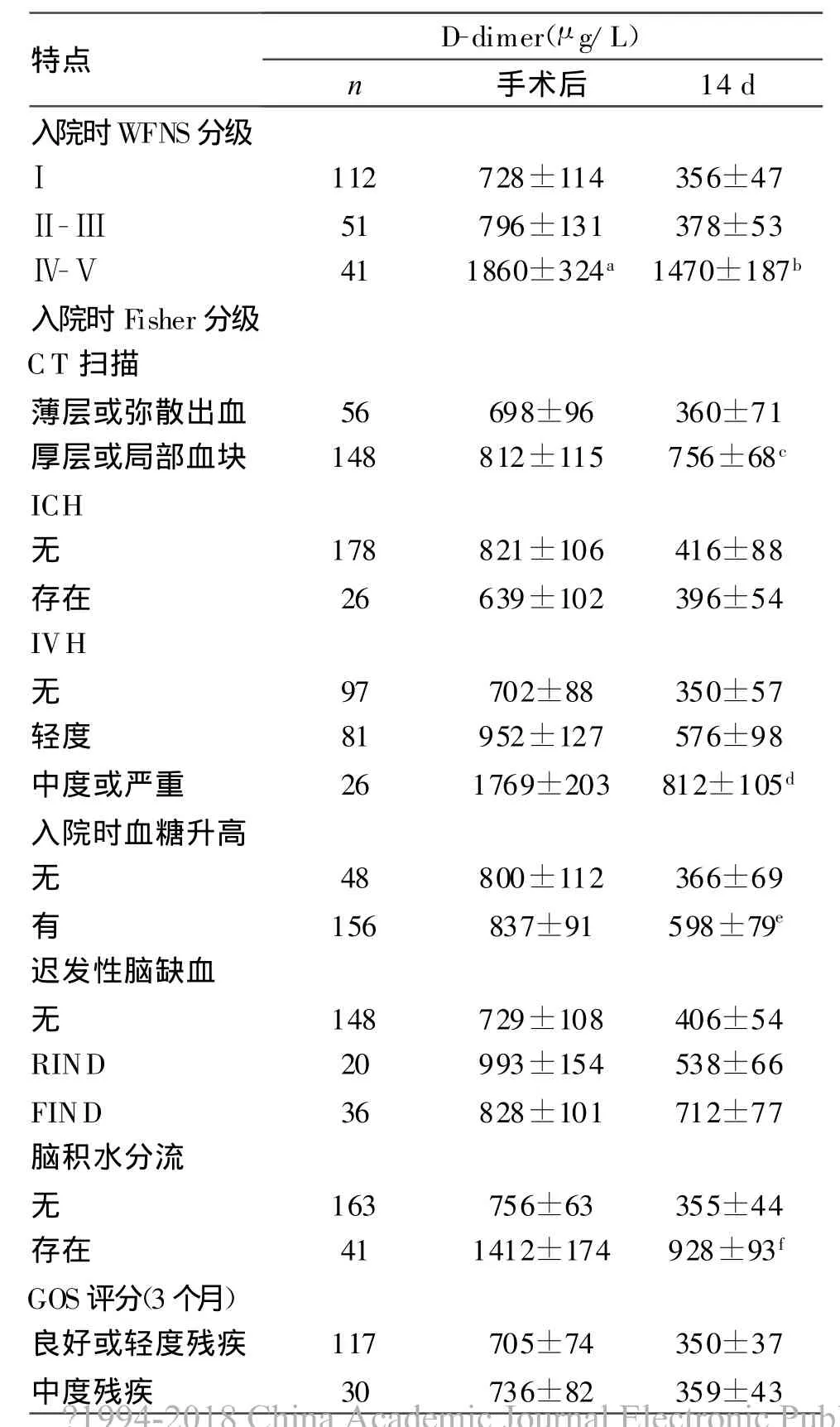
表2 SAH病人臨床、放射學變量與14 d血漿D-dimer濃度
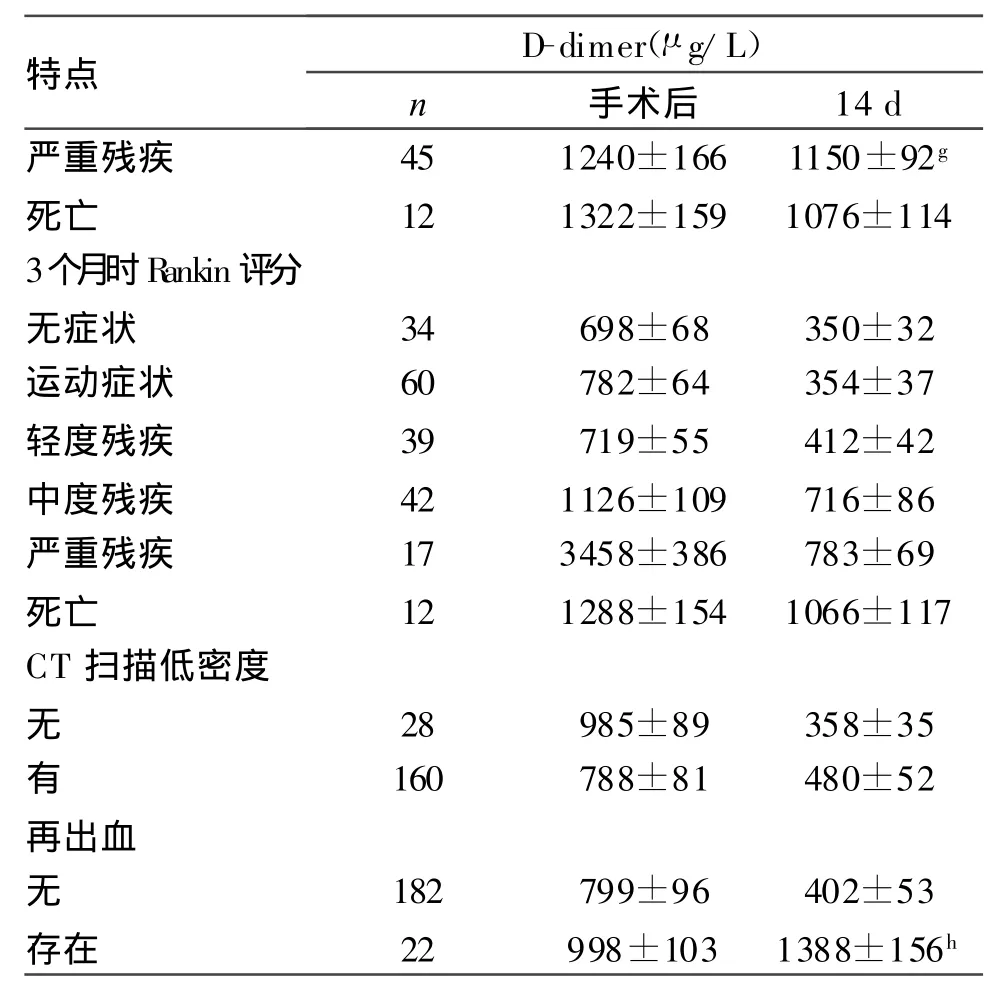
特點D-dimer(μg/L)n手術后14 d嚴重殘疾45 1240±166 1150±92g死亡12 1322±159 1076±114 3個月時Rankin評分無癥狀34 698±68 350±32運動癥狀60 782±64 354±37輕度殘疾39 719±55 412±42中度殘疾42 1126±109 716±86嚴重殘疾17 3458±386 783±69死亡12 1288±154 1066±117 CT掃描低密度無28 985±89 358±35有160 788±81 480±52再出血無182 799±96 402±53存在22 998±103 1388±156h
a.手術后分級與D-dimer濃度之間的比較,P<0.001;b.術后14 d W FNS分級D-dimer濃度比較,P<0.001;c.術后14 d Fisher分級D-dimer濃度比較,P<0.01;d.術后14 d腦室出血與無出血組D-dimer濃度比較,P<0.01;e.術后14 d血糖升高組與正常組D-dimer濃度比較,P<0.01;f.術后14 d腦室分流與無腦積水組D-dimer濃度比較,P<0.001;g.GOS評分嚴重殘疾與各組間D-dimer濃度比較,P<0.001;h.再出血組與無出血組D-dimer濃度比較,P<0.001

表3 SAH預后差的危險因素
3 討論
SAH是一種病死率和致殘率較高的疾病,發病率6/10萬~10/10萬,占急性腦卒中的10%,出血性卒中的20%[3]。動脈瘤性SAH占所有SAH的75%,血液流入蛛網膜下腔引起頭痛,顱內壓增高,視網膜出血,顱底或腦室內血液凝固CSF回流受阻引起腦積水,血液分解產物刺激引起丘腦下部功能紊亂如發熱、血糖升高和心律失常,血管活性物質如5-H T、TXA2和組織胺等刺激血管和腦膜引起血管痙攣,腦灌注壓下降導致昏迷,甚至引起腦疝和死亡[4]。我們研究的目的是選擇動脈瘤性SAH病人,了解SAH后D-dimer濃度變化與臨床預后的關系,探討D-dimer濃度增高能否做為預后不良的獨立危險因素。
研究發現,SAH出血病人如果手術后早期血漿D-dimer濃度升高,持續到SAH后14 d、或發生再出血提示預后不良。另一方面,D-dimer濃度不能獨立預測遲發性腦缺血或CT掃描永久性缺血性損害的發生。SAH的臨床預后主要由早期出血的嚴重性確定,由于出血后相關并發癥如遲發性缺血、再出血和腦積水等因素使預后不良的可能性增加[5]。動脈瘤破裂常引起應激性高血糖,由此引起再出血和代謝綜合癥,使預后不良的危險性增加。因此,SAH臨床預后可能與多種危險因素有關[6]。
SAH后,動脈壁的早期改變是內皮損傷引起血小板聚集,出血后顱內壓驟然升高引起急性血液-動脈壁屏障破壞,內皮釋放組織因子,產生大量的凝血酶和凝血活化,導致D-dimer的濃度升高[7]。D-dimer濃度升高可能反應腦血栓形成或全身高凝狀態,但也可能是一種嚴重SAH的偶然現象。在腦梗死患者中,入院時D-dimer濃度升高認為是進展性腦缺血的一種獨立危險因素[8]。我們的研究發現,D-dimer濃度升高可能是由于動脈瘤破裂后的應激反應、手術或代謝綜合征引起,與再出血的嚴重性、血糖、WFNS分級、fisher分級的IVH或ICH、FIND及患者年齡有關,而與體質數和高血壓史無明顯關系。
D-dimer是纖維蛋白溶解或血液高凝狀態的標志物,是出血嚴重性和臨床預后不良的危險因素,但這種危險因素受多種因素的影響,SAH后重復檢查發現血漿D-dimer濃度增高提示病人預后不良的危險因素增加。
[1] Ilveskero S,Juvela S,Siironen J,et al.D-dimer predicts outcome after aneurysm al subarachnoid hemorrhage:no effect of thromboprophylaxis on coagulation activity[J].Neurosurgery,2005,57:16-24.
[2] Hyoung SL,Young JK,Seung HY,et al.The In cidence of Aneurysm al Subarachnoid Hemorrhage in Youngdong District,Korea[J].J Korean Neurosurg Soc,2007,42(4):258-264.
[3] Simard JM,Geng ZH,Woo SK,et al.Gliben clamidereduces inflammation,vasogenic edema,and caspase-3 activation after subarachnoid hemorrhage[J].Cereb Blood Flow Metab,2009,29(2):317-330.
[4] Landis A,Coghlan B,Hindm an J,et al.Independent associations between electrocardiographic abnormalities and outcomes in patients with aneurysmal subarachnoid hemorrhage:findings from the Intraoperative Hypothermia Aneurysm Surgery Trial[J].Stroke,2009,40(2):412-418.
[5] Juvela S,Siironen J,Varis J,et al.Risk factors forischem ic lesions following aneury smal subarachnoid hemorrhage[J].J Neu rosurg,2005,102:194-201.
[6] Juvela S,Siironen J,Kuhmonen J,et al.Hyperglycemia,excess weight,and history of hypertension as risk factors for poor outcome and cerebral infarction after aneurysmal subarachnoid hemorrhage[J].J Neurosurg,2005,102:998-1 003.
[7] Jan WD,Mienke R,Irene C,et al.Relationship between vasospasm,cerebral perfusion,and delayed cerebral is chemia after aneurysm al subarachnoid hemorrhage[J].Neuroradiology,2009,51(12):813-819.
[8] Seppo J,Jari S.D-dimer as an independent predictor for poor outcome after aneurysmal subarachnoid hemorrhage[J].Stroke,2006,37:1 451-1 456.

