對比 思辨 提升
田長明
(蘇州市吳中區教育局教研室江蘇蘇州215128)
對比 思辨 提升
田長明
(蘇州市吳中區教育局教研室江蘇蘇州215128)
學習化學知識的過程中常常用到比較法,通過比較,弄清現象與本質、共性與個性之間的關系,引導學生通過比較、思辨,找到解決問題的不同方法,提高學生分析問題與解決問題的能力。
對比;現象;本質;共性;個性
比較是確定客觀事物彼此之間差異點與共同點的思維方法。有比較才有鑒別,通過比較可以認定事物的本質,弄清事物的相互關系。所謂比較就是異中求同或同中求異的思維或實踐過程。在學習化學知識的過程中也常常用到比較法。中學化學基礎內容中有許多知識既有相同點,又有相異點,如果教師在教學中把這些既有聯系又有區別的基礎理論、基本概念、物質性質、實驗、計算等進行分析歸納、縱橫比較,引導學生找出各自特征和彼此間的聯系,那么就能幫助學生加深理解,以獲得牢固的基礎知識。這里,筆者就談談在學習化學時常用的比較方法。
一、現象同、本質異
事物的本質是蘊含在事物的現象之中的,往往很難一眼看出,同時,其本質也有層次深淺或主次的區別,不易一下抓準。我們要用理性的睿智之光,對觀察到的表象下一番“振葉以尋根,觀瀾而溯源”的功夫。注意運用比較的方法,對事物的現象進行概括,去偽存真,去粗存精,由此及彼,由表及里,進而上升、飛躍,形成對事物理性化的認識。我們絕不要被表面現象所迷惑,我們應該透過現象看本質。我們通過化學反應過程中的“褪色”這一現象來說明:
現象1:SO2和氯氣通入品紅溶液,品紅溶液褪色。
分析:有機色素的褪色機理主要有2種。一種是色素結構被氧化破壞,具有不可逆性,如氯水、Na2O2、H2O2、O3等使酚酞、品紅等溶液褪色;另一種是色素與某物質結合生成無色物質,色素主體結構未受破壞,是暫時的、可恢復的,如SO2使品紅溶液褪色。
現象2:SO2通入溴水溶液,溴水溶液褪色。
分析:SO2氣體通入某溶液中,溶液發生褪色,其原因也并非只表現出SO2的漂白性。因為SO2的漂白是指SO2和色素發生化合反應,使其褪色。SO2還具有還原性,能使溴水、酸性高錳酸鉀等具有強氧化性的有色溶液褪色。
現象3:SO2通入石蕊試液,石蕊試液沒有褪色,而是變紅。
分析:中學實驗室中的品紅是一種偶氮化合物(偶氮染料),偶氮化合物顏色變化的一般規律是有機物分子中共軛體系增長而顏色加深。品紅是由一種叫做堿性品紅的發色母體(無色)加入鹽酸后生成的,在品紅溶液中存在著如下的平衡:
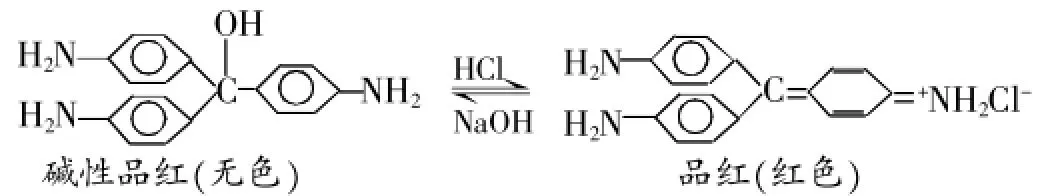
品紅溶液中通入SO2后,發生如下反應:
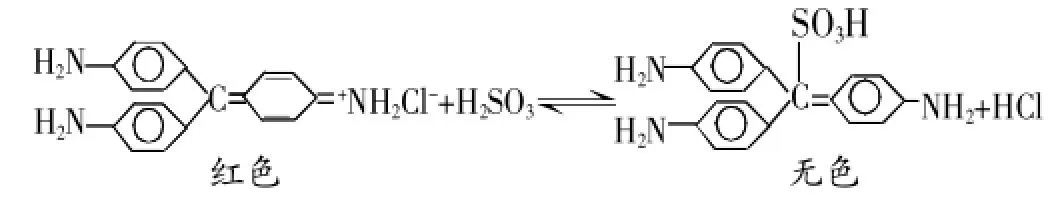
亞硫酸與品紅發生了加成反應,破壞了品紅結構中單雙鍵交替的結構,所以品紅褪色。加熱褪色后的溶液,溶液又恢復到原來的顏色,顏色恢復是因為加熱亞硫酸不穩定分解,平衡逆向移動,溶液恢復呈紅色。[1]
石蕊(Litmus)是一種弱的有機酸,相對分子質量為3300,在酸堿溶液的不同作用下,發生共軛結構的改變而變色,如果用HIn代表石蕊分子,HIn在水中發生電離:HIn?H++In-。在酸性溶液中,由于c(H+)增大,根據平衡移動原理可知,平衡將向逆反應方向移動,使c(HIn)增大,因此主要呈現紅色(酸色)。如果在堿性溶液中,由于c(OH-)增大,OH-與HIn電離生成的H+結合生成更難電離的水,使石蕊的電離平衡向正反應方向移動,于是c(In-)增大,因此主要呈現藍色(堿色);在中性溶液里,紅色的分子和藍色的酸根離子共存,因而溶液呈紫色。通入SO2后,不能與石蕊發生加成反應,溶液因呈酸性而顯紅色。
二、本質同、現象異
在生活中有許多這樣的例子:比如說滴水穿石和繩鋸木斷在表面形式上是不同,但表示了同樣的思想,就是只要堅持不懈就會成功;披肝瀝膽和開誠布公的形式不同但也是一個意思,為人處事非常忠誠。化學中也有類似的例子,如氫氣在氯氣中能安靜的燃燒,而氫氣和氯氣混合在光照的條件下就會發生爆炸,本質都是氫氣和氯氣反應生成氯化氫等,現以鋁與酸反應的現象為例:
現象4:pH值相等的稀鹽酸和稀硫酸與少量鋁粉反應,我們會發現鋁粉與稀鹽酸反應的速率比與稀硫酸反應的速率快。
分析:這兩個反應的本質相同,都是2Al+6H+=2Fe3++ 3H2↑,現象為什么會產生差異?決定鋁和酸反應的速率因素有4點:⑴是否生成配離子;⑵酸的濃度;⑶酸根離子的半徑大小;⑷反應生成的鋁鹽是否可溶于水。現在c(H+)的濃度相同,生成的鹽都能溶于水,其主要原因是c(Cl-)半徑小,能穿透氧化鋁薄膜取代氧化鋁中的氧原子,從而使之溶解;另一方面Al3+能與Cl-絡合生成[AlCl4]-,而硫酸沒有配位效應,也沒有穿透效應,因此造成了兩者反應速率的差異。
三、共性存、個性異
唯物辯證法認為共性和個性是一切事物固有的本性,每一事物既有共性又有個性。共性決定事物的基本性質,個性揭示事物之間的差異性,個性體現并豐富著共性,共性是絕對的,個性是相對的、有條件的。我們研究化學問題也應該遵循這樣的規律。
問題1:乙酸與乙醇發生酯化反應時為什么不加碎瓷片防暴沸?
分析:液體中的氣泡在沸騰過程中起著汽化核的作用,當液體中缺少氣泡時,即使溫度達到并超過了沸點,也不會沸騰,形成了過熱液體。過熱液體是不穩定的,如果過熱液體的外部環境溫度突然急劇下降或侵入氣泡,則會形成劇烈的沸騰,并伴有爆裂聲,這種現象叫暴沸。如果加一點雜質后(本質是帶入了微小氣泡),沸騰滯后被打破,產生沸騰。在液體中加入碎瓷片的原理與加入雜質相同,主要是通過孔隙凝聚水蒸氣,使成為氣泡浮出,防止暴沸。所以很多有機反應以及蒸餾,都要加入碎瓷片以防暴沸。
乙酸與乙醇發生酯化反應時為什么不加碎瓷片防暴沸?實驗表明,若在反應后在各試管中加入相應的試劑,實驗開始在混合物中加入了碎瓷片,產生乙烯氣體的速率顯著加快,嚴重地影響了乙酸乙酯的生成,導致生產出酯的量明顯減少,實驗效果欠佳。通過查找有關資料得知:在乙醇、乙酸、濃硫酸的混合物中,硫酸既可與乙醇作用產生碳正離子,也可與乙酸作用使羧基上的碳原子帶有更高的正電性,在這些“中間體”物質中,若有碎瓷片(Al2O3)存在,碎瓷片表面上的鋁離子可促進由醇生成的鹽迅速轉化為乙烯,從而抑制了由乙酸與乙醇作用生成乙酸乙酯的過程。所以在做乙酸乙酯的制取實驗中不能加入碎瓷片來防止爆沸,只能通過控制酒精燈的火焰大小來防溶液暴沸。[2]
四、問題同、方法異
有這樣的一個故事,亞歷山大曾經遇到了一個問題,有一個著名的死結,傳說如果有人能夠解開它,這個人就會成為王。亞歷山大也想解開。但是他花了很長時間研究,用了很多辦法之后,覺得真的難以解開,頭緒太多,完全不知道從何下手。在這之前,很多人都被這個問題難住了,最后都不知道如何解開。最后,亞歷山大拔出寶劍,說,既然我不能夠用你的方法解開,那么我就用我自己的方法。說完之后,他揮劍斬斷了這個死結,問題也迎刃而解。在許多情況下,我們將解決問題類似于亞歷山大,并不是問題不能解決,或者問題太難,而是我們需要不同的方法。
問題2:用下圖裝置分別制取和收集兩種干燥的氣體。燒杯里NaOH溶液用來吸收尾氣,防止污染空氣。根據裝置圖填寫下面的表格(填有關的化學式或化學方程式)。
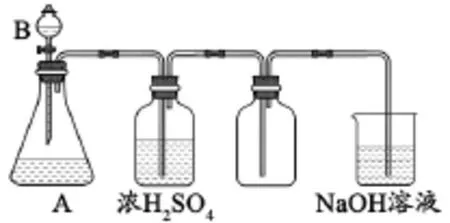
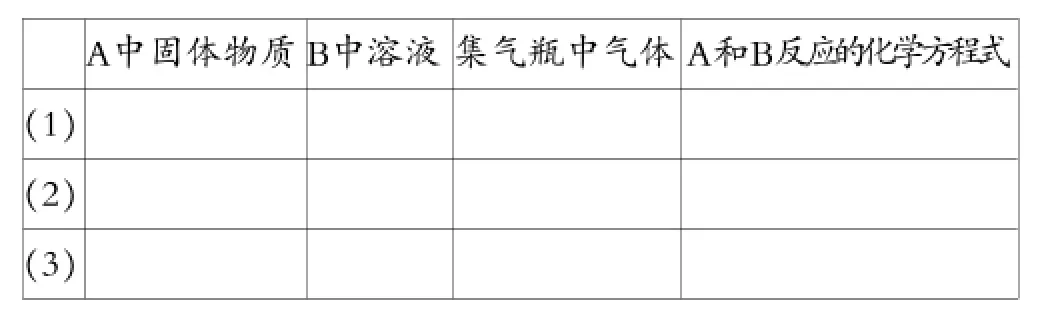
分析:⑴氣體發生裝置特點:①固體和液體反應;②反應不需要加熱。可制備的常見氣體有H2、O2、CO2、SO2、Cl2、H2S、NH3、C2H2、NO2等。⑵除雜裝置中不能用濃硫酸干燥的常見氣體有:H2S、NH3、HBr、HI、PH3等。⑶收集裝置可用向上排空氣法收集的氣體有:O2、CO2、SO2、Cl2、H2S、NO2等。⑷尾氣處理可用NaOH溶液吸收的氣體的有:SO2、Cl2、H2S、NO2等。因此上述表格可填寫如下:
1008-0546(2011)01-0008-02
G632.41
B
10.3969/j.issn.1008-0546.2011.01.004

