褶紋冠蚌臟神經節Glu、GABA、DA、Ach和5-HT能神經元的分布
肖 昱,唐 勤,孫妍妍,劉 玥,李葆明,,雷光春,吳小平,
(1.南昌大學 生命科學研究院,江西 南昌,330031; 2.復旦大學 神經生物學研究所,上海200032; 3.北京林業大學 自然保護區學院,北京 100083)
谷氨酸、γ-氨基丁酸、多巴胺、乙酰膽堿和 5-羥色胺作為哺乳動物中樞神經系統中的重要神經遞質,在學習、記憶和認知等行為過程中起重要作用。軟體動物盡管沒有發達的中樞神經系統,但許多研究表明,它們的神經系統中存在大量Glu、GABA、DA、Ach和 5-HT能神經元,并具有重要功能[1-4]。文獻報道,Glu在槍烏賊的神經細胞間信號傳遞中起著重要作用[5]; GABA 在軟體動物神經系統起興奮和抑制雙重作用[3,6]; Ach是軟體動物運動神經元重要的神經遞質,對雙殼類動物纖毛運動同時具有興奮和抑制作用[7]; 5-HT廣泛分布于軟體動物,如無齒蚌(Anodonta piscinalis)、褐云瑪瑙螺(Achatina fulica)、紫貽貝(Mytilus edulis)、地中海貽貝(Mytilus galloprovicialis)神經系統和其他組織[8-10],可能與感覺信息傳遞有密切關系[11]。
褶紋冠蚌(Cristaria plicata(Leach))隸屬瓣鰓綱(Lamellibranchia)、真瓣鰓目(Eulamellibranchiata)、蚌科(Unionidae),是中國重要的淡水經濟蚌種之一。關于淡水蚌類神經系統的神經元類型及分布,迄今知之甚少。本實驗目的是闡明淡水蚌神經系統Glu、GABA、DA、Ach和5-HT能神經元的分布及形態學特征,尤其是闡明它們是否存在于同一神經元內,以期為淡水貝類的行為學和保護等方面研究等方面提供基礎。
1 材料與方法
1.1 藥品
小鼠抗谷氨酸單克隆抗體(ab78944,Abcam公司)、小鼠抗谷氨酸脫羧酶(GAD67)單克隆抗體(ab26116,Abcam公司)、小鼠抗酪氨酸羥化酶單克隆抗體(T1299,Sigma公司)、小鼠抗膽堿乙酰轉移酶單克隆抗體(ab78023,Abcam公司)、小鼠抗色氨酸羥化酶單克隆抗體(T0678,Sigma公司)、生物素化羊抗小鼠 IgG (Jackson公司)、辣根過氧化物酶標記鏈霉卵白素(Jackson公司)、DAB試 劑盒(中山金橋公司)。
1.2 實驗材料
褶紋冠蚌購買于上海市徐匯區萬有全集團新鮮市菜場,選取健壯無損傷的鮮活個體。
1.3 H.E.染色
分離臟神經節,迅速放入現配預冷的4%多聚甲醛(0.1 mol/L PB)固定液中,4℃固定6~8 h。取出神經節,依次放入10%、20%、30%的 PB-蔗糖溶液中梯度脫水(4℃),直至標本沉至容器底部。O.C.T包埋,于冰凍滑動切片機(Leica,Germany; -25℃)冠狀連續切片,片厚為10 μm。將切片貼于涂有鉻礬明膠的載玻片上。風干后,用蘇木素-伊紅(H.E.)染色法染色,梯度酒精脫水,二甲苯透明,中性樹膠封片,OLYMPUS BX41系統顯微鏡下觀察并拍照記錄結果。
1.4 免疫組織化學
采用 SP免疫組織化學法:-25℃冠狀連續切片,片厚為40 μm。將切片放入0.01 mol/L PBS(磷酸緩沖液)中充分漂洗后,置入 0.3% H2O2室溫處理 4~5 min(抑制內源性過氧化物酶),PBS漂洗 3×10 min;加入 0.5%Triton X-100(PBST(PBS,0.5% Triton X-100)),室溫搖床反應 30 min; 棄去 Triton,加入10%正常羊血清室溫孵育30 min(抑制非特異性吸附);棄去血清,滴加 1∶500稀釋的一抗,4℃孵育 72 h,PBS漂洗3×10 min; 滴加1∶500稀釋的二抗(生物素化羊抗小鼠IgG),室溫孵育2 h,PBS漂洗3×10 min;滴加1∶500稀釋的辣根過氧化物酶標記的鏈霉卵白素,室溫反應 1 h,PBS漂洗 3×10 min; 滴加DAB-H2O2成色反應,室溫約 2~3 min至變色適度,放入 0.1 mol/L Tris-HCl終止成色反應; 0.1 mol/L PBS中將切片貼于涂有鉻礬明膠的載玻片上,風干;蘇木素復染2 min,自來水藍化10 min,蒸餾水漂洗10 s,梯度酒精脫水,二甲苯透明,中性樹膠封片,鏡檢并拍照記錄結果。實驗中,以10%正常羊血清與0.2% Triton X-100等比例混合成的抗體稀釋液代替一抗作為空白對照,結果為陰性。
2 實驗結果
2.1 形態學觀察
臟神經節是褶紋冠蚌中樞神經系統最大的神經節,2個對稱的臟神經節愈合成1對蝴蝶狀結構,緊貼于后閉殼肌前緣腹側表面,表面呈淡黃色。其背側面平滑,腹側面膨脹突起且表面光滑。前側逐漸變細成為腦臟神經連索,與腦神經節相連; 后端也逐漸變細成為 1對粗大的外套神經,延伸到身體后端外套膜; 前腹側方兩側 1對弓狀突起,彎向背側延伸至鰓腔中成為鰓神經。
應用 H.E染色法,作者標記出臟神經節由神經節被膜、胞體區和中央纖維網區 3部分組成。胞體區神經元分層不明顯,神經細胞屬單極型,多呈梨形或卵圓形,少數為不規則形。根據胞體直徑大小明顯分為小型(5~15 μm)、中型(15~35 μm)和大型(35~50 μm)細胞3種類型。細胞核多為圓形或橢圓形,多居于胞質中央,大小為 6~15 μm。不同大小的神經元胞體散亂分布在神經節表面,有時會大量聚集成簇分布。在中央神經纖維網區有少量神經胞體成簇分布,它們大部分為中、小型細胞。胞體發出的突起均進入中央神經纖維網,中央神經纖維網內的神經纖維呈散亂絮狀分布(圖1-1,圖1-2)。
2.2 自發熒光現象
應用 OLYMPUS BX-URA2熒光顯微鏡,在450~480 nm和510~550 nm兩種激發光濾光片帶處,觀察經多聚甲醛固定過的臟神經節冰凍切片。結果顯示:多數神經元胞體能自發紅色和綠色熒光,其中紅色熒光強于綠色熒光。這些自發熒光的胞體遍及神經節的整個胞體區,且呈不規則排列。中央神經纖維網靠近腦-臟神經連索區域和鰓神經區域亦存在大量具有自發熒光的纖維神經,呈念珠狀或少量靜脈曲張狀放射分布(圖2-1,圖2-2,圖2-3,圖2-4,)。在 100×油鏡下,可觀察到在神經元胞體內部和中央神經纖維網區有大量紅色和綠色熒光色素顆粒,這些顆粒圍繞細胞核周圍分布(圖2-5)。
2.3 免疫組化結果
為了鑒定和定位Glu、GABA、DA、Ach和5-HT神經元,作者選用抗 Glu、GAD67(GABA合成限速酶)、TH(DA合成限速酶)、ChAT(Ach合成限速酶)和 TPH(5-HT合成限速酶)抗體,進行免疫組織化學實驗。
2.3.1 Glu免疫陽性神經元
臟神經節的整個胞體區都存在 Glu能神經元。在胞體層較厚的區域,有大量小型細胞呈強 Glu免疫陽性反應,少量中型細胞呈弱 Glu免疫陽性反應,且兩種細胞呈不規則散亂分布。在胞體層較薄的區域,可見少量大型Glu免疫陽性細胞。中央纖維網有零星的陽性反應神經末梢存在(圖3-1,圖3-2)。
2.3.2 GAD67免疫陽性神經元
臟神經節的外側胞體區可見大量呈陽性反應的小型細胞,少數中型細胞呈弱陽性。這些陽性細胞多為單級神經元,其軸突進入神經節中央纖維網。中央纖維網區中可見豐富的GAD67強陽性反應的神經纖維,呈不規則絮狀排列,并有少量陽性神經纖維呈靜脈曲張狀突起(圖3-3,3-4)。

圖1 褶紋冠蚌臟神經節的組織切片(H.E染色)Fig.1 The hematoxylin and eosin staining of the visceral ganglion
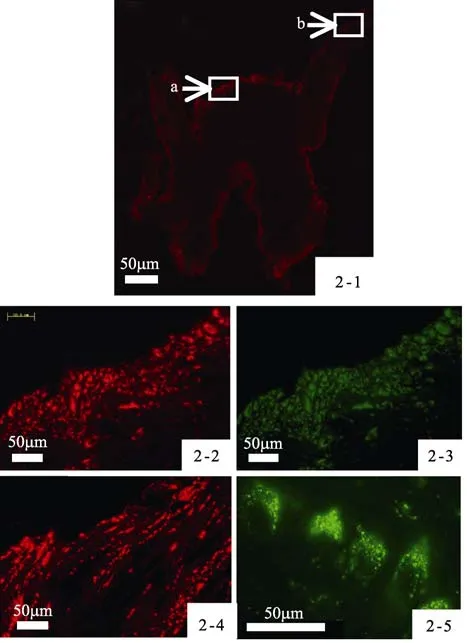
圖2 褶紋冠蚌臟神經節自發熒光現象Fig.2 The occurrence of autofluorescence in the visceral anglion
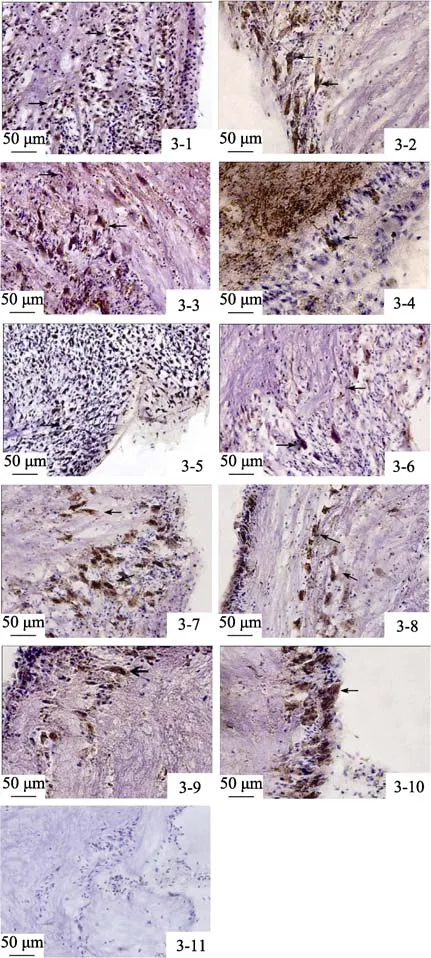
圖3 褶紋冠蚌臟神經節Glu、GABA、DA、ChAT、5-HT神經元的SP法免疫組化定位Fig.3 SP immunohistochemical locanization of Glu,GABA,DA,Ach and 5-HT neurons in the visceral ganglia of Cristaria plicata
2.3.3 TH免疫陽性神經元
臟神經節的整個胞體區及神經節周圍的結締組織鞘均見TH免疫陽性細胞。在大量細胞成簇出現的區域,TH免疫陽性反應神經元大部分為小型胞體;偶見呈TH免疫陽性反應的大型神經元; 中央纖維網區可見零星的陽性反應神經末稍(圖3-5,3-6)。
2.3.4 ChAT免疫陽性神經元
臟神經節背內側靠近外套神經的胞體區有大量的中型細胞呈強 ChAT陽性反應; 在中央神經纖維網中成簇放射狀夾雜排列的神經元中,也有少數中型細胞呈強 ChAT陽性反應,并夾雜有少量大型細胞亦呈弱 ChAT陽性反應。鰓神經根部有少量中型細胞聚集分布; 中央纖維網區可見較豐富的 ChAT陽性反應神經末梢(圖3-7,3-8)。
2.3.5 TPH免疫陽性神經元
臟神經節胞體區大量神經元呈TPH免疫陽性細胞,靠近外套神經和鰓神經區域尤為明顯。大部分免疫陽性細胞為大、中型神經元,偶見小型的免疫陽性神經元; 中央纖維網區只分布有顏色較淺的細小陽性反應纖維或末梢(圖3-9,3-10)。
3 討論
從解剖學看,瓣鰓綱褶紋冠蚌的臟神經節與腹足綱和頭足綱種類有較大不同:腹足綱的臟神經節位于食管末端處,形小、無愈合,彼此有神經相連[12-13]; 頭足綱的臟神經節在腦的腹面與平衡器相鄰,從背面觀其狀似四角形[14]; 而淡水褶紋冠蚌臟神經節位于后閉殼肌腹側,愈合,呈典型的蝴蝶狀,海洋瓣鰓綱種類(例如,疣簾蛤)的臟神經節為“X”型[15]。對臟神經節進行組織學比較后發現,瓣鰓綱不同種類之間存在差異:櫛孔扇貝(Chlamys farreri)胞體區含小型(5~15 μm)、大型細胞(15~36 μm)[16]; 淡水褶紋冠蚌神經節胞體區含有小型(5~15 μm)、中型(15~35 μm)和大型(35~50 μm)3 類細胞。這些差異可能與不同種類軟體動物生活的環境、行使的功能和所包含的神經遞質含量等差異有關[8]。
在褶紋冠蚌臟神經節,3種類型神經元均有自發的紅色和綠色熒光,且紅色熒光占主導。文獻報道,無齒蚌臟神經節中的自發綠色熒光較黃色熒光占主導[17]; 貽貝的腦、臟神經節自發橙黃熒光較綠色熒光占主導[18]。由于黃色熒光蛋白的激發光帶為490~510 nm,而本實驗使用的兩種激發光均不在此發光帶內,故無法觀察到自發黃色熒光。本實驗為進一步研究褶紋冠蚌神經元是否有其他波長的自發熒光奠定了基礎。
自發熒光是海洋無脊椎動物普遍存在的現象。例如,一些腔腸動物(水母、水螅和珊瑚)在受到機械刺激時會發射綠色熒光,櫛水母類則發射藍色熒光[19]。文獻報道,生物胺類物質如多巴胺、5-羥色胺等經甲醛處理后可顯示不同的熒光。由于褶紋冠蚌臟神經節胞體存在自發紅、綠熒光現象,本實驗無法運用免疫熒光技術進行雙標實驗,以分析不同神經遞質的共存現象,這一問題亟待在今后的研究中解決。
為了研究褶紋冠蚌臟神經節內不同遞質神經元的分布模式,作者采用了冰凍切片技術及SP免疫組化方法。實驗結果表明,這一方法可以清晰地觀察到Glu、GABA、DA、Ach和5-HT能神經元的分布規律及主要特征,不同種類神經元的形態學和分布有所不同。許多研究表明,Glu在軟體動物的主要功能是參與各種運動機能的調節,如攝食[20]、游泳[21]。GABA參與調節軟體動物的各種運動功能。例如,靜水椎實螺(Lymnaea stagnalis)的中樞神經系統和支配某些肌肉的神經中均有GABA神經元。在一些軟體動物貽貝(Mytilus galloprovincialis)、蛤蜊(Venerupis pullastra)和牡蠣(Ostera edulis)),GABA能誘導幼蟲的附著和變態[22]。
文獻報道,DA 在軟體動物攝食方面起著重要的作用。在軟體動物腹足綱中,DA參與調節食物的攝取量。在海兔中,DA在學習和記憶功能方面起重要的作用。Ach是軟體動物的運動神經遞質。例如,支配海兔攝食肌肉的運動神經元以Ach為遞質。5-HT則參與調控多種功能。在瓣鰓綱,5-HT控制鰓和纖毛運動[23],控制出、入水管的肌肉運動,并參與攝食和學習過程[9]。5-HT還參與性別功能的神經調控,與生殖發育有關[24-26]。
本實驗表明,Glu、GABA、DA、Ach和5-HT能神經元在褶紋冠蚌臟神經節中均有分布。其中GABA能神經元含量較少; GABA能神經纖維廣泛分布于中央纖維網,少數 GABA能神經纖維具有靜脈曲張狀的突起,推測 GABA神經元在整個神經節內參與大范圍、遠距離的神經活動調節。5-HT能神經元大量聚集在外套神經和鰓神經附近,推測5-HT作為一種重要的神經遞質在不同神經節之間起到交流作用,可能參與調控褶紋冠蚌的運動及生殖功能。關于這 5種神經遞質在褶紋冠蚌臟神經節的具體生理功能,有待今后的進一步研究。
致謝:本實驗的部分實驗在南昌大學生命科學學院完成,部分實驗在復旦大學神經生物學研究所完成。感謝徐開靜和單紅英兩位老師在實驗技術方面給予的協助。
[1]Nesic O B,Magoski N S,McKenney K K,et al.Glutamate as a putative neurotransmitter in the mollusk,Lymnaea stagnalis[J].Neuroscience,1996,79(4):1255-1269.
[2]Karhunen T,Airaksinen M S,Tuomisto L,et al.Neurotransmitters in the nervous system ofMacoma balthica(Bivalvia)[J].Comp Neurol,1993,334(3):477-488.
[3]張麗麗,于梅.五種經典神經遞質在軟體動物中的研究現狀[J].生命科學儀器,2008,6(12):32-36.
[4]Cottrell G A.Occurrence of dopamine and noradrenaline in the nervous tissue of some invertebrate species[J].Br J Pharmacol Chemother,1967,29:63-69.
[5]Evans P D,Reale V,Merzon R M,et al.N-methyl-D-aspartate (NMDA) and non-NMDA(metabotropic ) type glutamate receptors modulate the membrane potential of the Schwann cell of the squid giant nerve fibre [J].Exp Biol,1992,173:229-249.
[6]Kerkut G A,Cottrell G A.Acetylcholine and 5-hydroxytryptamine in the snail brain [J].Comp Biochem Physiol,1963,8:53-63.
[7]Yoshida M,Kobayashi M.Identified neurons involved in the control on the buccal muscle movement on the African giant snailAchatina fulica[J].J Exp Biol,1991,155:415- 433.
[8]Dahl E,Falck B,Mecklenburg C,et al.Neuronal localization of dopamine and 5-hydroxytryptamine in some mollusca [J].Z Zellforsch,1966,71:489-498.
[9]Lolagey R D,Garew T J.Serotonin immunoreactivity of the neurons the gastropodAplysia california[J].Neurobiol,l986,17:339-386.
[10]Biasi S D,Vitellaro Z L.Distribution of 5HT-immunoreactivity in the pedal ganglion ofMytilus galloprovincialis[J].Cell Tissue Res,1987,249:111-116.
[11]Morse D E,Hooker N,Duncan H,et al.γ-Aminobutyric acid,a neurotransmitter,induces planktonic abalone larvae to settle and begin metamorphosis[J].Science,1979a,204:407-410.
[12]李國華.脈紅螺(Rapana Venosa)神經系統解剖的初步研究[J].動物學報,1990,36 (4):345-351.
[13]金志良.釘螺神經系統的顯微解剖[J].動物學報,1993,39(3):229-238.
[14]張彥衡.烏鲗的解剖[J].山東大學學報,1958,1:119-161.
[15]Siniscalchi A,Cavallini S,Sonetti D,et al.Serotonergic neurotransmission in the bivalveVenus verrucosa(Veneridae):a neurochemical and immunohistochemical study of the visceral ganglion and Gonads [J].Marine Biology,2004,144:1205-1212.
[16]孫虎山,王宜艷.櫛孔扇貝神經節結構的顯微觀察[J].中國水產科學,2007,14(3):390-396.
[17]Sweeney D.The anatomical distribution of monoamines in a fresh water bivalve mollusc,Sphaerium sulcatum(L.)[J].Comp Biochem Physiol,1968,25:601-614.
[18]George B S,Edward A.Histofluorescent localization of serotonin and dopamine in the nervous system and gill ofMytilus edulis(Bivalvia) [J].Biological Bulletin,1975,148:141-156.
[19]鐘衛鴻,陳建孟,陳偉,等.珊瑚和海葵來源紅熒光蛋白的研究和應用[J].中國生物工程雜志,2005,25(5):10-14.
[20]Fox L E,Lloyd P E.Glutamate is a fast excitatory transmitter at some buccal neuromuscular synapses inAplysia[J].Neurophysiol,1999,82(3):1477-1488.
[21]崔素敏,王曉安.中國蛤蜊神經系統GABA和Glu的HPLC測定和免疫組化定位研究[J].四川動物,2008,27(5):764-767.
[22]Garcia M L,Sliva A.Effects of GABA and epinephrine on the settlement and metamorphosis of the larvae of four species of bivalve mollusks[J].Experimental Marine Biology and Ecology,2005,316:149-156.
[23]Stephens R E,Prior G.Dynein from serotonin-activated cilia and fl agella:extraction characteristics and distinct sites for cAMP-dependent protein phosphorylation [J].Cell Sci,1992,103:999-1012.
[24]Mart?nez G,Rivera A.Role of monoamines in the re-productive process ofArgopecten purpuratus[J].Invertebr Reprod,1994,25:167-174.
[25]Mart?nez G,Saleh F,Mettifogo L,et al.Monoamines and the release of gametes by the scallopArgopectenpurpuratus[J].J Exp Zool,1996,274:365-372.
[26]Gibbons M C,Castagna M.Serotonin as an inducer of spawning in six bivalve species[J].Aquaculture,1984,40:189-191.

