環境因子對櫛孔扇貝血淋巴中谷胱甘肽轉硫酶活性的影響
王宜艷,孫虎山,周彥菊,閆冬春,王 磊
(魯東大學 生命科學學院,山東 煙臺 264025)
谷胱甘肽轉硫酶(Glutathione S-transferases,GST,EC2.5.1.18),也稱為不含硒谷胱甘肽過氧化物酶(nonSeGPx),是一組多功能同功酶,其主要功能是催化谷胱甘肽(GSH)與各種內源性和外源性有害的親電子化合物反應,生成無毒性或毒性小的GSH硫結合物; 同時能催化有機過氧化物還原成相應的醇,與硒谷胱甘肽過氧化物酶(SeGPx)協同作用起抗氧化作用[1]。軟體動物的雙殼類、腹足類和頭足類的鰓、足、外套膜和消化腺等組織中都廣泛存在著 GSH及其相關酶(SeGPx、GST和谷胱甘肽還原酶等),并在其抗氧化和解毒中起重要作用[2-5]。近10年來,國外有關貝類體內 GST的研究報道較多,多集中在重金屬、殺蟲劑和石油污染物等對GST等抗氧化因子和生物異源物質代謝系統的影響[2,6-13],對 GST等抗氧化因子的季節變化也有研究報道[14-16],研究的主要熱點是探討 GST等抗氧化因子在應激狀態下的作用及作為環境污染的生物標志物的可行性; 國內有關貝類 GSH及其相關酶的研究報道極少[17-18]。對貝類體內GST性質的研究國內外均未見研究報道。作者以人工養殖的櫛孔扇貝(C.farreri)為材料,采用生化測定的方法對其血淋巴中GST活性及部分性質進行了初步研究,以期為貝類防御機理的研究積累資料,也為貝類體內GST的功能研究提供理論依據。
1 材料與方法
1.1 材料和試劑
櫛孔扇貝購自煙臺水產市場,殼長 40~50 mm,暫養于室內充氣的砂濾海水水族箱內。還原型谷肽胱甘肽、1-氯-2,4-二硝基苯(CDNB)等試劑均為國產分析純產品。
1.2 血清和血細胞的制備
用5mL注射器和5號針頭從櫛孔扇貝閉殼肌血竇中抽取血淋巴,每次實驗取 5只扇貝的血淋巴混合作為樣品,4℃、3500 r/min離心10 min,取上清即血清用于血清中GST活力的測定。下層沉淀即血細胞中加入與血清等量的雙蒸水低滲溶血后,4℃、6000 r/min離心10 min,取上清液即血細胞裂解液用于血細胞中GST活力的測定。樣品制備后立即用于酶活測定,未用完的血樣品置于4℃冰箱中保存不超過 12 h。
1.3 GST活性力測定
GST活力測定采用CDNB比色法[8],略有改進。對照管中依次加入0.1 mol/L、pH 6.5的磷酸緩沖液(PBS)0.1 mL、10 mmol/L的 GSH 0.1 mL及 1.25 mmol/L的CDNB 0.8 mL,測定管中以等量血樣品取代PBS,25℃恒溫下準確反應5 min; 然后在對照管中依次加入10%的鹽酸0.1 mL、血樣品0.1 mL、蒸餾水1.8 mL,測定管中用等量PBS取代血樣品; 1 cm石英比色皿、340 nm下以對照管作空白,讀取測定管的吸光度。測定管設5個平行組。采用Lowry等[10]的福林-酚試劑法測定樣品中的蛋白質含量。酶活力單位的定義:每毫克蛋白每分鐘催化生成1 μmol產物所需要的酶量為1個酶活力單位(U)。數據處理采用T檢驗。
1.4 GST性質的研究
1.4.1 溫度及pH對血細胞中GST活力的影響
以0.1 mol/L、pH 6.5的PSB為緩沖液,分別在5、10、15、20、25、30、35、40、60℃的反應條件下測定酶活力,以測定溫度對血細胞中 GST活力的影響。
以25℃為測定溫度,分別以pH 5、5.5、6、7、7.5和8的0.1 mol/L的PBS為緩沖液,測定pH對血細胞中GST活力的影響。
1.4.2 血細胞中GST的熱穩定性
將血細胞裂解液分別在 20、25、30、35℃恒溫中放置30 min后; 在4℃中分別保存12、24 h后,以0.1 mol/L、pH 6.5的PBS為緩沖液,25℃測該酶的反應速率,以測定該酶的熱穩定性。
1.4.3 金屬離子銅、鉛對血細胞中GST活力的影響
分別以硫酸銅和硝酸鉛為抑制劑,以0.1 mol/L、pH 6.5的檸檬酸-檸檬酸鈉為緩沖液,分別配制銅、鉛離子終質量濃度為:0、0.05、0.25、0.5、2.5、5 mg/L的反應液,在25℃測得該酶的反應速率。
2 結果
2.1 血清和血細胞中GST活力
櫛孔扇血清和血細胞中GST活力的測定結果見表1。由表1可見,櫛孔扇貝血清和血細胞中均存在GST,血細胞中 GST活力遠高于血清中的,是血清中的12倍。

表1 櫛孔扇貝血清和血細胞中GST活力Tab 1 Activity of Glutathione S-transferases in the haemolymph of C.farreri
2.2 溫度對血細胞中GST活力的影響
溫度對血細胞中GST活力影響的測定結果見圖1。結果表明:隨溫度的升高酶活力出現先升后降的趨勢,該酶的最適溫度范圍為20~35℃。GST在5℃的低溫下活力很低,僅為 48.14 U,10℃時活力有所升高,15℃時活力快速升高,為5℃時的3倍多; 30℃時酶活力達最高值,后隨溫度的繼續升高而下降,35℃時活力較 30℃下降了 20%,40℃時其活力只有30℃時的23%,60℃時該酶已完全喪失活力。
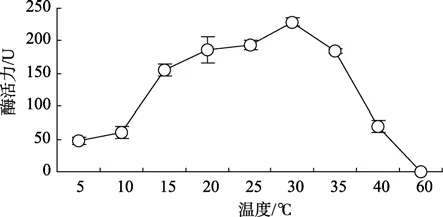
圖1 溫度對櫛孔扇貝血細胞中GST活力的影響Fig.1 Effects of temperature on GST activity in haemocytes of C.farreri
2.3 pH對血細胞中GST活力的影響
pH對血細胞中 GST活力影響的測定結果見圖2。結果表明:pH為5時GST活力較低僅為62.31 U,pH為5.5和6時,酶活力有所升高,但變化不明顯;pH為7.5時酶活力達最高值,為240.06 U。pH為7和8時酶活力分別達到最高值的61%和76%。該酶的適宜pH為7~8,最適pH為7.5。
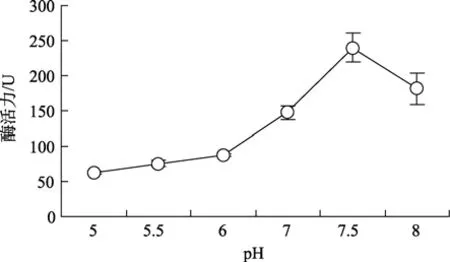
圖2 pH對櫛孔扇貝血細胞中GST活力的影響Fig.2 Effects of pH on GST activity in haemocytes of C.farreri
2.4 血細胞中GST的熱穩定性
4℃時血細胞中GST穩定性的測定結果見圖3。結果表明:4℃時 GST活力隨保存時間的延長而下降。4℃保存12 h后GST活力已下降了51%,4℃保存24 h后酶活力僅有原活力的32%。說明此酶在低溫中保存也易失活,低溫保存時間最好不要超過 12 h。
血細胞中GST熱穩定性的測定結果見圖 4。結果表明:血細胞裂解液在不同溫度下保溫30 min后,該酶隨溫度的升高活力逐漸降低,35℃時酶的活力顯著降低,為20℃時的22%,為30℃的29%。因此,該酶熱穩定性較差。
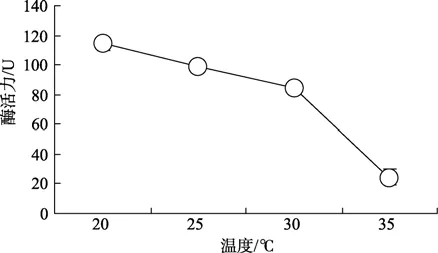
圖4 櫛孔扇貝血細胞中GST的熱穩定性Fig.4 Heat stabilities of GST in haemocytes of C.farreri
2.5 銅和鉛離子對血細胞中GST活力的影響
Cu2+對血細胞GST活力影響的測定結果見圖5。結果表明:Cu2+對該酶活力有明顯抑制作用,隨著Cu2+質量濃度的升高抑制作用增強。Cu2+質量濃度為0.25 mg/L該酶活力較對照組已下降了近 40%; 當Cu2+質量濃度升高到0.5 mg/L時其活力較對照組下降了78%; 當Cu2+質量濃度升高到2.5 mg/L時酶活力已接近0。
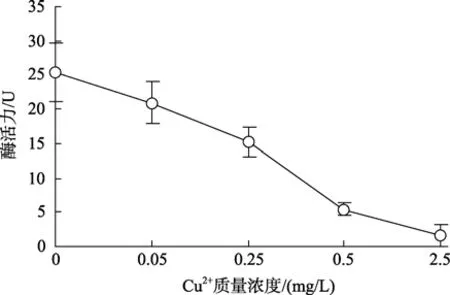
圖5 Cu2+對櫛孔扇貝血細胞中GST活力的影響Fig.5 Effects of Cu2+ on GST activity in haemocytes of C.farreri
Pb離子對血細胞GST活力影響的測定結果見圖6。結果表明:Pb2+對GST活力也有明顯抑制作用,隨著 Pb2+質量濃度的升高抑制作用增強。Pb2+為0.05mg/L時酶活力較對照組已下降了51%; Pb2+質量濃度升高到5mg/L時該酶失活。
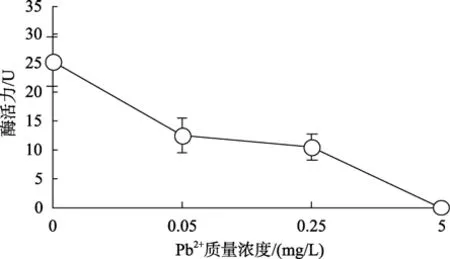
圖6 Pb2+對櫛孔扇貝血細胞中GST活力的影響Fig.6 Effects of Pb2+ on GST activity in haemocytes of C.farreri
3 討論
本實驗結果表明,櫛孔扇貝血細胞 GST的最適溫度為 30℃,較馬素永等[19]CDNB法測得玉米螟(Ostrinia furnacalis)GST的最適溫度41℃為低; 尹登科等[20]利用大腸桿菌表達日本血吸蟲(Schistosoma japonicum)GST后,CDNB法測得其最適作用溫度為37℃,也高于本實驗結果; 日本血吸蟲 GST對溫度的穩定性也高于櫛孔扇貝。玉米螟GST最適pH為6.3~6.9,日本血吸蟲GST最適pH為7.0,均稍低于櫛孔扇貝。GST是一組多功能同功酶,為由多種不同亞基構成的二聚體,不同物種不同組織中可有不同種類的GST[21],因此,在不同物種間可存在GST理化性質的差異。櫛孔扇貝血細胞GST對溫度的穩定性較差,室溫下對該酶操作易失活,用于實驗的樣品在4℃保存時間最好不要超過12 h。櫛孔扇貝不同組織中GST同功酶的分型、分布等有待于進一步的研究。本實驗顯示,應用CDNB法測定GST活力時,緩沖液種類有影響作用,同為pH6.5的緩沖液,25℃為測定溫度的條件下,用PBS緩沖液較檸檬酸-檸檬酸鈉緩沖液酶活力要高出近 8倍,其原因有待進一步研究。
貝類血細胞殺死被吞噬的病原菌等異物的主要機制之一是伴隨吞噬引起的呼吸突發產生的具殺菌作用的超氧陰離子和 H2O2等活性氧,活性氧對貝類機體也有毒害作用,須及時清除。GSH可通過巰基與體內自由基結合轉化成容易代謝的酸性物質,從而加速超氧陰離子、H2O2和脂質過氧自由基等自由基的排泄,同時GSH又可通過GST發揮作用,抑制脂質過氧化,保護細胞膜恢復細胞功能,并可保護細胞內含巰基的酶的活性,防止因巰基氧化導致蛋白質變性,減少自由基對 DNA的攻擊,從而減少DNA損傷和突變[3]。本文結果表明扇貝的血淋巴中含有GST,說明扇貝體內也存在GST和GSH清除自由基的免疫防御機制。
貽貝(Mytella guyanensis)等濾食性雙殼貝類組織中的 GSH、GST、SeGPx等對水中重金屬離子等污染物比較敏感,污染物含量高的組織中 GST等的活力也較高[11,13],因此,某些貝類體內的 GST等可作為污染的生物標志物。但不同污染物對貝組織中GST活力的影響不同[6],已有報道顯示不同質量濃度金屬離子暴露實驗對貝類GST活性影響無一致的規律,有的顯示GST活性無改變[12],有的顯示GST活性降低[10]。Hunaitia等[22]用不同質量濃度的氯化鉛體外(37℃)孵育人全血24 h后,血液中GST活性隨 Pb+質量濃度升高而下降,說明鉛對 GST活力抑制作用的存在。本實驗結果顯示,金屬離子銅和鉛對櫛孔扇貝血細胞GST活性有顯著直接抑制作用。對貝類組織中GST性質尤其是抑制劑、激活劑的研究對GST作為污染的生物標志物的應用有一定的參考價值。
[1]陳瑗,周玫.自由基醫學基礎與病理生理[M].北京:人民衛生出版社,2002:126-132.
[2]Antognelli C,Francesca B,Andrea P,et al.Activity changes of glyoxalase system enzymes and glutathione-S transferase in the bivalve molluscScapharca inaequivalvisexposed to the organophosphate chlorpyrifos[J].Pesticide Biochem Physiol,2006,86:72-77.
[3]Bebianno M J,Company R,Serafim A,et al.Antioxidant systems and lipid peroxidation inBathymodiolus azoricusfrom Mid-Atlantic Ridge hydrothermal vent fields[J].Aquat Toxicol,2005,75:354-373.
[4]Pannunzio T M,Storey K B.Antioxidant defenses and lipid peroxidation during anoxia stress and aerobic recovery in the marine gastropodLittorina littorea[J].J Exp Mar Biol Ecol,1998,221:277-292.
[5]Zielinski S,P?rtner H O.Oxidative stress and antioxidative defense in cephalopods:a function of metabolic rate or age? [J].Comp Biochem Physiol,2000,125 B:147-160.
[6]Petushok N,Gabryelak T,Pa?ecz D,et al.Comparative study of the xenobiotic metabolising system in the digestive gland of the bivalve molluscs in different aquatic ecosystems and in aquaria experiments[J].Aquat Toxicol,2002,61:65-72.
[7]Lau P S,Wong H L.Effect of size,tissue parts and location on six biochemical markers in the green-lipped mussel,Perna viridis[J].Mar Pollut Bull,2003,46:1563-1572.
[8]Luca-Abbott S B D,Richardson B J,McClellan K E,et al.Field validation of antioxidant enzyme biomarkers in mussels (Perna viridis) and clams (Ruditapes philippinarum) transplanted in Hong Kong coastal waters[J].Mar Pollut Bull,2005,51:694-707.
[9]Looise B A S,Holwerdu D A,Foekemu E M.Induction of glutathione S transferase in the freshwater bivalveSghderium corneumas a biomarker for short-term toxicity tests? [J].Comp Biochem Physiol,1996,113C(1):103-107.
[10]Regoli F,Nigro M,Orlando E.Lysosomal and antioxidant responses to metals in the Antarctic scallopAdamussium colbecki[J].Aquat Toxicol,1998,40:375-392.
[11]Torres M A,Testa C P,Gáspari C,et al.Oxidative stress in the musselMytella guyanensisfrom polluted mangroves on Santa Catarina Island,Brazil[J].Mar Pollut Bull,2002,44:923-932.
[12]Almeida E A D,Miyamoto S,Bainy A C D,et al.Protective effect of phospholipid hydroperoxide glutathione peroxidase (PHGPx) against lipid peroxidation in musselsPerna pernaexposed to different metals[J].Mar Pollut Bull,2004,49:386-392.
[13]Cheung C C C,Zheng G J,Lam P K S, et al. Relationships between tissue concentrations of chlorinated hydrocarbons (polychlorinated biphenyls and chlorinated pesticides) and antioxidative responses of marine mussels,Perna viridis[J].Mar Pollut Bull,2002,45:181-191.
[14]Bocchetti R,Regoli F.Seasonal variability of oxidative biomarkers,lysosomal parameters,metallothioneins and peroxisomal enzymes in the Mediterranean musselMytilus galloprovincialisfrom Adriatic Sea[J].Chemosphere,2006,65:913-921.
[15]Borkovic S S,Saponjic J S,Pavlovic S Z.The activity of antioxidant defence enzymes in the musselMytilus galloprovincialisfrom the Adriatic Sea[J].Comp Biochem Physiol,2005,141C:366-374.
[16]Power A,Sheehan D.Seasonal variation in the antioxidant defence systems of gill and digestive gland of the blue mussel,Mytilus edulis[J].Comp Biochem Physiol,1996,114C(2):99-103.
[17]陳榮,鄭微云,余群,等.石油污染對僧帽牡蠣谷光甘肽含量及相關酶活性的影響[J].海洋學報.2003,25(增 2):226-230.
[18]楊海靈,高波,曾慶銀,等.對生蒴蛤谷光甘肽轉移酶的光譜研究[J].高等學校化學學報,2003,24(8):1472-1476.
[19]馬素永,周先碗,張廷芳.玉米螟谷胱甘肽轉硫酶的純化及性質研究[J].北京大學學報(自),1999,35(4):474-478.
[20]尹登科,丁虹,喻昕.殼聚糖固定化谷光甘肽硫轉移酶的研究[J].生物技術,2004,14(6):17-19.
[21]聶立紅,王聲涌,胡毅玲.谷光甘肽硫-轉移酶研究進展[J].中國病理生理雜志,2000,16(11):1240-1243.
[22]Hunaiti A A,Soud M.Effect of lead concentration on the level of glutathione,glutathione S-transferase,reductase and peroxidase in human blood[J].Sci Total Environ,2000,248:45-50.

