魁蚶雌核發育的人工誘導
楊 青,李 琪,聶鴻濤,鄭小東,于瑞海
(中國海洋大學 海水養殖教育部重點實驗室,山東 青島 266003)
人工誘導雌核發育是快速建立純系、克隆的有效手段。目前有關水產動物雌核發育的研究多見于魚類[1-4],在海洋經濟貝類人工雌核發育研究方面,已報道的種類限于太平洋牡蠣 (Crassostrea gigas)[5]、貽貝(Mytilus edulis)[6]、地中海貽貝(Mytilus galloprovincialis)[7]、皺紋盤鮑(Haliotis discus hannai)[8]、華貴櫛孔扇貝(Chlamysnobilis)[9]、蝦夷扇貝(Patinopecten yessoensis)[10]、櫛孔扇貝(Chlamys farrer)[11]和馬氏珠母貝(Pinctada martensii)[12]等貝類,為近交系的開發以及基因著絲粒作圖等遺傳學研究提供了有用素材。
魁蚶(Scapharca broughtonii)俗名赤貝,屬于瓣鰓綱、翼形亞綱、蚶目、蚶科,主要分布在中國、日本及朝鮮沿海,是中國近海漁業生產的重要貝類資源之一。然而,由于近年來魁蚶野生資源因濫捕、棲息地破壞而嚴重衰退,很多地區已較難采集。目前,國內外關于魁蚶的研究主要集中在育苗生產、增殖放流、繁殖生物學等方面,其他方面的研究報道相對較少。為保護和利用魁蚶這種珍貴的海產貝類資源,積累有關遺傳學資料,本研究利用紫外線人工誘導魁蚶雌核發育并探索其最佳條件,以期為魁蚶雌核發育二倍體品系的培育和近交系的開發提供基礎數據。
1 材料與方法
1.1 材料
實驗所用親貝取自山東威海自然海區的2齡貝(殼長10.7 cm±0.5 cm,殼高6.4 cm±0.3 cm)。親貝經刷干凈后入池,于浮動網箱中暫養(水溫16℃),每天換水投餌,餌料為叉鞭金藻、三角褐指藻和鹽藻。
1.2 精卵的采集
采用陰干升溫的方法獲取成熟精、卵,并分別用海水定量至濃度為1.0×107個/mL和2.0×104個/mL。所用海水為四級砂濾海水,培養溫度為23~25℃。
1.3 紫外線處理精子和受精
將1.0 mL精液置于直徑9.0 cm的塑料培養皿中,將培養皿置于紫外線殺菌燈下 25 cm處,用紫外線強度測定儀(法國Cole-Parmer公司)測得此條件下紫外線強度為2 561 μW/(cm2·s)。將精子在紫外線下分別處理0,10,15,20,25,30,35,40,45,50,55和60 s。照射結束后每個培養皿中加入5.0 mL卵液,充分混合后轉移至燒杯培養,溫度保持23~25℃。
1.4 數據統計和倍性檢查
通過計算授精后 3 h分裂卵數占總處理卵數的百分比獲得卵裂率,通過計算授精后8 h擔輪幼蟲數占總受精卵數的百分比獲得早期胚胎存活率,通過計算授精后24 h D形幼蟲數占總觀測幼蟲數的百分比獲得 D形幼蟲發生率。采用不同的親貝,該實驗重復進行3次。
采用染色體制片法測定擔輪幼蟲倍性,具體操作如下:將擔輪幼蟲樣品濃縮后,用 0.1%的秋水仙素海水處理2 h,加入0.075 mol/L的KCl溶液低滲處理30 min,去掉低滲液,用Carnoy氏液(甲醇:冰醋酸=3:1)固定,反復固定 3次。滴片前去掉固定液,加入50%冰醋酸,用吸管輕輕吹打解離成單細胞。樣品滴到已經加熱的載玻片上,空氣干燥后經磷酸緩沖液(pH 6.8)稀釋的10% Giemsa染色。觀察和計數分散較好的中期分裂相(n=1 248)以獲得染色體數目。
利用流式細胞儀(德國 Partec公司,FCM)進行DNA 相對含量的分析,具體操作如下:將擔輪幼蟲或D形幼蟲樣品,濾除海水、雜質和組織塊后,移入盛有1.0 mL DAPI染液的1.5 mL離心管中,-20℃冷凍保存。檢測前將樣品解凍后在旋渦混合器上充分解離成單細胞懸液,經20 μm篩絹過濾樣品至流式細胞儀專用樣品管中,進一步去除組織塊,進行DNA相對含量分析。
2 結果
2.1 不同紫外線照射劑量對卵裂率、早期胚胎存活率和D形幼蟲發生率的影響
不同紫外線照射時間與卵裂率、早期胚胎存活率和D形幼蟲發生率的關系見圖1(圖1中各數據表示平均值 ± SD)。卵裂率總的趨勢是隨紫外線照射時間的增加而降低,對照組為89.1%,60 s照射組為20.7%。早期胚胎存活率隨照射時間的增加而逐漸下降,對照組為91.3%,35 s時為52.3%; 之后隨著照射劑量的增加而回升,至45 s照射組達到最高67.2%,之后再次急劇下降,60 s照射組為16.0%。D形幼蟲發生率隨照射時間增加顯著降低,對照組為 95.2%,照射30 s時,其值變為0。
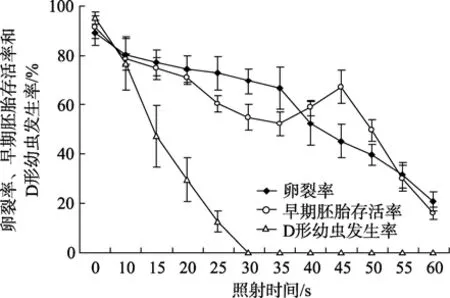
圖1 卵裂率、早期胚胎存活率和D形幼蟲發生率與不同紫外線照射時間之間的關系Fig.1 Relationships between ultraviolet irradiation duration and the rates of cleavage,survival at the early embryo stage and development of D-larvae
2.2 流式細胞儀測定結果
圖2以DNA直方圖的形式顯示了對照組(0 s)和雌核發育組(45 s)擔輪幼蟲的 DNA相對含量。對照組和45 s照射組的DNA相對含量均有2個峰,一個為存在比率較高、DNA沒有開始復制的G1期細胞,另一個為存在比率較低、DNA復制完全的G2和M期細胞[13]。其中對照組主峰值為104.95,45 s照射組主峰值為 51.18,二者的比值為 2.05,說明對照組的DNA相對含量基本上為45 s照射組的2倍,即45 s照射組能有效地誘導產生雌核發育單倍體。

圖2 對照組(0 s)和雌核發育組(45 s)擔輪幼蟲的DNA相對含量Fig.2 Histograms of fluorescence intensity from diploid control and 45 s irradiated trochophore larvae by flow cytometry
2.3 染色體頻率分布
圖3顯示了各實驗組中的幼蟲細胞染色體數目的頻率分布情況。對照組中幾乎全部為二倍體(2N),染色體數目為38,20 s照射組中染色體數目為2N=38的幼蟲仍占一定比例,但隨照射時間增加,2N比例減少,染色體數目為N=19的單倍體細胞和非整倍體細胞比例逐漸增加。45 s照射組大部分細胞染色體數目均為19,單倍體比例為37.1%,此時已無二倍體細胞。60 s照射組中染色體數目為19的細胞比例明顯減少。
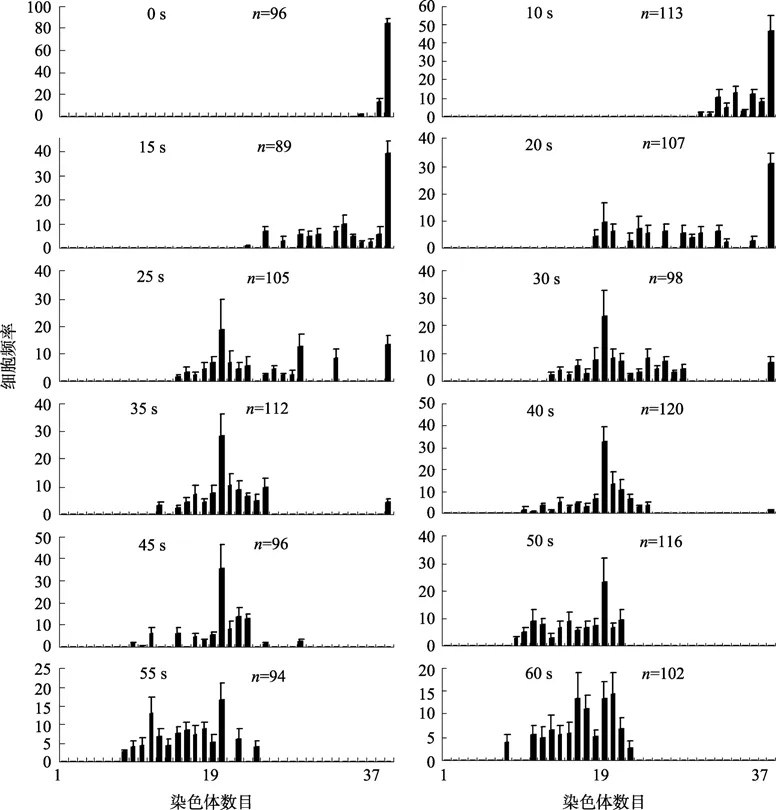
圖3 各實驗組細胞染色體數目分布頻率Fig.3 Frequency distribution of chromosome numbers in larval cells by various durations of ultraviolet irradiation in three experiments (± SD)
3 討論
本研究發現利用紫外線(254 nm)遺傳失活魁蚶精子DNA從而誘導雌核發育是有效的。根據染色體數目分析結果和流式細胞儀分析的結果可以看出,強度為 2 561 μW/(cm2·s) 的紫外線照射 20~60 s均能誘導出魁蚶雌核發育單倍體,但照射20~40 s時二倍體仍然存在,而且照射時間超過 45 s后受精率就會明顯下降。由于有效地誘導雌核發育既需要精子遺傳物質失活又需要保證較高的受精率,因此強度為2 561 μW/(cm2·s)的紫外線照射遺傳失活魁蚶精子的適宜劑量為45 s。在已報道的貝類雌核發育研究中,櫛孔扇貝是強度為 2 561 μW/(cm2·s)的紫外線照射30 s[14],太平洋牡蠣是強度為 720 μW/(cm2·s)的紫外線照射60 s[5],地中海貽貝是強度為620 μW/(cm2·s)的紫外線照射2 min[7]。由此可見誘導貝類精子遺傳失活的紫外線照射劑量因種類的不同而異。
紫外線照射導致精子染色體遺傳失活的原理在于它能夠使DNA氫鍵斷裂,同一鏈上相鄰的或雙螺旋相對應的兩條鏈上的胸腺嘧啶之間形成胸腺嘧啶二聚體,致使雙螺旋兩鏈間的氫鍵減弱,DNA結構局部變形,從而嚴重影響DNA的正常復制和轉錄[15]。本實驗中各照射組均出現非整倍體,由于紫外線的照射劑量決定精子染色體的失活程度,因此實驗中出現非整倍體可能是低劑量紫外線造成精核染色體部分失活的結果,即未完全失活的精子染色體入卵后與卵核結合,所生成的合子則為非整倍體。Watson[16]認為在特定的酶作用下,由紫外線引起的DNA損傷可以被光修復,這同樣可以導致父本染色體部分參與核分裂,從而導致非整倍體的產生。
實驗中隨紫外線照射時間的增加,卵裂率、早期胚胎存活率和 D形幼蟲發生率總體呈下降趨勢,經紫外線照射的精子受精后所產生的單倍體胚胎發育速度明顯慢于正常受精所產生的二倍體胚胎。卵裂率的下降表明精子激活卵子的能力隨紫外線照射劑量的增加而降低,原因可能是精子中一些與受精力、胚胎發育相關的功能結構受到破壞的程度增大,從而減弱了精子的受精力。紫外線照射30 s后D形幼蟲發生率降為0,照射35~45 s時早期胚胎存活率出現回升,呈現Hertwig效應。該現象在皺紋盤鮑[8,17]、太平洋牡蠣[18]、合浦珠母貝[12]、櫛孔扇貝[14]等貝類的雌核發育研究中也有報道。Hertwig效應產生的原因可能是由于高輻射劑量能完全破壞精子的遺傳物質,導致產生的單倍體胚胎比低劑量誘發出來的具有顯性致死突變基因的非整倍體胚胎存活時間長[17]。本研究首次報道了利用紫外線誘導魁蚶雌核發育的適宜條件,為魁蚶雌核發育二倍體的人工誘導提供了基礎數據。
4 結論
本研究首次研究了利用紫外線照射進行魁蚶雌核發育的人工誘導,發現隨照射時間的增加,卵裂率、早期胚胎存活率和D形幼蟲發生率呈下降趨勢,遺傳失活的精子與正常卵子受精后其胚胎發育至D形幼蟲前期停止。根據染色體計數和基于流式細胞儀的細胞倍性分析,確定魁蚶精子遺傳失活的最佳照射劑量為在強度 2 561 μW/(cm2·s)的紫外線下照射45 s。研究結果為開展魁蚶雌核發育二倍體的人工誘導研究奠定了基礎。
[1]Purdom C E,Thompson D,Lou Y D.Genetic engineering in rainbow troutSalmo gairdneriiRichardson,by suppression of meiotic and mitotic metaphase [J].J Fish Biol,1985,27:73-79.
[2]Yamamoto E.Studies on sex-manipulation and production of cloned populations in hirame,Paralichthys olivaceus(Temminck et Schlegel) [J].Aquaculture,1999,173:235-246.
[3]Harald B T,Tillmann J B,Deborah J M R,et al.Gynogenesis and sex determination in Atlantic Halibut(Hippoglossus hippoglossus) [J].Aquaculture,2006,252:573-583.
[4]Francesc P,Rosa M C,Castora G,et al.Induction of gynogenesis in the turbot (Scophthalmus maximus):Efects of UV irradiation on sperm motility,the Hertwig efect and viability during the flint 6 months of age [J].Aquaculture,2004,238:403-419.
[5]Li Qi,Osada M,Kashihara M,et al.Induction of gynogenetic diploids and cytological studies in the Pacific oyster,Crassastrea gigas[J].Suisanzoshoku,2000,48(2):185-191.
[6]Fairbrother J E.Viable gynogenetic diploidMytilus edulis(L.) larvae produced by ultraviolet light irradiation and cytochalasin B shock [J].Aquaculture,1994,126:25-34.
[7]Scarpa J,Komaru A,Wada K T.Gynogenetic induction in the mussel,Mytilus galloprovincialis[J].Bull Natl Res Inst Aquac,1994,23:33-41.
[8]Li Qi,Osada M,Kashihara M,et al.Artificially induced gynogenetic diploid in the Pacific abalone,Haliotis discus hannai[J].Fish Genet Breed Sci,1999,28:85-94.
[9]Goswami U.Sperm density required for inducing gynogenetic haploidy in scallopChlamys nobilis[J].Indian J Mar Sci,1991,20:255-258.
[10]Li Qi,Osada M,Kashihara M,et al.Effects of ultraviolet irradiation on genetical inactivation and morphological structure of sperm of the Japanese scallop,Patinopecten yessoensis[J].Aquaculture,2000,186:233-242.
[11]Pan Ying,Li Qi,Yu Ruihai,et al.Induction of gynogenetic diploids and cytological studies in the zhikong scallop,Chlamys farreri[J].Aquat Living Resour,2004,17:201-206.
[12]許國強,林岳光,李剛,等.人工誘導合浦珠母貝雌核二倍體發生及“Hertwig”效應的初步研究 [J].熱帶海洋,1990,9:1-7.
[13]Bruce A,Dennis B,Julian L,et al.Molecular biology of the cell [M].New York:Garland Publishing,1994.
[14]Pan Ying,Li Qi,Yu Ruihai,et al.Induction of gynogenesis and effects of ultraviolet irradiation on ultrastructure of sperm of the Zhikong scallop,Chlamys farreri[J]. Fisheries Science,2004,70:487-496.
[15]樓允東.人工雌核發育及其在遺傳學和水產養殖上的應用 [J].水產學報,1986,10(1):111-123.
[16]Watson J D.Molecular Biology of the Gene [M].London:W A Benjamin,Inc.1975.
[17]Kijima A.Effect of UV irradiation on genetic inactivation of sperm using marketing tissue culture petri dish in the Pacific abaloneHaliotis discus hannai[J].Tohoku Journal of Agriculture Research,1992,42:73-81.
[18]Guo Ximing,Gaffney P M.Artificial gynogenesis with ultraviolet light-irradiated sperm in the Pacific oyster,Crassostrea gigasII.Allozyme inheritance and early growth [J].Heredity,1993,84:311-315.

