后刺才女蟲胚胎及幼蟲發育過程研究
高 燕,張 濤,楊紅生,張曉芳
(1.中國科學院 海洋研究所,山東 青島 266071; 2.中國科學院 研究生院,北京 100049; 3.獐子島漁業集團股份有限公司,遼寧 大連 116001)
才女蟲屬復合體(Polydora-complex)是環節動物門(Annelida)、多毛綱(Polychaeta)、游走目(Erranta)、海稚蟲科(Spionidae)中具變形第 5剛節種類的統稱[1]。才女蟲以第5剛節的粗足刺剛毛鉆孔穴居于石灰質的石塊、珊瑚和軟體動物貝殼中,尤其對扇貝、珍珠貝、鮑、牡蠣、菲律賓蛤仔等經濟貝類危害極大[2-8]。才女蟲侵染使病貝生長緩慢,貝殼受損,由于管道的形成使貝殼易碎; 當蟲體鉆穿貝殼達到軟體部時,則直接侵害軟體部,被侵組織周圍發生炎癥,局部形成膿腫和潰瘍,引起細菌繼發性膿瘍,并產生一種特殊的臭味,大大降低了貝類的品質和價值,嚴重時導致貝類死亡。Lleonart[9]報道澳大利亞鮑魚由于才女蟲病爆發,殼變薄易碎,死亡率高達50%~90%。
魁蚶(Anadara uropygimelana)俗稱大毛蚶、赤貝、血貝,屬瓣鰓綱(Lamellibranchia)、翼形亞綱(Pterimorphia)、蚶目(Arcoida)、蚶科(Arcidae),其貝殼大而堅厚,左右兩殼相等,呈斜卵圓形,極膨脹,殼頂膨脹突出,放射肋寬,平滑無明顯結節,約42~48條,以43條者為多。魁蚶為冷水性貝類,主要分布于中國、日本、朝鮮半島及俄羅斯東南部沿海,生活在水深3~50 m的軟泥或泥沙質海底[10]。我國山東及遼寧沿海都有分布,以黃海北部較多。魁蚶成體個大體肥,營養豐富,是一種頗受歡迎的經濟貝類[11]。但是底播養殖的魁蚶生活在軟泥或泥沙質海底,經常受到才女蟲病的困擾。
才女蟲對浪蛤、牡蠣、鮑、扇貝等經濟貝類危害的研究已有報道[12-15],而對魁蚶的危害尚未見詳細報道。我們對山東榮成地區養殖的魁蚶才女蟲病進行了研究,確定該種為后刺才女蟲(Polydora latispinosaBlake & Kudenov,1978); 同時還描述了患病魁蚶的癥狀,后刺才女蟲的幼蟲發育過程及各發育階段幼蟲形態結構特點,豐富了多毛類繁殖生物學資料,并為魁蚶才女蟲病的防控提供科學參考依據。
1 材料與方法
1.1 才女蟲成蟲的收集
魁蚶樣品于2010年5月份采自山東威海。寄生有才女蟲的魁蚶檢出后放入 25℃海水中暫養,每天投喂混合單胞藻。用鉗子和小鑷子將寄生有才女蟲的魁蚶上殼掰碎后,在解剖鏡下將成蟲從管穴中移出,7%氯化鎂麻醉后在光學顯微鏡下觀察。
1.2 才女蟲幼蟲的培養
部分雌蟲的泥管中有卵袋黏附在管壁上,將含有卵袋的泥管放入1 000 mL燒杯中培養,每隔12 h在解剖鏡和顯微鏡下觀察一次。用 300目篩絹過濾暫養魁蚶的海水收集幼蟲,放入30 cm×40 cm×50 cm塑料箱中培養,水溫25℃,鹽度30~32。每隔一天換一次水,每天投喂少量金藻和小球藻,幼蟲轉入底棲生活后加入底棲硅藻。每天在顯微鏡下觀察幼蟲生長情況。
2 結果
2.1 后刺才女蟲成蟲形態
被才女蟲寄生的魁蚶會在貝殼表面留下一道至絞合部的凹槽,如圖 1A。為了阻止才女蟲侵入,魁蚶會不停地分泌珍珠層把才女蟲包裹起來,最后就在貝殼的內表面形成一個瘤狀的突起,如圖1B,C。由于才女蟲在魁蚶外套膜上鉆孔,導致外套膜潰瘍發紅,更容易受到病菌的侵染,增加患病率和死亡率。用解剖鉗和鑷子小心地將瘤狀突起打開,可見里面盤踞著才女蟲。成體的后刺才女蟲體長可長達17 cm,體色呈橙黃色或棕褐色,可分為 3部分:頭部,軀干部,尾部(圖1D)。頭部由口前葉和圍口節組成,口前葉前端圓鈍,具中間缺刻,向后形成腦后脊;圍口節發達,在兩側形成側翼狀包圍著口前葉。一對發達的觸手著生在圍口節的后緣,觸手較長,具伸縮性,其上具明顯的溝槽,溝槽周圍密被厚實的纖毛。軀干部由頭后的數百個剛節組成,是蟲體的主要部分。由于前后體節的結構不同,又可分為體前部和體后部。體前部包括圍口節向后第一至第五剛節,其中前四個體節疣足為典型的雙葉型,即具背葉和腹葉、背剛毛和腹剛毛、背須和腹須、背足刺和腹足刺。第五剛節較其他剛節長,兩種特殊剛毛排成兩排,一排為細毛狀的剛毛(約 5~6根),另一排稍彎曲,為變形粗足刺剛毛(4~5根),具伴隨剛毛。鰓始于第五剛節以后,在解剖鏡下,可清楚地看見其背面中央充滿紅色血液的血管貫穿身體前后端,并有分支血管將血液輸向各疣足部分。體后部背部有足刺狀剛毛,為巾鉤狀。尾部為身體最后的數個體節,肛部呈領狀,中間有缺凹。
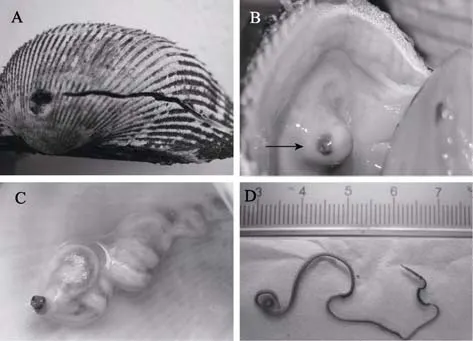
圖1 被后刺才女蟲寄生的魁蚶Fig.1 Anadara uropygimelana infested by Polydora latispinosa
2.2 后刺才女蟲胚胎發育過程
后刺才女蟲發育過程分為卵、胚胎、幼蟲和成蟲4個階段。成熟的個體含有卵或精子; 沒有證據表明它們是雌雄同體。配子只存在于身體中間的體節。終年都可以在雌蟲身體內發現卵細胞,但是發現有卵袋的月份比較少,推測只有在條件適宜時才把卵細胞排出體外。卵袋的形狀與眾不同,用規則排列的不成對的細絲掛在管壁上(圖2)。每個卵袋中約含有100粒受精卵,才女蟲每次產20~40個卵袋。在卵袋中正在分裂的胚胎呈球形,直徑約為 90 μm。早期,胚胎呈靜止狀態,部分胚胎緊靠著卵袋膜,且卵袋膜繃得比較緊,當有胚胎開始旋轉后,胚胎與卵袋膜之間逐漸有了空隙,卵袋變成扁長形。胚胎發育完全后,即破袋而出(圖2B)。

圖2 后刺才女蟲卵袋Fig.2 The egg capsules of Polydoralatispinosa
卵子受精后卵膜迅速膨大,形成膠狀外膜,卵徑達到120 μm左右(圖3A)。受精卵進行螺旋形卵裂,3次卵裂為大小不等的8個分裂球(圖3B),排列為上下兩層。8細胞期以后,細胞數目迅速增加,經過多次卵裂發育到多細胞期,但胚胎的大小基本與受精卵相當。胚胎經過囊胚期進入原腸胚后,胚體長出極細的纖毛,借著纖毛的擺動,能使胚體在卵膜內轉動,此時胚胎長約150 μm(圖3C)。才女蟲在卵袋中孵化的時間比較長,大概需要5~8 d。隨著發育,胚體逐漸拉長,梨形,長 180~220 μm,寬 110~130 μm,進入擔輪幼蟲期。到擔輪幼蟲后期,此時具有4條纖毛輪(口前纖毛輪、2條中纖毛輪、端纖毛輪)和2條纖毛束(頂纖毛束和端纖毛束),前端有兩個眼點,體側具有3對乳突狀的疣足及其未伸出疣足的剛毛束,體內可見清晰的油球顆粒(圖3D)。此時幼蟲可借不斷運動掙脫卵袋孵化。
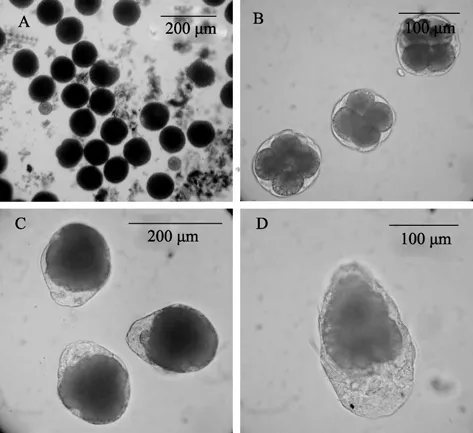
圖3 后刺才女蟲胚胎發育過程Fig.3 The embryo development of Polydoralatispinosa
2.3 后刺才女蟲幼蟲發育過程
后刺才女蟲早期幼蟲營浮游生活,且明顯具有趨光性。幼蟲身體透明,每個體節都有剛毛,以第一體節剛毛數較多,每側有 6 根。幼蟲依靠剛毛的擺動而前進,運動速度較快。在其頭部上方有兩對眼點,前面一對較大,且眼間距離寬,后一對較小,眼間距離也較小。隨著體節數增加,達16~18節后,每一節的體側(除第 5節外) 都可見疣足,當身體發育至15~20 節后,第五節變粗,明顯大于其他體節,觸手也開始變得明顯,長度達360 μm 以上,但受到刺激時,不能靈活收縮。身體尾端有纖毛環,幼蟲能憑纖毛環黏附在燒杯壁上。尾端的中央有排泄孔。
三剛節幼蟲(圖 4A):在三剛節幼蟲期幼蟲從卵袋中釋放出來,能游動并具有明顯的趨光性。浮游的三剛節幼蟲平均體長240 μm,頭部的最大體寬90 μm。第一剛節的剛毛囊大并且顯著,包括7到10根長的鋸齒狀的剛毛。少數鋸齒狀的剛毛出現在第2和第3剛節。有很重纖毛的前庭被先前的四五根有觸覺的纖毛環繞。口形成并且消化管發育完善。內臟中依然有明顯的卵黃。六個眼狀物出現在頭部的背面,包括兩個大的杯狀的生在側面的眼和兩對小的圓形的生在中間的眼。兩根長的有觸覺的纖毛生在杯狀眼稍后的區域。前纖毛環由六簇明顯的纖毛組成,兩簇在腹部,兩簇在腹外側,兩簇在背外側。兩簇不明顯的頸背纖毛出現。內臟由于攝取的藻類呈黃褐色。胚胎卵黃消失。
五剛節幼蟲(圖4B):在25℃下,約兩天即可發育到五剛節。身體仍透明,消化道發育完善,從圍口節到排泄孔形成一條管道,體壁收縮把消化后的食物排泄至體外。

圖4 后刺才女蟲的幼蟲發育過程Fig.4 The larvae development of Polydoralatispinosa
九剛節幼蟲(圖4C):在 25℃下,約五天即可發育到九剛節。隨著幼蟲的發育,體色不斷加深,在背部出現黑色的斑點。這個階段幼蟲運動靈活,觀察到可以捕捉并吞食貝類的D形幼蟲。所以在貝類育苗中,才女蟲不僅和貝類爭奪餌料,還捕食貝類幼蟲,給育苗業造成極大的危害。
十六剛節幼蟲(圖 4D):十六剛節期處于浮游生活的晚期。這些幼蟲長 1 300~1 400 μm,寬 180 μm,體節分化明顯。疣足開始發育,但剛毛仍很長。背部出現黑色的花紋,圍口節逐漸形成,并且開始出現下沉的行為,為尋找附著基做準備。
二十二剛節幼蟲(圖4E):此階段幼蟲基本上營底棲生活,依靠體壁肌肉收縮快速蠕動。剛毛變短,疣足發育完成,身體分節明顯,第五剛節變粗并且形成變形剛毛。
稚蟲(圖4F):稚蟲分泌黏液粘附泥土顆粒和殘餌碎屑,形成管狀,把自己包裹在里面,營管棲生活,這時幼蟲的形態和生態都與成蟲相似。
3 討論
海稚蟲科幼蟲發育方式可以為 3類:(1)完全浮游生活發育; (2)完全或者部分在雌蟲構造的結構中發育; (3)在雌蟲體內發育。Blake[16]1969年記述了新英格蘭北部海域 8種才女蟲的繁殖時間、幼蟲發育過程。這 8種才女蟲分別是:Polydora ligni,P.latispinosa,P.websteri,P.commensalis,P.socialis,P.concharum,P.quadrilobata和P.caulleryi。前 7 種是從卵袋中的胚胎開始觀察,而P.caulleryi只收集到了浮游幼蟲。P.concharum和P.quadrilobata在冬季繁殖,卵細胞較大; 其余的6種在春季和夏季繁殖,卵細胞較小。在Blake 的研究中P.quadrilobata存在兩種發育方式:一種是受精卵吸收周圍未受精的卵細胞中的營養,幼蟲浮游期短; 另一種是沒有周圍的輔助細胞為受精卵提供營養,幼蟲浮游期長。Blake推測可能是相似種,分類未明確。
后刺才女蟲與鑿貝才女蟲繁殖方式類似,都是把受精卵產在卵袋中,胚胎發育為 3剛節幼蟲后開始浮游生活,經過一段時間后開始下潛尋找合適的附著基進行附著變態[17]。張樹林[18]對利氏才女蟲(Polydora ligni)幼蟲的發育過程及各發育階段形態結構特點作了觀察研究,結果表明在溫度 16℃±3℃下,卵在卵袋中經過4 d發育成3剛節浮游幼蟲后進入水體開始浮游生活,13 d后14剛節的浮游幼蟲開始變態,19 d發育成21剛節后開始轉為底棲生活,21 d后23剛節的底棲幼蟲完成變態營管棲生活。才女蟲的附著變態過程不容易鑒定,因為它們沒有明顯的時段分界線特征。一般認為變態過程中形態學的變化包括前纖毛環,端纖毛環,項纖毛和鋸齒狀的幼蟲剛毛[19]。后刺才女蟲在附著變態過程中觸手開始長出,很快達到成蟲的長度。后刺才女蟲不容易被誘導變態,通過向海水中添加底棲硅藻、海泥等,大約只有百分之一的幼蟲完成了附著變態過程,其余的一直營浮游生活,但其體節不再增加。因而才女蟲延遲變態的能力非常強。
觀察中發現后刺才女蟲幼蟲能夠捕食貝類幼蟲,因此在魁蚶育苗生產中親貝的選擇要嚴格把關,務必不要將帶病親貝混入育苗室。一旦將寄生有才女蟲的魁蚶混入親貝中,后刺才女蟲將大量繁殖,與貝類幼苗爭奪餌料,并且捕食貝類幼苗,對育苗業造成巨大危害。
[1]Radashevsky V I.Revision of the genusPolydoraand related genera from the North West Pacific (Polychaeta:Spionidae) [J].Publications of the Seto Marine Biological Laboratory,1993,36(1-2):1-60.
[2]崔秀林.扇貝養殖中黑殼病的發生和預防[J].河北漁業,1995,81:16.
[3]Nel R,Coetzee P S,Niekerk G V.The evaluation of two treatment to reduce mud worm (Polydora hopluraClaparede) infestation in commercially reared oysters(Crassostrea gigasThunberg) [J].Aquaculture,1996,141(1-2):31-39.
[4]Marnnez J C,Montes P M,Yeomans R V.Polydorasp.infestation and health of the Pacific OysterCrassostrea gigascultured in Baja California,NW Mexico [J].Journal of Shellfish Research,1998,17(1):259-264.
[5]Boscolo R,Giovanardi O.Polydora ciliatashell infestation inTapes philippinarumManila clam held out of the substrate in the Adriatic Sea,Italy [J].Journal of Invertebrate Pathology,2002,79(3):197-198.
[6]劉慧玲.鑿貝才女蟲發育階段的形態觀察[J].湛江海洋大學學報,2003,23(6):8-11.
[7]王愛民,石耀華,吳星.4種防治馬氏珠母貝多毛類寄生病方法的效果比較[J].海洋水產研究,2004,25(2):41-46.
[8]Mcdiarmid H,Day R,Wilson R.The ecology of polychaetes that infest abalone shells in Victoria,Australia[J].Journal of Shellfish Research,2004,23(4):1179-1188.
[9]Lleonart M,Handlinger J,Powell M.Spionid mudworm infestation of farmed abalone (Haliotisspp.)[J].Aquaculture,2003,221(1-4):85-96.
[10]孫鵬飛,劉杰,王衛民,等.淺海底播養殖魁蚶試驗[J].河北漁業,2009,10:42-54.
[11]姚紅偉,郭晉,景娜娜.魁蚶增養殖狀況及遺傳多樣性研究進展[J].河北漁業,2010,5:45-47.
[12]Riascos J M,Heilmayer O,Oliva M E,et al.Infestation of the surf clam Mescidesma donacium by the spionid polychaete Polydora bioccipitalis[J].Journal of Sea Research,2008,59(4):217-227.
[13]Royer J,Ropert M,Mathieu M,et al.Presence of spionid worms and other epibionts in Pacific oysters(Crassostrea gigas) cultured in Normandy,France [J].Aquaculture,2006,253(1-4):461-474.
[14]Radashevsky V I,Olivares C.Polydora uncinata(Polychaeta:Spionidae) in Chile:an accidental transportation across the Pacific[J].Biological Invasions,2005,7(3):489-496.
[15]Satookoshi W,Sugawara Y,Nomura T.Reproduction of the boring PolychaetePolydora-Variegatainhabiting scallops in Abashiri Bay,North Japan [J].Marine Biology,1990,104(1):61-66.
[16]Blake J A.Reproduction and larval development of Polydora from northern New England [J].Ophelia,1969,7:1-63.
[17]Daro M H,Polk P.The autecology ofPolydora ciliataalong the Belgian coast [J].Netherlands Journal of Sea Research,1973,6 (1-2):130-140.
[18]張樹林,李曉東,畢相東.利氏才女蟲幼體發育的研究[J].四川動物,2009,28(6):801-809.
[19]Gibson G D,Ian G P.Morphogenesis during sexual and asexual reproduction inAmphipolydora vestalis(Polychaeta:Spionidae) [J].New Zealand Journal of Marine and Freshwater Research,2003,37:741-752.

