降解未處理纖維素厭氧混合菌群的篩選及功能
于艷玲,馮玉杰,高 霏,于麗新,徐 琛
(哈爾濱工業大學市政環境工程學院城市水資源與水環境國家重點實驗室,150090哈爾濱,yujief@hit.edu.cn)
包括木材及其加工廢棄物、快速生長的各種草類、農作物秸稈及城市垃圾等在內的纖維素類物質是世界上最廣泛和廉價的可再生資源[1-3].科學、合理地開發利用這一資源,將是實現可續發展的最有潛力的途徑之一.將纖維素降解為小分子物質——糖類或糖代謝中間產物[4],從而利用糖轉化平臺,使纖維素資源化,如產乙醇[5-6]、產電[7-9]、產氫[10]等,是木質纖維素獲得應用的重要途徑.但由于木質纖維素的復雜結構,纖維素尤其是不經預處理的纖維素物質很難被微生物降解或降解周期很長.因此,獲得高效穩定的原木質纖維素降解微生物,是國內外的研究熱點.動物的瘤胃是自然界最高效的發酵罐,瘤胃微生物能在48 h內消化瘤胃內50%的纖維素[11].因此,瘤胃是很好的纖維素降解菌的菌源庫.模擬瘤胃條件,馴化瘤胃微生物體外降解纖維素,對于獲得效果好的纖維素降解菌或菌群和研究厭氧纖維素降解菌群內的生態作用有著重要意義.
1 試驗
1.1 樣品來源
取哈爾濱郊區以秸稈為主要飼料的成年牛的牛胃殘渣.
1.2 培養條件
篩選培養基:750 mL無機鹽溶液,250 mL瘤胃液,L-半胱氨酸鹽酸鹽1.5 g;刃天青(0.1%,質量分數)1 mL,煮沸并充氮氣消氧后,每個培養瓶分裝90 mL,秸稈1 g,每瓶有兩條1 cm×3 cm的新華濾紙作降解指示物,用作失重率實驗時,不加濾紙條,培養基121℃,濕熱滅菌20 min.其中,無機鹽溶液的成分(750 mL):KH2PO4·2H2O 0.5 g,NaCl 1.0 g,(NH4)2SO40.5 g,CaC12· 2H2O 0.1 g,MgS04·7H2O 0.1 g,K2HPO4· 3H2O 0.5 g.
瘤胃液的制取:牛瘤胃液4層紗布過濾.
秸稈:自然風干當年收成的玉米秸稈,粉碎至2~3 mm.
預處理的秸稈:預處理的方法見文獻[12].
1.3 纖維素厭氧降解菌混合菌群的篩選和馴化
取哈爾濱郊區以秸稈為主要飼料的成年牛的瘤胃液與瘤胃殘渣懸濁液10 mL接種到90 mL的篩選培養基中,38.5℃恒溫靜止培養.待培養基中的指示濾紙崩解時,轉接于同樣的新鮮培養液中,如此轉接數代,挑選降解速度快且性能穩定的樣品,直至篩選出高效穩定的混合菌群.
1.4 混合菌群纖維素分解特性測定
1.4.1 底物失重率的測定
將1.0 g纖維素類物質作為唯一碳源制作90 mL培養基,接種10 mL菌液,38.5℃靜止培養5 d后,5 000 r/min離心,倒出清液,用鹽酸和硝酸的混合液沖洗而消除菌體,離心,清水洗,離心,105℃烘干后稱重,計算失重量和失重率[13].
1.4.2 纖維素酶酶活測定方法
取0.5 mL酶液,加pH=4.8乙酸-乙酸鈉緩沖液1.0 mL,加卷曲的新華1號濾紙(1 cm× 6 cm)一條,于 50℃水浴反應 30 min,加入1.0 mL的DNS溶液,沸水浴5 min,冷卻后加入蒸餾水定容至10 mL,在530 nm下測定其吸光度.同時在相同條件下做空白樣調零.
酶活力單位的定義為:在pH=4.8、50℃條件下,1 mL酶液每分鐘水解濾紙生成1 μg葡萄糖的酶量,稱為一個酶活力單位(IU).
1.4.3 混合菌群中菌種的分離純化
將1.2中所述的培養基中的秸稈和濾紙,換成羧甲基纖維素鈉,質量分數為1%,再加入2% (質量分數)的瓊脂,厭氧操作制成平板,將富集得到的纖維素厭氧降解菌液采用平板劃線分離法獲得一系列單個菌落,再挑取單菌落重復以上操作,直至獲得純培養.可作片在顯微鏡下觀察,直至菌株形態相同,編號做好記錄.
2 結果與分析
2.1 纖維素厭氧降解菌混合菌群的篩選與馴化
用1.3所介紹的篩選與馴化方法,得到了高效穩定的纖維素厭氧降解混合菌群,命名為FYG -2.FYG-2混合菌群在篩選培養的第2天,降解指示物濾紙條出現透明的蝕斑,5 d后濾紙完全崩解,秸稈底物變成乳濁狀,溶液渾濁;以濾紙為唯一碳源時,溶液顏色變淺(圖1).在培養過程中,有大量氣體生成,說明FYG-2混合菌群中不僅存在纖維素降解菌,還存在產甲烷菌等其他瘤胃菌種[14].培養3 d,FYG-2混合菌群對于滅菌和未滅菌濾紙的分解率分別是45.6%和44.8%,誤差小于5%,可以認為FYG-2對滅菌和未滅菌濾紙的降解性能是相同的.

圖1 FYG-2混合菌群培養物
經過30代以上的傳代培養,FYG-2混合菌群對濾紙分解3 d后,濾紙的失重率基本保持穩定(如圖2所示),說明該混合菌群對纖維素的降解性能穩定.FYG-2是一個混菌體系,利用瘤胃中自然存在的微生物之間的協同作用降解纖維素,這樣的體系環境適應性和抗干擾能力都要優于純菌,多次傳代以后一般不會出現純菌中存在的退化現象.

圖2 FYG-2的底物失重率與傳代次數的關系
2.2 FYG-2混合菌群的纖維素分解特性
2.2.1 對不同纖維素類物質的分解
分別以預處理的秸稈、未處理的秸稈和濾紙為底物,考查了FYG-2混合菌群對不同類型纖維素的分解情況(表1).表1結果表明,38.5℃靜止培養3 d后,預處理秸稈的底物失重率最低,僅為12.4%,而未處理的秸稈失重率卻達到了36.5%,濾紙條的失重率最高,為45.6%,說明底物降解的難易順序為濾紙>未處理的秸稈>預處理后的秸稈.濾紙比秸稈易降解與底物的成分組成和結構有關,濾紙是純纖維素,暴露的表面積大,則纖維素的吸附可及度就大,所以濾紙降解得快,而天然秸稈中的纖維素包埋在木質素和半纖維素中,纖維素降解菌很難吸附到纖維素的表面,致使纖維素降解的難度有所增加.秸稈經過預處理以后,纖維素與木質素產生了剝離,氫鍵也被打開,纖維素充分暴露出來,但是其失重率卻降低了,這可能有兩方面的原因:一方面可能是秸稈預處理過程中產生的乙酸、糠醛、小分子酚類等副產物對混合菌群中的某些菌種有毒性作用[15],破壞了菌群微生物之間的協同作用;另一方面,自然界中瘤胃微生物降解的都是未經過預處理的自然形態的纖維素,所以,其協同作用的機制在降解自然形態的木質纖維素時能得到更充分的發揮.
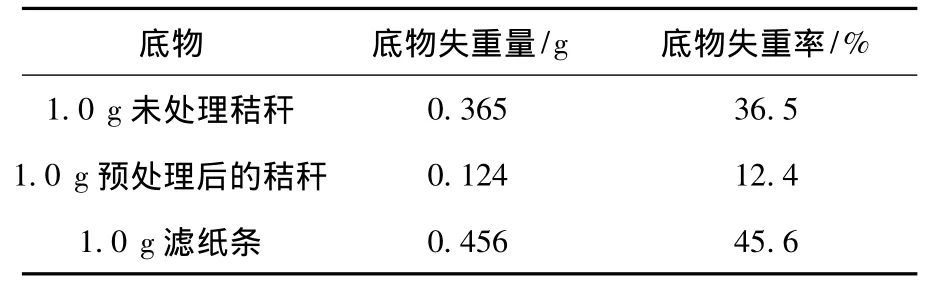
表1 FYG-2混合菌群降解不同纖維素類物質實驗
2.2.2 FYG-2混合菌群的酶活與產酶時間的關系
在接菌量為10%,FYG-2混合菌群纖維素酶活隨時間的變化如圖3所示,在培養的前3天酶活一直處于上升趨勢,在第3天時達到最高為126 IU,而在濾紙已經完全崩解的第5天,纖維素酶活卻已經降到111 IU,此時發酵液的含糖量卻最高達到了50 mg/L.從圖3還可以看出,第3天和第4天的酶活保持相對穩定,說明此時混合菌群中纖維素降解菌是優勢菌群.所以,做為種子液時,以第3、4天的培養物為宜,而將纖維素的分解產物作為其他用途的底物時,以第5天的培養物為宜.

圖3 FYG-2酶活與產酶時間的關系
2.2.3 FYG-2混合菌群纖維素酶活與初始接菌比例之間的關系
在不同初始接菌量時,培養3 d,FYG-2混合菌群的酶活和溶液的葡萄糖質量濃度變化如圖4所示.可以看出,FYG-2的酶活和糖化率不與初始接菌量成正比.在初始接菌量為15%時,FYG-2的酶活最高,而當初始接菌量增加到50%時,其酶活降低了一半,但是反應體系中的葡萄糖質量濃度卻提高了一倍多.
纖維素酶是一種反饋抑制酶,其酶活受到產物的反饋抑制.當初始接菌量從10%提高到15%,培養液中的含糖量和酶活都在上升,說明接種量增加,產酶量也在增加,而酶解產生的糖質量濃度也不足以產生反饋抑制.但是當初始接種量增加到20%,酶量增加,但是酶解產生的糖質量濃度也在增加,此時的糖質量濃度已經可以對纖維素酶產生很大的反饋抑制作用,所以酶活降低.而接種量在20%~40%是一個產糖和反饋抑制的平衡階段,酶活和產糖量都不會有太大變化.但是當初始接種量足夠大(達到50%),糖化速度會比較快,糖質量濃度會在短時間內快速增加,同時反饋作用也會使酶活迅速降低.因此,可以依據不同的目的,選擇初始接種量.

圖4 FYG-2酶活與初始接菌比例之間的關系
2.2.4 混合菌群微生物間的協同作用
采用厭氧平板劃線分離的方法,從FYG-2中分離到7株純菌,分別命名為F1、F2、F3、F4、F5、F6、F7.將這7株菌和FYG-2分別單獨接入以纖維素為唯一碳源的篩選培養基.接入純菌的樣品,纖維素底物未見明顯降解.培養3 d后,分別測定各個菌株和FYG-2的酶活,結果如圖5所示.可以看出,各個單菌的纖維素酶活遠遠小于混合菌群.這表明FYG-2中微生物間存在強烈的協同作用.這種協同作用可能包括纖維素降解菌之間[16]、纖維素降解菌與非纖維素降解菌之間[17]和可培養微生物與不可培養微生物間的協同作用[18].

圖5 FYG-2中純培養微生物與混菌酶活的對比
限于目前的微生物分離技術的局限性,自然環境中可分離培養的微生物種類只占該環境下微生物種類總數的0.1% ~10%[19],不能檢測那些尚未能培養的微生物,不能很好地反映自然環境中微生物多樣性的原始狀態.即便對于可分離培養的微生物,雖然經過多次分離純化,獲得的菌株也存在偶然性.本研究采用以纖維素為唯一碳源的限制性分離方法,獲得的菌株均為纖維素降解菌,無法獲得非纖維素降解菌和不可培養菌.從現有獲得的7株純菌無論單獨還是混合都未得到好的纖維素降解結果來看,混合菌群中的協同作用很可能存在于纖維素降解菌與非纖維素降解菌之間或存在于可培養微生物與不可培養微生物間,因此,很難通過人工分離再復配的方式獲得該菌群的功能.關于此混合菌群協同作用的進一步研究,將另作報道.
2.3 FYG-2混合菌群與其他文獻中報道的混合菌群的比較
國內外學者已經從不同的篩選源中,采用不同的限制培養方法,構建和篩選出一些具有不同功能的纖維素降解混合菌群,選出幾個效果比較好的菌群MC[18]、MC1[20]、WSC-6[21]、PCS-S[22]和本研究篩選出的FYG-2進行了比較(表2).在5個纖維素降解混合菌群中,FYG-2的纖維素酶活最高,水解液中的還原糖質量濃度也最高,這可能與厭氧微生物對糖的代謝速度慢有關.除了MC,FYG-2的濾紙失重量與其他幾個菌群不相上下,表明FYG-2對纖維素的降解速度與其他菌群相當.但是FYG-2分解纖維素時的作用溫度卻是最低的,這有利于FYG-2與其他利用纖維素的分解產物產電、產乙醇等微生物的復配,是FYG-2不可比擬的優勢.

表2 各纖維素降解混合菌群的比較
3 結論
1)獲得了高效穩定的纖維素厭氧降解混合菌群,命名為FYG-2.該菌群可以在5 d內使1 g的濾紙完全崩解.經過30代以上的傳代培養,其降解性能仍保持穩定.且纖維素底物的滅菌與否不影響失重率.
2)FYG-2對不同類型的纖維素底物降解的難易順序為濾紙>未處理的秸稈>預處理后的秸稈,混合菌群更適合于降解天然木質纖維素.
3)FYG-2混合菌群具有高效且性能穩定的酶活.培養第3天纖維素酶活最高,初始接種量為15%可以獲得最高纖維素酶活.
4)FYG-2中微生物間存在強烈的協同作用,這種協同作用很可能存在于纖維素降解菌與非纖維素降解菌之間或存在于可培養微生物與不可培養微生物間.
5)FYG-2對纖維素的分解速度與其他文獻報道的混合菌群相當,但是作用溫度較低,有利于和其他微生物復配進行纖維素資源化的研究.
[1]RAGAUSKAS A J,WILLIAMS C K,DAVISON B H,et al.The path forward for biofuels and biomaterials[J]. Science,2006,311:484-489.
[2]郭德憲,曹健,鮑宇茹.利用生物技術降解纖維素的研究進展[J].鄭州工程學院學報,2001,22(3):84 -85.
[3]COYLE W.The future of biofuels:a global perspective[J].Amber Waves,2007,5:24-29.
[4]WYMAN C E.Potential synergies and challenges in refining cellulosic biomass to fuels,chemicals,and power[J].Biotechnol Prog,2003,19:254-262.
[5]邢啟明,孫啟忠,高鳳芹.木質纖維素類物質生產燃料乙醇的研究進展[J].中國農業科技導報,2008,10 (S1):41-44.
[6]SREENATH H K,JEFFRIES T W.Production of ethanol from wood hydrolyzate by yeasts[J].Bioresource Tech,2000,72:253-260.
[7]RISMANI-YAZDI H,CHRISTY A D,DEHORITY B A,et al.Electricity generation from cellulose by rumen microorganisms in microbial fuel cells[J].Biotechnology and Bioengineering,2007,97(6):1398-1407.
[8]WANG Xin,FENG Yujie,WANG Heming,et al.Bioaugmentation for electricity generation from corn stover biomass using microbial fuel cells[J].Environ Sci Technol,2009,43(15):6088-6093.
[9]REN Zhiyong,WARD T,REGAN J.Electricity production from cellulose in a microbial fuel cell using a defined binary culture[J].Environ Sci Technol,2007,41:4781 -4786.
[10]REN Nanqi,CAO Guangli,WANG Aijie,et al.Dark fermentation of xylose and glucose mix using isolated Thermoanaerobacterium thermosaccharolyticum W16[J].International Journal of Hydrogen Energy,2008,33:6124-6132.
[11]王夢芝,徐愛秋,李世霞,等.瘤胃微生物對纖維素類物質降解的研究[J].飼料工業,2007,28(14):53-57.
[12]李冬梅,馮玉杰,任南琪.纖維素類物質生產燃料酒精的研究進展[C]//第八次全國環境微生物學術研討會論文集.北京:化學工業出版社,2005:40-47.
[13]UPDEGRAFF D M.Semimicro determination of cellulose in biological materials[J].Analytical Biochemistry,1969,32:420-424.
[14]趙玉華,楊瑞紅,王加啟.瘤胃微生物甲烷生成的機理與調控[J].微生物學雜志,2005,25(5):68 -73.
[15]PANAGIOTOU G,OLSSON L.Effect of compounds released during pretreatment of wheat straw on microbial growth and enzymatic hydrolysis rates[J].Biotechnol Bioeng,2007,96:250-258.
[16]馮玉杰,李冬梅,任南琪.混合菌群用于纖維素糖化和燃料酒精發酵的試驗研究[J].太陽能學報,2007,4:375-379.
[17]KATO S,HARUTA S,CUI Zongjun,et al.Effective cellulose degradation by a mixed-culture system composed of a cellulolytic Clostridium and aerobic noncellulolytic bacteria[J].FEMS Microbiology Ecology,2004,51:133-142.
[18]HARUTA S,CUI Zongjun,HUANG Z,et al.Construction of a stable microbial community with high cellulose -degradation ability[J].Apply Microbiol Biotechnol,2002,59:529-534.
[19]MUYZER G,WALL E C D,UITTERLINDEN A G. Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reactiorr amplified genes coding for 16S rDNA[J].Appl Environ Microbiol,1993,59:695-700.
[20]崔宗均,李美丹,樸哲,等.一組高效穩定纖維素分解菌復合系MC1的篩選及功能[J].環境科學,2002,23(3):36-39.
[21]王偉東,王小芬,高麗娟,等.高效穩定纖維素分解菌復合系WSC-6的篩選及其功能[J].黑龍江八一農墾大學學報,2005,17(3):14-17.
[22]FENG Yujie,YU Yanling,WANG Chengwu,et al.Selection of microbial community with high cellulosedegradation ability and its characteristics[C]//Bioinformatics and Biomedical Engineering ICBBE.Wuhan: ICBBE,2008:4218-4221.

