大腸埃希菌臨床株Dr粘附素的檢測(cè)及其序列分析
劉世花,劉德夢(mèng),趙慶英,宮艷格
(天津醫(yī)科大學(xué)第二醫(yī)院感染性疾病研究所,天津300211)
大腸埃希菌是臨床上最常見(jiàn)的致病菌,致病因素復(fù)雜,而粘附素是其主要致病因素之一。其中Afa/Dr家族粘附素是大腸埃希菌的主要粘附素之一,它主要表達(dá)于腸道彌漫粘附性大腸埃希菌和尿道致病性大腸埃希菌。而Dr粘附素又是該家族粘附素中的一個(gè)重要成員,與30%~50%膀胱炎、50%兒童慢性腹瀉、30%孕婦腎盂腎炎及青年女性復(fù)發(fā)性泌尿系統(tǒng)感染密切相關(guān),攜帶Dr粘附素的大腸埃希菌有形成慢性和復(fù)發(fā)性感染的傾向[1]。目前,我國(guó)缺乏對(duì)Afa/Dr家族粘附素的研究。本實(shí)驗(yàn)通過(guò)擴(kuò)增大腸埃希菌該家族粘附素的共有序列afa/draC及Dr粘附素的特異序列draE,從而了解該家族粘附素及Dr粘附素在大腸埃希菌臨床株中的攜帶情況及編碼粘附蛋白draE基因的突變情況。
1 材料和方法
1.1 菌株來(lái)源 600株大腸埃希菌分離自天津市某醫(yī)院患者送檢的各種標(biāo)本,剔除重復(fù)菌株,其中261株來(lái)自泌尿系感染患者的尿,244株來(lái)自急性腹瀉患者的便,22株來(lái)自呼吸道痰標(biāo)本,其他73株來(lái)自其它部位(外傷分泌物、血、腹水)。
陽(yáng)性對(duì)照菌株AAEC191A(pCC90)由美國(guó)華盛頓大學(xué)Steve Moseley教授惠贈(zèng)。陰性對(duì)照菌株為國(guó)際通用無(wú)菌毛代表菌株E.coli K-12p678-54菌株,由英國(guó)伯明翰大學(xué)兒童保健中心Stuart Knutton教授惠贈(zèng)。
1.2 主要儀器 PCR擴(kuò)增儀533244249(德國(guó)Eppendorf公司)、thermo-mixer恒溫震蕩儀(德國(guó)Eppendorf公司)、離心機(jī)5415D(德國(guó)Eppendorf公司)、DYY-6D型電泳儀和水平電泳槽(北京六一儀器廠)、GELDOC-200型凝膠成像系統(tǒng)(美國(guó)BIORAD公司)
1.3 主要試劑 Premix(PerfectShotTMTaq)、DNA marker DL 2000購(gòu)自大連寶生物TaKaRa生物工程公司,引物由上海生物工程公司合成,序列分別為:
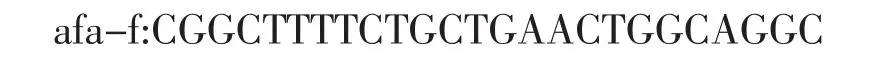

兩對(duì)引物擴(kuò)增的目的基因分別為Afa/Dr家族粘附素的afa/draC及draE基因片段,長(zhǎng)度大小分別為672bp、484bp。
1.4 DNA提取 參照Pitout[2]方法提取細(xì)菌總DNA。95℃水浴加熱10min,以11000r/min速度離心10min,小心吸取上清液保存,作為PCR模板。
1.5 PCR擴(kuò)增afa/draC和draE基因 反應(yīng)體系:50μL,含Premix(PerfectShotTMTaq)25μL,上下游引物各2μL,DNA模板4μL,去離子水17μL。
反應(yīng)條件:afa/draC:預(yù)變性94℃4min,變性94℃45s,退火53℃30s,延伸72℃1min,共30個(gè)循環(huán),末次循環(huán)延伸72℃8min。
draE:預(yù)變性94℃4min,變性94℃30s,退火54℃30s,延伸72℃45s,共30個(gè)循環(huán),末次循環(huán)延伸72℃8min。
PCR產(chǎn)物分析:取6μL PCR產(chǎn)物,在含0.5mg/L溴化乙啶的1%瓊脂糖凝膠中電泳30min。使用BIO-RAD凝膠成像系統(tǒng)觀察結(jié)果,分析PCR產(chǎn)物。如果出現(xiàn)特異性擴(kuò)增條帶可能為陽(yáng)性菌株。
1.6 DNA序列測(cè)序及分析 PCR擴(kuò)增產(chǎn)物送上海英駿生物公司進(jìn)行正負(fù)雙向DNA測(cè)序。測(cè)序結(jié)果與genebank中的標(biāo)準(zhǔn)序列進(jìn)行比對(duì),應(yīng)用DNAstar軟件將draE的DNA測(cè)序結(jié)果轉(zhuǎn)化為氨基酸序列后與陽(yáng)性對(duì)照株pCC90所對(duì)應(yīng)的氨基酸序列進(jìn)行比對(duì)分析。
2 結(jié)果
2.1 Afa/Dr家族粘附素的攜帶率 600株大腸埃希菌中402株afa/draC基因陽(yáng)性,陽(yáng)性率為67.0%。其中分離自尿的大腸埃希菌261株中186株陽(yáng)性,陽(yáng)性率71.3%;分離自便的大腸埃希菌244株中169株陽(yáng)性,陽(yáng)性率為69.3%;其余47株陽(yáng)性菌株分別來(lái)自痰和其他分泌物。PCR擴(kuò)增afa/draC基因電泳結(jié)果見(jiàn)圖1。

圖1 大腸埃希菌臨床株afa/draC基因片段的PCR擴(kuò)增產(chǎn)物電泳圖Fig1 PCR amplification of afa/draC in E.coli clinical strainsM.DL2000DNA Marker;1.陽(yáng)性對(duì)照;2.100;3、4、5.實(shí)驗(yàn)中的陰性菌株;6. B1683;7.陰性對(duì)照;8.空白對(duì)照
2.2 draE基因的擴(kuò)增及序列分析 402株攜帶Afa/Dr家族粘附素的大腸埃希菌3株經(jīng)PCR檢測(cè)出現(xiàn)484bp的預(yù)期條帶,PCR擴(kuò)增draE基因電泳結(jié)果見(jiàn)圖2。PCR產(chǎn)物送上海英俊生物公司進(jìn)行測(cè)序。結(jié)果與genebank AF329316的基因序列進(jìn)行比對(duì),發(fā)現(xiàn)陽(yáng)性對(duì)照株pCC90的該段基因序列與genebank所示完全一致;3株臨床分離株的draE基因序列與陽(yáng)性對(duì)照株pCC90對(duì)比具有高度同源性(大于99%),其中分別存在1~3處堿基的缺失或插入,分別在第10、第42、第436、第475位點(diǎn)堿基的缺失及第7~8、第479~480位點(diǎn)之間堿基的插入,其詳細(xì)突變情況見(jiàn)表1。應(yīng)用DNAstar軟件將上述DNA測(cè)序結(jié)果轉(zhuǎn)化為氨基酸序列后與陽(yáng)性對(duì)照株pCC90所對(duì)應(yīng)的氨基酸序列進(jìn)行比對(duì),結(jié)果顯示同源性均為100%。

圖2 大腸埃希菌臨床株draE基因片段的PCR擴(kuò)增產(chǎn)物電泳圖Fig.2 PCR amplification of draE in E.coli clinical strains M.DL2000DNA Marker;1.陽(yáng)性對(duì)照;2.100;3.321;4.B1683;5.陰性對(duì)照

表1 3個(gè)陽(yáng)性菌株draE基因序列突變位點(diǎn)Tab 1 The mutations of draE in three positive bacterias
2.3 Dr粘附素的攜帶率 600株大腸埃希菌中3株(0.5%)攜帶draE基因,占Afa/Dr家族粘附素的0.75%。其中1株分離自泌尿道,另2株分離自消化道急性腹瀉患者的糞便。
3 討論
大腸埃希菌是目前醫(yī)院感染中最主要的病原菌之一,而抗菌藥物的廣泛使用使得細(xì)菌的耐藥日益嚴(yán)重,重癥感染者單用敏感抗生素往往不能改善病情進(jìn)展。隨著人們對(duì)細(xì)菌致病機(jī)制的研究,毒力因子將成為抗感染治療的新靶位[4]。大腸埃希菌的毒力因子主要包括粘附素、毒素、外膜蛋白、鐵轉(zhuǎn)運(yùn)系統(tǒng)等。其中粘附素是借助粘附激活被粘附細(xì)胞的信號(hào)傳導(dǎo)系統(tǒng),使其不同程度釋放不同種類(lèi)的細(xì)胞因子,導(dǎo)致炎性反應(yīng)性損傷;而某些粘附因子與受體作用,激活細(xì)胞凋亡控制系統(tǒng),引起細(xì)胞凋亡。炎癥損傷和細(xì)胞凋亡有利于細(xì)菌生長(zhǎng)、繁殖和擴(kuò)散。
目前發(fā)現(xiàn)大腸埃希菌重要粘附素之一Afa/Dr家族粘附素包括13種亞型,基因結(jié)構(gòu)主要由afa/ draA、afa/draB、afa/draC、afa/draD、afa/draE 5個(gè)基因片段組成,A~D基因片段具有相對(duì)高的保守性,而編碼粘附蛋白E基因片段具有高度的變異性。其中C基因編碼引導(dǎo)蛋白,與周漿蛋白一起輔助粘附蛋白到達(dá)細(xì)菌表面;E基因編碼粘附蛋白,二者是細(xì)菌粘附于細(xì)胞的關(guān)鍵結(jié)構(gòu),C基因和E基因的某些突變可以使引導(dǎo)蛋白或粘附蛋白的結(jié)構(gòu)和功能發(fā)生改變。
本研究通過(guò)Afa/Dr家族粘附素共有序列afa/ draC及Dr粘附素的特異序列draE基因PCR檢測(cè)、序列分析,對(duì)600株大腸埃希菌臨床株該家族粘附素及Dr粘附素的攜帶率進(jìn)行了分析。研究結(jié)果顯示,402株攜帶Afa/Dr家族粘附素,陽(yáng)性率為67.0%;其中分離自泌尿道、消化道的大腸埃希菌afa/draC基因陽(yáng)性率分別為71.3%、69.3%,說(shuō)明Afa/Dr家族粘附素是泌尿道感染、急性腹瀉相關(guān)大腸埃希菌的一個(gè)主要的粘附素。在402株攜帶Afa/Dr家族粘附素的大腸埃希菌中,3株攜帶Dr粘附素,占家族粘附素的0.75%。2007年美國(guó)學(xué)者Natalia[5]對(duì)美國(guó)華盛頓某醫(yī)院的大腸埃希菌Dr粘附素的檢測(cè)發(fā)現(xiàn)其占家族粘附素的25%,遠(yuǎn)遠(yuǎn)高于本實(shí)驗(yàn)結(jié)果,這可能是由于地區(qū)差異和實(shí)驗(yàn)菌株的來(lái)源不同導(dǎo)致的,國(guó)外研究的實(shí)驗(yàn)菌株主要分離自復(fù)發(fā)性尿路感染和慢性腎盂腎炎患者,而本實(shí)驗(yàn)菌株主要分離自膀胱炎及急性腹瀉患者。以往的研究顯示Dr粘附素在尿道致病性大腸埃希菌中檢出率最高,DraE陽(yáng)性的大腸埃希菌結(jié)合于分化完全的膀胱上皮細(xì)胞,而本研究中3株draE陽(yáng)性的大腸埃希菌僅有1株分離自泌尿系統(tǒng),另2株都分離自消化道,其具體作用機(jī)制及這3株菌是否具有同源性有待進(jìn)一步研究。
在泌尿系感染和腹瀉的發(fā)生過(guò)程中,Dr粘附素與Ⅳ型膠原的識(shí)別起到關(guān)鍵作用,而draE基因編碼粘附蛋白通過(guò)周漿伴侶途徑分泌至細(xì)菌表面[6],是細(xì)菌粘附于細(xì)胞的關(guān)鍵結(jié)構(gòu)。點(diǎn)特異性突變實(shí)驗(yàn)表明,DraE的第54個(gè)氨基酸必需帶有負(fù)電荷才有氯霉素敏感的受體結(jié)合特點(diǎn),氨基酸序列在第32、40、54、90和113位點(diǎn)上突變會(huì)改變粘附素的粘附能力和氯霉素敏感特性,使得Dr粘附素不能與Ⅳ型膠原結(jié)合[7]。本實(shí)驗(yàn)draE基因陽(yáng)性的3株大腸埃希菌,PCR擴(kuò)增后進(jìn)行測(cè)序,與genebank比對(duì)顯示:與陽(yáng)性對(duì)照株pCC90對(duì)比具有高度同源性,所測(cè)菌株均存在1~3個(gè)點(diǎn)突變,進(jìn)行氨基酸比對(duì)顯示與陽(yáng)性對(duì)照株pCC90的同源性均為100%。說(shuō)明本實(shí)驗(yàn)檢測(cè)出的陽(yáng)性菌株在致病過(guò)程中Dr粘附素起著很重要的作用。
總之,Dr粘附素在尿道致病性大腸埃希菌和腹瀉相關(guān)性大腸埃希菌的致病過(guò)程中具有重要作用。目前粘附素及其受體的結(jié)構(gòu)研究仍是國(guó)內(nèi)外研究的熱點(diǎn),本實(shí)驗(yàn)為進(jìn)一步研究Dr粘附素提供基礎(chǔ),筆者可以進(jìn)一步對(duì)DraE蛋白進(jìn)行克隆表達(dá)研制相應(yīng)的疫苗,從而使粘附素成為抗感染治療的新靶位,降低大腸埃希菌的致病作用。
[1] Germani Y,Béaud E,Duval P,et al.Prevalence ofenteropathogenic, enteroaggregative,and diffusely adherent Escherichia coliamongiso lates from children with diarrhea in New Caledonia[J].Infect Dis, 1996,174(5):1124
[2] Pitout J,Thmoson K,Hanson N,et al.Plasmid-mediated resistance to expanded-spectrum cephalosporins among enterobacter aerogenes strains[J].Antimicrob Agent Chemother,1998,42(3):596
[3] Jouve M,Garcia MI,Courcoux P,et al.Adhesion to and invasion of HeLa cells by pathogenic Escherichia coli carrying the afa-3gene cluster are mediated bythe AfaE and AfaDproteins,respectively[J]. Infect Immun,1997,65(10):4082
[4] Clatworthy AE,Pierson E,Hung DT.Targeting virulence:a new paradigmforantimicrobialtherapy[J].NatChemBiol,2007,3(9):541
[5] Natalia K.Selection for functional diversity drives accumulation of point mutations in Dr adhesins of Escherichia coli[J].Mol Microbiol,2007,64(1):180
[6] Servin AL.Pathogenesis of Afa/Dr diffusely adhering Escherichia coli[J].Clin Microbiol Rev,2005,18(2):264
[7] CarnoyC,MoseleySL.Mutational analysis ofreceptor bindingmediated bythe Dr familyofEscherichia coli adhesins[J].Mol Microbiol, 1997,23(2):365

