藻藍蛋白介導光動力療法在乳腺癌治療中的機制研究
李 冰,褚現明,高美華,徐穎婕
(青島大學醫學院1.生物學教研室,山東 青島 266021;2.附屬醫院心內科,山東 青島 266101;3.免疫學教研室,山東青島 266021)
光動力學療法是一種微創性治療手段[1-2]。隨著光敏物質、光激活裝置和導光系統的發展和進步,該療法已逐步成為腫瘤的基本治療手段之一。光動力學療法的治癌機制主要是由于癌細胞能特異性攝取一種叫光敏劑的物質。光敏劑被癌細胞攝取后,能較長時間留在癌細胞內。光敏劑經一種特殊波長的光(常用630nm的激光)照射后,產生一種具有毒性作用的活性態氧離子,從而破壞癌細胞。所以光敏劑的選擇至關重要,目前選擇開發安全無毒的新型光敏劑成為研究的重點[3-4]。
藻藍蛋白(C-phycocyanin,C-PC)是一種存在于鈍頂螺旋藻細胞內的光合色素,能高效捕獲光能。由肽鏈上共價結合1個開鏈的四吡咯環輔基構成,類似動物紅細胞的血紅素結構。因其水溶性、安全無毒、清亮且著色力強等優點,藻藍蛋白被廣泛用于食品著色劑和化妝品的添加劑。另外藻藍蛋白具有一定的醫療價值,具有改善血脂代謝、抗衰老、抗氧化、抗輻射、抗疲勞、抑制腫瘤和提高機體免疫力等作用[5]。蔡心涵等[6]用螺旋藻藻藍蛋白對 S180移植瘤和人大腸癌細胞進行體內外激光治癌實驗,但對作用機制研究甚少,本研究選擇藻藍蛋白作為光敏劑,對其介導的光動力學療法治療小鼠乳腺癌的免疫和凋亡機制進行探討。
1 材料
1.1 實驗動物BALB/C純系小鼠40只,♀♂各半,體質量20~22 g,購自北京大學醫學部動物房。
1.2 細胞MCF-7細胞(本實驗室保種)。
1.3 激光器HNZSQ-型氦氖激光照射器(上海醫用激光儀器廠)
1.4 光敏劑藻藍蛋白。由本實驗室從鈍頂螺旋藻粉中提取純化,純度為A620/A280=4.71。
1.5 其它試劑4%多聚甲醛(PFA)、3%檸檬酸、2×SSC、DMEM培養液(美國Gibco公司);胰酶(購自Amersco公司);Poly-L-Lysine、DEPC、CD44 原位雜交試劑盒、Fas免疫組化試劑盒、兔抗人P53/NFkB單克隆抗體(武漢博士德生物工程有限公司)。
2 方法
2.1 動物模型建立和分組小鼠在左側肋緣皮下脾區接種MCF-7細胞0.2 ml(約1×105個細胞),24 h后隨機分成3組:(1)對照組:15只小鼠,植瘤后不照激光不加藻藍蛋白;(2)激光照射組:15只小鼠,植瘤24 h后進行He-Ne激光照射;(3)藻藍蛋白處理組:15只小鼠,注入2ml藻藍蛋白液(320 g·L-1);(4)藻藍蛋白+激光照射組:15只小鼠,注射2ml藻藍蛋白液(320 g·L-1),2 h后給予激光照射。
照射時需固定小鼠,去毛并充分暴露瘤體,采用24 mW He-Ne激光照射器照射瘤區,激光光纖輸出電流10 mA,光纖頭距離瘤體中心50 cm,光斑直徑2 cm,每天照射10 min,照射10 d為一療程。
2.2 組織的采集、石蠟包埋和切片的制作
2.2.1 組織的收集和處理 4~5 d長出腫塊,實驗d11乙醚麻醉小鼠后斷頸處死,置于75%乙醇溶液中消毒5 min。剖開小鼠腹腔取出胸腺和脾臟,并分離皮內瘤塊,將以上組織去除包膜,稱瘤塊重量并計算每組小鼠的腫瘤形成率(成瘤率/%=每組中有腫瘤形成的小鼠數量/每組小鼠的數量×100%)。
取腫瘤組織切成0.5 cm×0.5 cm×0.5 cm大小,分別置于盛有10%甲醛(DEPC處理)的小瓶中,4℃固定。余下組織經針栓研磨,200目篩絹過濾,制成細胞懸液。
2.2.2 載玻片、器皿和儀器的處理 配制1∶10的多聚賴氨酸于塑料容器中,每批載玻片泡5 min。所有載玻片、器皿和儀器均需浸泡在DEPC中做除RNA酶處理。
2.2.3 常規石蠟切片的制備
2.3 免疫細胞免疫活性的監測
2.3.1 各組中NK細胞活性的比較 取脾細胞5×106作為效應細胞(NK細胞),K562細胞5×105(靶細胞),效 ∶靶為10 ∶1。取效、靶細胞各100 μl加入96 孔板,各孔加 MTT 10 μl(5 g·L-1),置 37℃5%CO2培養箱孵育 4 h,離心 1500 r·min-1,吸去上清,每孔加入二甲基亞砜150 μl,振蕩10 min,570 nm波長測OD值。NK活性/%=[實驗孔(效靶)OD值-效應細胞孔OD值]/靶細胞對照孔OD值×100%。
2.3.2 各組中T細胞增殖活性比較 采用MTT還原分析法。將胸腺制成細胞懸液,用RPMI 1640營養液洗3 次,將細胞配成5 ×109·L-1,取100 μl(含5×105/細胞)細胞加入96孔培養板中,每孔加入ConA 20 μl(濃度 25 mg·L-1),37℃ 5%CO2培養箱中培養48 h,收獲前 5 h 參入 MTT 50 μg·孔-1,培養結束時,低溫離心1 000 r·min-1,棄上清,加入二甲亞砜150 μl,振蕩10 min,490 nm 處測 OD 值,作為T細胞的增殖活性。
2.4 免疫組化法檢測各組中腫瘤細胞表面Fas、NF-κB、p53蛋白表達的比較實驗步驟按試劑說明書。切片常規脫蠟至水,滅活內源性過氧化物酶,熱修復抗原,DAB顯色,蘇木精輕度復染,脫水、透明,中性樹膠封片。免疫組化染色胞質或(和)胞膜棕黃色為陽性結果。參照Frormowitz的方法,隨機選取5個高倍視野(×400),首先根據陽性細胞所占的百分比記分,陽性細胞數<5%為0分,5% ~25%為1分,26% ~50%為2分,51% ~75%為3分,76% ~100%為4分。再根據陽性細胞顯色強度記分:無著色為0分,輕度色為1分,中度染色為2分,重度染色為3分,兩者得分之和即為陽性蛋白表達,其中0~1分為陰性(-),2~3分為弱陽性(+),4~5分為中等陽性(),6~7分為強陽性()。
2.5 原位核酸雜交法檢測各組中腫瘤細胞CD44mRNA表達的比較具體步驟參照CD44原位雜交試劑盒說明書進行。由上海博亞生物公司合成針對CD59cDNA的寡核苷酸探針。探針序列為5'-AAGTGTTGGAAGCATGAGCAGTGCAATT-3',5'經地高辛標記。石蠟切片經常規脫蠟至水,滅活內源性酶,DAB顯色,蘇木精復染,充分水洗。乙醇脫水,二甲苯透明,封片,鏡檢。
2.6 MCF-7細胞增殖活性檢測采用 MTT法。將MCF-7細胞制成細胞懸液,用RPMI 1640營養液洗3 次,將細胞配成5 ×108·L-1,取100 μl加入96孔培養板中。培養24 h后更換新鮮培養液,細胞分成4組:對照組,激光照射組(細胞每天接受激光照射2 min),藻藍蛋白處理組(加入80 mg·L-1的藻藍蛋白液),光動力學治療組(加入80 mg·L-1的藻藍蛋白液兩小時后激光照射2 min)。37℃ 5%CO2培養箱中培養72 h,收獲前5 h加入20 μl/孔 MTT(5 g·L-1),培養結束時,低溫離心1 000 r·min-1,棄上清,加入二甲亞砜100 μl/孔,輕微振蕩10 min使甲臜結晶充分溶解,用酶標儀測定490 nm處的光密度(OD490)。
2.7 電鏡形態學觀察不同組的MCF-7細胞分別收集于EP管中,PBS洗滌兩次。1500 r·min-14℃離心10 min,細胞沉淀用PBS洗兩次,將細胞懸浮于2.5%戊二醛中固定30 min,再用PBS洗兩次、將細胞懸浮于1%鋨酸中固定1 h、以丙酮梯度脫水、在將細胞置于丙酮∶包埋劑(1∶1)中置換30 min、用單包埋劑浸泡2 h,離心收集細胞,按常規將細胞包埋、切片、雙重染色,用透射電子顯微鏡觀察細胞形態。
2.8 細胞色素C釋放試驗分別取4組細胞少量置于EP管中,pH7.4 0.01 mol·L-1PBS洗滌兩次。細胞涂片,吹干。95%乙醇固定5 min,待干加入FITC-抗人細胞色素C約每孔5 μl,對照孔加小鼠IgG 約5 μl,置濕盒中,37℃ 45 min。PBS 洗滌3 次,干后鏡檢。陰性對照組,用PBS代替一抗。
2.9 統計學分析結果以±s表示,以SPSS軟件分析,t檢驗確定差異顯著性。
3 結果
3.1 各組小鼠瘤塊重量和腫瘤形成率的比較Tab 1和Fig 1、2顯示,與對照組相比較,激光組中瘤塊體積、重量和腫瘤形成率無變化(P>0.05),而藻藍蛋白處理組中明顯降低(P<0.05),PDT組與對照組比較,差異有顯著性(P<0.01)。PDT組與藻藍蛋白處理組比較,P<0.05。這說明CPC具有抗腫瘤的作用,而在輔助He-Ne激光作用后,這種作用效果更加明顯。
3.2 各組中NK細胞活性比較由Tab 2可見,與對照組相比,單獨激光照射對NK細胞活性影響不大(P>0.05),而C-PC具有增強NK細胞活性的作用,與對照組相比較,P<0.05,差異有顯著性。而PDT組與對照組比較,差異有顯著性(P<0.01)。PDT組與藻藍蛋白處理組比較,P<0.05。這表明激光能夠增強藻藍蛋白對NK細胞的活化作用。
3.3 各組小鼠T細胞增殖活性的比較Fig 3表明,與對照組相比,He-Ne激光照射組無明顯變化(P>0.05)。而藻藍蛋白處理組中荷瘤小鼠胸腺T細胞增殖活性明顯增強,與對照組相比,P<0.05,差異明顯。而光動力學治療組差異更為顯著,P<0.01。PDT組與藻藍蛋白處理組比較,P<0.05。由此證明CPC具有增強T細胞活性的功能,而激光可強化這一功能。

Tab 1 Comparision of tumor weight of four groups of mice

Fig 1 Comparision of tumor volume of four groups of mice
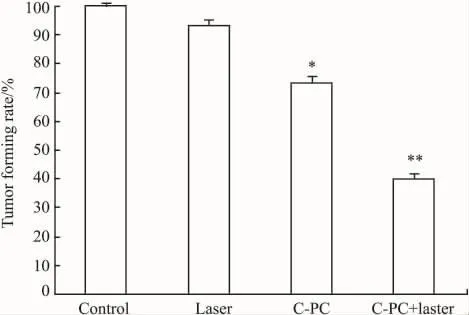
Fig 2 Comparision of tumor forming rate of four groups of mice

Tab 2 Comparision of NK cell activities of four groups of mice(n=15)

Fig 3 Comparision of the proliferative activity of T cells of four groups of mice
3.4 各組中腫瘤細胞Fas基因表達的比較Tab 3顯示,激光照射組腫瘤細胞中Fas蛋白的陽性表達率為53.33%,與對照組差異無顯著性(P>0.05),而藻藍蛋白處理組明顯高于對照組(66.67%),P<0.05,有統計學意義。而PDT組中Fas的陽性表達率為80%,明顯高于其在其它3組中的表達,P<0.01。Fig 3顯示藻藍蛋白處理組腫瘤組織中Fas的陽性表達量明顯高于對照組,而光動力學治療組腫瘤細胞中Fas的陽性表達量較其它3組中的表達又進一步升高。這表明藻藍蛋白對腫瘤組織中Fas的表達具有促進作用,而輔助激光照射能使促進作用更明顯。

Tab 3 Comparision of Fas protein expression in tumor cells of four groups of mice(n=15)
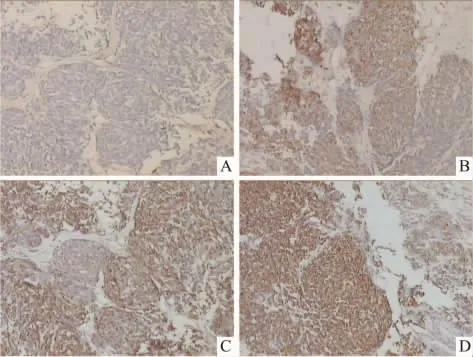
Fig 4 Comparision of Fas protein expression in tumor cells of four groups of mice
3.5 各組中腫瘤細胞中NF-κB和p53蛋白表達的比較Tab 4顯示,與對照組相比,激光照射組腫瘤組織中NF-κB和p53的陽性表達率無明顯變化(P>0.05)。而藻藍蛋白處理組腫瘤組織中NF-κB和p53的陽性表達率分別為73.33%和80%,明顯低于它們在對照組中的表達(93.33%),P<0.05,有統計學意義。而PDT組中NF-κB和p53的陽性表達率為53.33%和60%,明顯低于其在其它3組中的表達(P<0.01)。這表明藻藍蛋白具有抑制腫瘤組織中NF-κB和p53表達的作用,而激光照射能增強這種抑制作用。
3.6 各組中腫瘤細胞CD44 mRNA表達的比較Tab 5顯示,激光照射組腫瘤細胞中CD44 mRNA的陽性表達率86.67%,與對照組相比無明顯變化(P>0.05),而藻藍蛋白處理組為78.57%,明顯低于它在對照組中的表達(93.75%),P<0.05,有統計學意義。而PDT組中CD44 mRNA的陽性表達率為60%,明顯低于其在其它3組中的表達(P<0.05)。由Fig 4可見,藻藍蛋白處理組腫瘤組織中CD44 mRNA的陽性表達量明顯低于對照組,而光動力學治療組腫瘤細胞中CD44 mRNA的陽性表達量較其在對照組和激光照射組中的表達又進一步下降。這表明藻藍蛋白具有抑制腫瘤組織中CD44 mRNA表達的作用,而在激光照射的輔助下該抑制作用得到進一步提升,從而抑制腫瘤細胞的惡性增殖及其侵襲轉移能力。
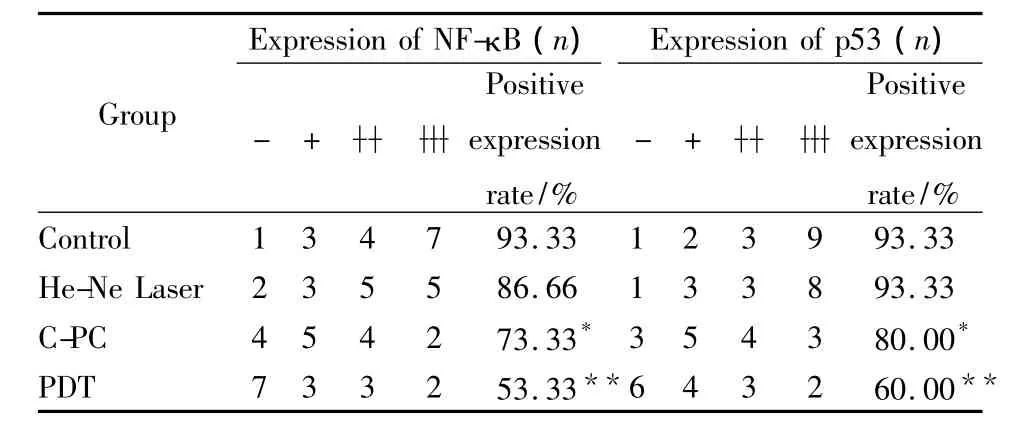
Tab 4 Comparision of NF-κB,p53 protein expression in tumor cells of four groups of mice

Tab 5 Comparision of CD44 mRNA expression in tumor cells of four groups of mice(n=15)
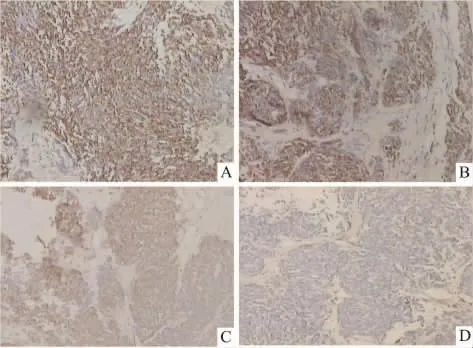
Fig 5 Comparision of CD44 mRNA expression in tumor cells of four groups of mice
3.7 MCF-7細胞增殖活性檢測Fig 6表明,與對照組相比,He-Ne激光照射組MCF-7細胞數目無明顯變化(P>0.05)。而藻藍蛋白處理組中MCF-7細胞數目明顯減少,與對照組相比(P<0.05),差異明顯。而光動力學治療組差異更為明顯(P<0.01)。由此證明藻藍蛋白具有抑制MCF-7細胞增殖的功能,而激光可強化這一功能。

Fig 6 Detection of proliferative activities of MCF-7 cells
3.8 電鏡形態學觀察Fig 7顯示藻藍蛋白處理組細胞形態發生了一系列的改變,細胞失去微絨毛,胞質濃縮,核染色質凝集,而光動力學治療組細胞變圓,染色質進一步凝集,該結果說明藻藍蛋白可能通過誘導體外 MCF-7細胞的凋亡來發揮其抗腫瘤效用,而結合激光作用后可加速細胞的凋亡進程。

Fig 7 Morphological features of three groups of MCF-7 cells
3.9 細胞色素C釋放試驗Fig 8表明,與對照組相比,He-Ne激光照射組MCF-7細胞內熒光強度無明顯變化。而藻藍蛋白處理組中MCF-7細胞中熒光強度明顯增強,而光動力學治療組中熒光強度進一步增強。由此證明藻藍蛋白具有促進MCF-7細胞中細胞色素C從線粒體向細胞質的釋放,而激光可強化這一功能。
4 討論

Fig 8 Comparision of release quantities of cytochrome C
腫瘤的形成是一種多因素、多階段、長期相互作用的過程,其機制非常復雜。近年來,有關分子腫瘤學的研究進展極為迅速,癌基因、原癌基因、抗癌基因的異常表達,造成腫瘤細胞死亡信號傳遞系統的紊亂可能是腫瘤形成的重要機制[7-11]。本研究選用對人無害的氦氖激光照射瘤細胞區,促進腫瘤死亡信號的傳遞,并提高荷瘤機體的抗腫瘤免疫力。研究結果證明:藻藍蛋白處理組瘤塊重量、腫瘤形成率均低于對照組,同時,藻藍蛋白能夠增強NK細胞的活性及T細胞的增殖活性,這表明藻藍蛋白照射確實具有抗腫瘤及提高免疫細胞活性的作用。而藻藍蛋白和激光聯合作用后,抗腫瘤免疫效應明顯增強,藻藍蛋白的光敏作用可能與藻藍蛋白的分子結構有關。藻藍蛋白屬于藻膽蛋白的一種,為一種捕光色素蛋白,具光能作用,它的載體蛋白以共價鍵形式連結著開鏈血毗咯發色團,與卟啉衍生物有類似之處。目前我國應用的光敏劑多數為血卟啉衍生物,如YHPD、癌光啉等,或葉綠素葉啉,這些光敏劑在臨床上應用時,往往存在一定的毒副作用,在治療時,患者為防止正常組織及皮膚受損而需避光一段時間,使激光治癌受到一定的限制。而藻藍蛋白從海洋生物藻藍中提取,資源豐富,且其無毒,安全,其本身已作為營養保鍵食品為人們利用,故這種光敏劑如能用于臨床,病人更易接受,具有進一步推廣應用價值。
細胞凋亡的發生作為光動力學療法治療癌癥、誘導癌細胞死亡的機制性探討也在本實驗中得到了證實。細胞凋亡是細胞受基因調控的程序性的死亡過程,Fas、p53、NF-κB 是調控細胞凋亡的相關基因,是細胞凋亡途徑中重要的信號分子[12-15]。免疫細胞上的配體FasL與Fas結合,通過激活caspase引起細胞凋亡。p53作為抑癌基因可通過控制細胞周期G1向S期移行來參與細胞周期調控。近年來發現,核轉錄因子 κB(Nuclear factor-kappa b,NF-κB)的激活可以促進腫瘤的生長,在腫瘤的治療中是研究的熱點,在腫瘤細胞中其具有調控多種基因轉錄表達的能力,與腫瘤細胞的生長、增殖和浸潤、轉移的關系密切,還能調控腫瘤細胞的凋亡和免疫活性[16]。CD44及其變異體分子參與腫瘤的發生發展和侵襲轉移,尤其是CD44V6在腫瘤侵襲轉移中的作用,它們可能是判斷腫瘤生物學行為及預后因素的重要指標[17-18]。藻藍蛋白處理后腫瘤細胞內抗凋亡基因(p53)和與腫瘤增殖轉移逃逸有關的基因(NF-κB、CD44)表達量明顯減少,而促凋亡基因(Fas)明顯增多。體外實驗也證實PDF組出現明顯的凋亡形態,MCF-7的增殖活性受到抑制,而細胞色素C的釋放量明顯增多。在藻藍蛋白和氦氖激光聯合作用的光動力學治療組中p53、NF-κB、CD44蛋白的表達量進一步增多,而Fas大大減少。MCF-7細胞的凋亡形態更為明顯,增殖活性進一步降低,而細胞色素C的釋放量進一步增多。
本實驗證明藻藍蛋白可以作為一種光敏劑,其介導的光動力學療法在宮頸癌治療中的作用機制主要是通過增強機體的免疫力,同時啟動MCF-7細胞內的凋亡信號轉導通路誘導細胞凋亡,從而達到殺死腫瘤的目的。
[1] Brown S B,Brown E A,Walker I.The present and future role of photodynamic therapy in cancer treatment[J].Lancet Oncol,2004,5(8):497-508
[2] Kwitniewski M,Juzeniene A,Ma L W,et al.Diamino acid derivatives of PpIX as potential photosensitizers for photodynamic therapy of squamous cell carcinoma and prostate cancer:in vitro studies[J].J Photochem Photobiol B,2009,94(3):214 -22.
[3] Prasad G A,Wang K K,Halling K C,et al.Correlation of histology with biomarker status after photodynamic therapy in Barrett esophagus[J].Cancer,2008,113(3):470 - 6.
[4] Nyst H J,Tan I B,Stewart F A,et al.Is photodynamic therapy a good alternative to surgery and radiotherapy in the treatment of head and neck cancer?[J]Photodiagnosis Photodyn Ther,2009,6(1):3-11.
[5] Li B,Zhang X C,Gao M H,et al.Effects of CD59 on antitumoral activities of phycocyanin from Spirulina platensis[J].Biomed Pharmacother,2005,59(10):551 -60.
[6] 蔡心涵,何立明,蔣家倫,等.螺旋藻藻藍蛋白對癌激光療法增敏作用的實驗研究[J].中國海洋藥物雜志,1995,14(1):15-9.
[6] Cai X H,He L M,Jiang J L,et al.The experimental study of application of phycocyanin in cancer laser therapy[J].Chin J Marine Drugs,1995,14(1):15 -9.
[7] Schimke R T,Mihich E.Fifth annual Pezcoller symposium:apoptosis[J].Cancer Res,1994,54(1):302 -5.
[8] 李 冰,褚現明,高美華,張學成.鈍頂螺旋藻藻藍蛋白誘導HeLa細胞凋亡的分子機制研究[J].中國藥理學通報,2009,25(8):1045-50.
[8] Li B,Chu X M,Gao M H,Zhang X C.Study on the molecular mechanism of C-phycocyanin from Spirulina platensis induced apoptosis in HeLa cells[J].Chin Pharmacol Bull,2009,25(8):1045-50.
[9] 王曉琴,王振華,劉 梅,張 波.氧化還原調控在紫檀芪誘導HeLa細胞內質網凋亡途徑中的作用[J].中國藥理學通報,2010,26(9):1184-8.
[9] Wang X Q,Wang Z H,Liu M,Zhang B.The role of redox sensing in pterostilbene-induced HeLa cell apoptosis via endoplasmic reticulum pathway[J].Chin Pharmacol Bull,2010,26(9):1184-8.
[10]張乃菊,陳天平,董淑英,等.賴氨匹林對人宮頸癌HeLa細胞的抑制作用及其機制研究[J].中國藥理學通報,2010,26(9):1212-5.
[10] Zhang N J,Chen T P,Dong S Y,et al.Inhibitory effects and mechanism research of aspisol on huran cervical cancer HeLa cells[J].Chin Pharmacol Bull,2010,26(9):1212 -5.
[11]于春艷,李洪巖,鐘加滕,等.維生素K3通過下調mTOR信號途徑而誘導HeLa細胞自噬[J].中國藥理學通報,2009,26(9):1173-6.
[11] Yu C Y,Li H Y,Zhong J T,et al.Vitamin K3 induces autophagy in HeLa cells through downregulating the mammalian target of rapamycin(mTOR)pathway[J].Chin Pharmacol Bull,2009,25(9):1173-6.
[12] Choi S E,Sohn S,Cho J W,et al.9-Hydroxypheophorbide alpha-induced apoptotic death of MCF-7 breast cancer cells is mediated by c-Jun N-terminal kinase activation[J].J Photochem Photobiol B,2004,73(1-2):101 -7.
[13]曹 波,雷志勇,陳虹新,等.新的微管抑制劑YB-13誘導He-La細胞凋亡及其機制[J].中國藥理學通報,2008,24(1):123-7.
[13] Cao B,Lei Z Y,Chen H X,et al.YB-13,a novel synthetic m icrotubule inhibitor,induces apoptosis of HeLa cells and itsmechanism[J].Chin Pharmacol Bull,2008,24(1):123 -7.
[14]喬愛敏,池島喬,張為革,等.激活AKT和ERK可拮抗N-去甲基克拉霉素對HeLa細胞的凋亡誘導作用[J].中國藥理學通報,2007,23(3):379 -83.
[14] Qiao A M,Ikejima takashi,Zhang W G,et al.N-demethyl-clarithromycin induced HeLa apoptosis through regulating Akt and ERK activity[J].Chin Pharmacol Bull,2007,23(3):379 -83.
[15] Zhou C,Shunji C,Jinsheng D,et al.Apoptosis of mouse MS-2.brosarcoma cells induced by photodynamic therapy with Zn(Ⅱ)–Phthalocyanine[J].J Photochem Photobiol B,1996,33(3):219-23.
[16] Gilmore T D,Koedood M,Piffat K A,et al.Rel/NFκB/IkB proteins and cancer[J].Oncogene,1996,13(7):1367 -78.
[17] Screaton G R,Bell M V,Jackson D G,et al.Genomic structure of DNA encoding the lymphocyte homing receptor CD44 reveals at least 12 alternatively spliced exons[J].Proc Natl Acad Sic USA,1992,89(24):12160-4.
[18] Camp R L,Kraus T A,Pure E.Variations in the cytoskeletal interaction and posttranslational modification of the CD44 homing receptor in macrophages[J].J Cell Biol,1991,115(5):1283 -92.

