α-synuclein過表達下調Nurr1轉錄活性的機制研究
趙 明,苑玉和,金 金,孫建棟,陳乃宏
(中國醫學科學院·北京協和醫學院藥物研究所,北京 100050)
帕金森病 (Parkinson’s disease,PD)是一種常見的神經退行性疾病,其主要臨床表現癥狀為靜止性震顫、運動遲緩和強直[1]。PD患者的典型神經病理學特征為中腦黑質多巴胺能神經元進行性變性缺失,神經元胞質內存在大量的路易小體,而α-突觸核蛋白(α-synuclein)是路易小體的主要組成成分[2]。目前已有研究發現[3],α-synuclein 過表達后能夠引發多巴胺能神經元凋亡,但是其具體機制尚未完全明確。
核受體相關因子-1(Nurr1)是一種在中腦多巴胺能神經元中表達的核受體轉錄因子,屬于核甾體/甲狀腺激素受體超家族成員。Nurr1在多巴胺能系統的發育和功能維持中發揮關鍵作用,而且與帕金森病發病密切相關[4]。同時一些流行病學研究發現[5],無論是在家族性還是散發性PD中,Nurr1基因異常均為危險因素。
已有研究表明[6-7],多巴胺能神經元過表達 αsynuclein會影響多巴胺合成和轉運通路。而Castelo-Branco等[8]在中腦前體細胞研究中發現,GSK3β/β-catenin通路調節著Nurr1轉錄活性,從而影響前體細胞向神經元的分化。其中 GSK3β(Ser9)磷酸化水平降低和 β-catenin表達水平降低可抑制Nurr1轉錄活性。
鑒于Nurr1在多巴胺合成和儲存的調控中發揮關鍵作用,我們初步研究了α-synuclein與Nurr1之間的關系,并針對其機制進行初步探討。
1 材料與方法
1.1 質粒及細胞Nurr1熒光素酶報告基因pGal4-NBRE質粒載體由Thomas Perlmann教授惠贈(瑞典路德維格癌癥研究所)[9],其中嵌入Nurr1結合反應元件序列(Nurr1 binding response elements,NBRE),當轉錄因子Nurr1與其反應元件序列NBRE結合時,即可啟動熒光素酶的合成,從而可以通過檢測熒光素酶活力反映Nurr1的轉錄活性。pEGFP-N1-αsynuclein質粒載體為本室構建[10],pEGFP-N1 質粒載體、pRL-TK海腎熒光素酶表達載體和PC12細胞為本室保存。
1.2 試劑胎牛血清購自Hyclone公司,DMEM細胞培養基購自Gibco公司,試驗耗材購自Corning公司。雙熒光素酶檢測試劑盒購自威格拉斯生物有限公司,轉染試劑LipofectamineTM2000購自Invitrogen公司。化學發光檢測試劑購自普利萊公司。抗αsynuclein,β-actin,p-GSK3β/GSK3β 抗體購自Santa Cruz公司,抗β-catenin抗體購自CST公司。
1.3 儀器ECL檢測系統Fuji LAS3000,化學發光酶標檢測儀Molecular Device(Lmax),酶標儀MDC SPECTRAMAX 190。
1.4 細胞培養PC12細胞:5%胎牛血清和5%馬血清的DMEM培養基,于37℃,5%CO2培養箱中培養。
1.5 雙熒光素酶法檢測PC12細胞接種培養24 h后,采用轉染試劑 LipofectamineTM2000,向 PC12細胞轉染雙熒光素酶報告基因質粒載體(900ng pGal4-NREB和100ng pRL-TK)以及1 μg測試基因質粒載體(pEGFP-N1或 pEGFP-α-synuclein)。轉染 24 h后裂解細胞,根據雙熒光素酶檢測試劑盒說明書進行檢測。
1.6 免疫印跡檢測PC12細胞轉染24 h后,采用1%NP-40細胞裂解液進行裂解30 min后,于4℃12000 r·min-1下離心30 min。使用BCA定量試劑盒進行蛋白定量后,加入上樣緩沖液煮沸變性。30 μg蛋白經15%SDS-PAGE膠分離后轉移至PVDF膜上,3%BSA室溫封閉2 h,加入一抗4℃過夜,TBS-Tween洗滌3次后加入HRP標記的二抗,室溫孵育2 h,再經TBS-Tween洗滌3次后加上ECL發光液進行檢測。
1.7 統計學分析所有數據均采用±s表示,t檢驗進行組間差異顯著性分析。
2 結果
2.1 α-synuclein過表達對Nurr1轉錄活性的影響雙熒光素酶檢測實驗中所用質粒載體如Fig 1A所示,其中報告基因載體為pGal4-NBRE和pRL-TK質粒,測試基因質粒載體分別為pEGFP-N1空載體質粒或 pEGFP-N1-α-synuclein質粒。轉染24 h后,進行雙熒光素酶活性檢測。如 Fig 1B所示,與MOCK組(轉染pEGFP-N1空載體)相比,α-synuclein組(轉染pEGFP-N1-α-synuclein)Nurr1轉錄活性明顯下降,僅為 MOCK組的45%(P<0.01 vs MOCK group)。
2.2 α-synuclein過表達對Nurr1蛋白表達水平的影響如Fig 2A所示,α-synuclein過表達后Nurr1蛋白表達水平沒有明顯變化。通過對Fig 2A Western blot結果中Nurr1條帶進行灰度掃描后統計,如Fig 2B所示,α-synuclein過表達組與MOCK組之間差異無顯著性。這說明α-synuclein過表達對Nurr1蛋白表達水平無影響。
2.3 α-synuclein 過表達對 GSK3β/β-catenin 信號通路蛋白表達的影響GSK3β/β-catenin通路對Nurr1轉錄活性發揮正向調節作用。GSK3β(Ser9)磷酸化水平和 β-catenin含量降低可抑制Nurr1轉錄活 性[8]。針對 GSK3β/β-catenin 通路蛋白的Western blot結果顯示,α-synuclein過表達后,GSK3β(Ser9)磷酸化水平及β-catenin蛋白含量均下降(Fig 3A)。通過對 Fig 3A中 p-GSK3β及 βcatenin條帶進行灰度掃描后統計,如Fig 3B所示,與MOCK組相比,α-synuclein過表達組上述3種蛋白表達水平明顯降低,其中GSK3β磷酸化水平下降50%(P<0.01 vs MOCK組),β-catenin含量下降32%(P<0.05 vs MOCK組)。這表明 α-synuclein過表達后明顯降低GSK3β磷酸化水平和β-catenin含量,從而可能導致Nurr1轉錄活性下降。

Fig 1 Effect of α-synuclein overexpression on Nurr1 transcriptional activity in PC12 cells(±s,n=3)
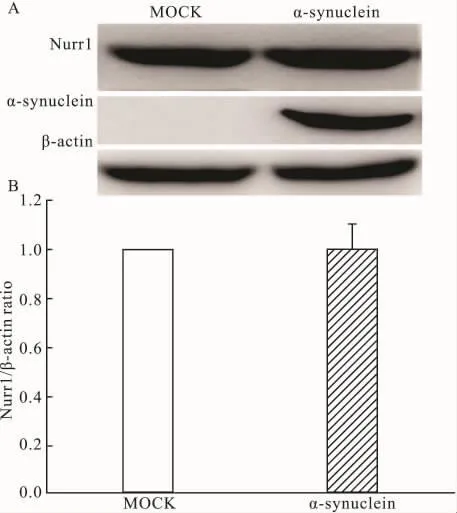
Fig 2 Effect of α-synuclein overexpression on Nurr1 protein expression level in PC12 cells(±s,n=3)

Fig 3 Effect of α-synuclein overexpression on GSK3β/β-catenin pathway in PC12 cells(±s,n=3)
3 討論
近期研究發現,多巴胺神經元核受體轉錄因子Nurr1在多巴胺神經元的發育、分化及表型維持中發揮著重要作用[4]。基因敲除研究表明,Nurr1基因敲除純合子小鼠(Nurr1-/Nurr1-)無法在中腦產生多巴胺能神經元;而Nurr1基因敲除雜合子小鼠(Nurr1+/Nurr1-)與正常小鼠相比則表現出旋轉和運動能力明顯下降。
Nurr1在多巴胺合成和儲存調控中發揮重要作用的蛋白表達,包括酪氨酸羥化酶(TH)、多巴胺轉運體(DAT)、囊泡單胺轉運體(VMAT2)和芳香氨基酸左旋脫氫酶(AADC)的表達。Lotharius等[6]發現采用在分化型MESC2.10細胞中過表達突變型αsynuclein(A53T)后,細胞內DAT與VMAT2的表達均降低50%左右[6]。Baptista 等[7]發現在神經母細胞瘤細胞中轉染野生型或突變型 α-synuclein(A30P/A53T)后,TH mRNA和蛋白表達水平明顯降低,芳香族氨基酸脫羧酶mRNA水平明顯下降。
本研究發現,α-synuclein過表達使Nurr1轉錄活性明顯下降,這為解釋α-synuclein過表達對多巴胺合成和轉運通路產生廣泛的影響提供了一些證據。但進一步研究發現α-synuclein過表達并未影響Nurr1蛋白表達水平。針對Nurr1轉錄活性調控的研究表明,在中腦前體細胞中 GSK3β/β-catenin通路調節Nurr1轉錄活性,從而影響前體細胞向神經元的分化。其中GSK3β(Ser9)磷酸化水平降低和β-catenin蛋白水平下降可抑制 Nurr1轉錄活性[8]。Kitagawa等[11]發現 β-catenin 與 Nurr1 在多種水平上存在著功能上的相互作用。
不同氨基酸位點磷酸化對其活性具有不同的調節作用。GSK3β蛋白Tyr216位點為興奮性磷酸化位點,Tyr216位點磷酸化后可激活GSK3β,并導致β-catenin降解。GSK-3β蛋白Ser9位點為抑制性磷酸化位點,Ser9位點磷酸化后可抑制GSK3β活性,從而抑制β-catenin降解。因此,GSK3β(Ser9)磷酸化水平下降使GSK3β蛋白處于激活狀態,從而導致β-catenin降解[12]。本研究發現,在過表達 α-synuclein后,GSK3β(Ser9)磷酸化水平降低,同時 βcatenin蛋白水平下降,這可能是導致Nurr1轉錄活性下調的原因。
近年來許多研究關注GSK3β在神經退行性疾病中的重要作用[13]。已有研究發現[8],提高GSK3β(Ser9)磷酸化水平可增加β-catenin含量,從而上調Nurr1轉錄活性,增加神經元前體細胞分化為具有多巴胺神經元表型的比例。因此開發針對GSK3β的藥物對維持帕金森病多巴胺細胞移植療法中神經干細胞分化具有重要意義。
綜上所述,本研究表明α-synuclein過表達可能通過抑制GSK3β/β-catenin通路,下調Nurr1轉錄活性,為闡明研究α-synuclein在帕金森氏病發病機制中的作用提供部分理論證據。
[1] Nutt J G,Wooten G F.Diagnosis and initial management of Parkinson's disease[J].N Engl J Med,2005,353:1021 - 7.
[2] Spillantini M G,Schmidt M L,Lee V M,et al.Alpha-synuclein in Lewy bodies[J].Nature,1997,6645:839 -40.
[3] Masliah E,Rockenstein E,Veinbergs I,et al.Dopaminergic loss and inclusion body formation in α-synuclein mice:Implications for neurodegenerative disorders[J].Science,2000,278:1265 -7.
[4] Jankovic J,Chen S,Le W D.The role of Nurr1 in the development of dopaminergic neurons and Parkinson’s disease[J].Prog Neurobiol,2005,77:128 -38.
[5] Le W D,Pan T H,Huang M S,et al.Decreased Nurr1 gene expression in patients with Parkinson’s disease[J].Neurol Sci,2008,273:29 -33.
[6] Lotharius J,Barg S,Wiekop P,et al.Effect of mutant alpha-synuclein on dopamine homeostasis in a new human mesencephalic cell line[J].J Biol Chem,2002,277:38884 -94.
[7] Baptista M J,O'Farrell C,Daya S,et al.Co-ordinate transcriptional regulation of dopamine synthesis genes by alpha-synuclein in human neuroblastoma cell lines[J].J Neurochem,2003,85:957-68.
[8] Castelo-Branco G,Rawal N,Arenas E.GSK-3beta inhibition/beta-catenin stabilization in ventral midbrain precursors increases differentiation into dopamine neurons[J].J Cell Sci,2004,117:5731-7.
[9] Volakakis N,Malewicz M,Kadkhodai B,et al.Characterization of the Nurr1 ligand-binding domain co-activator interaction surface[J].J Mol Endocrinol,2006,37:317 -26.
[10]馬開利,苑玉和,胡金鳳,等.α-synuclein C端截短體的胞內分布[J].中國藥理學通報,2010,26(1):36 -9.
[10] Ma K L,Yuan Y H,Hu J F,Sun J D,et al.Distribution of α-synuclein truncation in cell[J].Chin Pharmacol Bull,2010,26(1):36-9.
[11] Kitagawa H,Ray W J,Glantschnig H,et al.A regulatory circuit mediating convergence between Nurr1 transcriptional regulation and Wnt signaling[J].Mol Cell Biol,2007,27:7486 - 96.
[12] Ter-Haar E,Coll J T,Austen D A,et al.Structure of GSK3β reveals a primed phosphorylation mechanism[J].Nat Struct Biol,2001,8(7):593 -6.
[13] Kaytor M D,Orr H T.The GSK3b signaling cascade and neurodegenerative disease[J].Curr Opin Neurobiol,2002,12:275 - 8.

