心臟特異表達(dá)Calponin 1轉(zhuǎn)基因小鼠的心臟功能分析
王書美,呂 丹,陳 煒,張曉娟,曹興水,張連峰,2
(1.中國醫(yī)學(xué)科學(xué)院實驗動物研究所,衛(wèi)生部人類疾病比較醫(yī)學(xué)重點實驗室,北京 100021;2.中國醫(yī)學(xué)科學(xué)院實驗動物研究所,國家中醫(yī)藥管理局人類疾病動物模型三級實驗室,中國醫(yī)學(xué)科學(xué)院和北京協(xié)和醫(yī)學(xué)院,北京 100021)
Calponin 1(CNN1)基因編碼的堿性調(diào)寧蛋白(calponin 1,CNN1)是一個首先從雞砂囊和牛主動脈中分離出的相對分子質(zhì)量為3.4×104的堿性蛋白[1,2]。它主要在平滑肌細(xì)胞中表達(dá),具有很強的組織特異性,結(jié)合肌動蛋白,原肌球蛋白,鈣調(diào)蛋白[1,3,4],抑制肌球蛋白的ATP酶活性[5],在固定化的肌球蛋白抑制Ca2+-依賴的肌動蛋白的移動性[6],誘導(dǎo)肌動蛋白絲的構(gòu)象改變[7],參與平滑肌收縮。
20世紀(jì)90年代,CNN1作為平滑肌分化的標(biāo)記,研究主要集中在其結(jié)合肌動蛋白,抑制肌球蛋白ATP酶(myosin ATPase,簡稱ATP酶)方面。近年來,發(fā)現(xiàn)CNN1可調(diào)節(jié)肌動蛋白細(xì)胞骨架的穩(wěn)定性,認(rèn)為CNN1可作為重要的信號轉(zhuǎn)導(dǎo)和整合分子[8]。現(xiàn)在研究也表明CNN1不僅作為平滑肌分化的可靠標(biāo)記,還可預(yù)測腫瘤轉(zhuǎn)移及患者的預(yù)后情況。其表達(dá)改變與許多疾病的發(fā)生、發(fā)展密切相關(guān),研究其生化特征及生化分子機制,能為預(yù)防和治療平滑肌疾病及腫瘤,提供理論與實驗基礎(chǔ)。
在鼠類胚胎發(fā)育過程中,在9.5d胚胎的背主動脈,心臟流出管道,管型心臟中可監(jiān)測到CNN1,隨后的發(fā)育過程中血管平滑肌組織中CNN1表達(dá)上調(diào),而在心臟中的表達(dá)下調(diào)至檢測不到的水平,表明CNN1參與心肌纖維發(fā)育,調(diào)節(jié)胚胎期心臟的收縮[9]。Tan等[10]基因芯片結(jié)果中顯示心力衰竭患者中CNN1表達(dá)比非心力衰竭者下調(diào),本實驗也發(fā)現(xiàn)cTnTR141W擴張型心肌病模型小鼠心臟中CNN1表達(dá)比野生型小鼠降低,推測其對心臟發(fā)育及心血管系統(tǒng)可能具有重要的作用。CNN1過表達(dá)對心臟會有怎樣的影響,對心臟的發(fā)育是有利還是不利的,本文因此建立了心臟特異表達(dá)CNN1的轉(zhuǎn)基因小鼠,以對其生理功能,特別是對心臟正常發(fā)育可能存在的作用進行初步研究。
1 材料和方法
1.1 CNN1表達(dá)載體的構(gòu)建及轉(zhuǎn)基因小鼠的制備
以pBluescriptR-CNN1質(zhì)粒(Open Biosystems,美國,Clone ID4824832)為模板,用PCR法擴增人CNN1全長cDNA,將擴增片段插入pMD18T載體,經(jīng)測序并比對正確無突變堿基后,以Sal I(寶生物工程有限公司,中國)酶切回收CNN1片段,并克隆入α-MHC啟動子下游構(gòu)建心臟特異CNN1表達(dá)載體。提取并酶切鑒定質(zhì)粒正確后,用Not I將其線性化,SephedexG50柱純化DNA片段,獲得α-MHC啟動的CNN1基因的轉(zhuǎn)基因片段,注射前將轉(zhuǎn)基因片段的濃度調(diào)整至5ng/μL,用顯微注射法將線性化的轉(zhuǎn)基因表達(dá)載體注射到C57BL/6J小鼠的受精卵中(小鼠購自中國醫(yī)學(xué)科學(xué)院實驗動物研究所,康藍(lán)公司XCXK京2004001),用ICR小鼠作假孕受體(本實驗室飼養(yǎng)),制備轉(zhuǎn)基因小鼠(TE2000U顯微注射儀)[11]。實驗中涉及動物的操作程序已經(jīng)得到中國醫(yī)學(xué)科學(xué)院醫(yī)學(xué)實驗動物研究所實驗動物使用與管理委員會的批準(zhǔn)(GC-08-2035)。
1.2 PCR法鑒定CNN1轉(zhuǎn)基因小鼠的基因型
轉(zhuǎn)基因小鼠在出生9~14d用剪趾法編號,收集剪下的組織,用堿裂解法提取基因組DNA[12],用PCR法對轉(zhuǎn)基因小鼠進行基因型檢測。PCR上游引物為:5′AAGGGCGGAACATCATTGGGCT 3′,下游引物為:5′CTCGAAGATCTGCCGCTTGGT 3′(invitrogen)。PCR反應(yīng)體系20μL(試劑購自寶生物工程有限公司,中國)。反應(yīng)條件:94℃預(yù)變性3min,94℃變性30s,60℃退火30s,72℃延伸30s,30個循環(huán)。CNN1目的片段為215bp。
1.3 Western Blot
將小鼠脫頸椎處死后,取100mg心臟組織加入1mL預(yù)冷的蛋白裂解液,冰上充分研磨,之后冰上靜置30min,再將組織勻漿于4℃,12000r/min離心30min,吸取上清即為心臟組織總蛋白。取50μg蛋白,12%的SDS-PAGE凝膠電泳,將蛋白轉(zhuǎn)移到0.45μm硝酸纖維素NC膜上(Millipore,美國)。將NC膜放入5%脫脂奶粉封閉液,室溫下置搖床上封閉1h,再用TBST稀釋的兔抗人Calponin 1單克隆抗體(ab46794,Abcam公司,美國)(1∶20000稀釋),4℃雜交過夜。次日,TBST洗3次,每次5min。將膜轉(zhuǎn)移到TBST稀釋的辣根過氧化物酶標(biāo)記的羊抗兔抗體(Pierce,美國)(1∶15000),室溫雜交1h,采用HRP-GAPDH作為內(nèi)參(康成生物,中國),TBST洗3次,每次5min。將膜置于化學(xué)發(fā)光液中,X-ray膠片曝光、顯影及定影。
1.4 超聲檢查CNN1轉(zhuǎn)基因小鼠
選用3月齡的轉(zhuǎn)基因陽性和同窩陰性對照小鼠,用三溴乙醇(0.2mL/10g體重)麻醉,脫去心前區(qū)的被毛,選用30Hz的探頭,按Zhou[13]報道的方法進行心臟超聲影像分析(Vevo770小動物超聲探測系統(tǒng),加拿大)。
1.5 組織學(xué)檢測
選用6月齡的轉(zhuǎn)基因陽性和同窩陰性對照小鼠,頸椎脫臼法犧牲小鼠,打開胸腔取出心臟,將心臟組織固定在中性福爾馬林中24h,進行脫水、包埋、切片、HE染色和Masson染色。
1.6 統(tǒng)計學(xué)分析
數(shù)據(jù)SPSS統(tǒng)計軟件處理。先進行數(shù)據(jù)的方差齊性檢驗,組間比較采用獨立性t檢驗。計量數(shù)據(jù)用均數(shù)±標(biāo)準(zhǔn)差(±s)表示。
2 結(jié)果
2.1 CNN1基因在小鼠心臟組織中的表達(dá)
分別提取新生、14d,30d,90d的野生型小鼠,3月齡cTnTR141W和cTnTR92Q轉(zhuǎn)基因小鼠[14,15]的心臟組織總蛋白,用Calponin 1單克隆抗體進行Western Blot分析,結(jié)果CNN1在不同年齡的野生型小鼠心臟中均有表達(dá),且表達(dá)隨小鼠年齡的增長略有下調(diào)(圖1A),同時發(fā)現(xiàn)CNN1在擴張型心肌病模型小鼠心臟中表達(dá)降低,肥厚型心肌病模型小鼠心臟中表達(dá)升高(圖1B)。
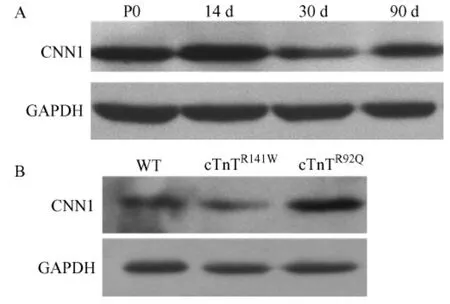
圖1 CNN1基因在小鼠心臟組織中的表達(dá)Fig.1 Expressions of CNN1 gene in the heart tissues

圖2 CNN1轉(zhuǎn)基因小鼠的建立Fig.2 Generation of CNN1 transgenic mice
2.2 CNN1轉(zhuǎn)基因小鼠的建立
用PCR法克隆人CNN1基因,測序結(jié)果顯示克隆的cDNA同已報道的CNN1序列完全一致(GenBank No.NM_001299.4),將CNN1基因插入心臟特異表達(dá)的α-MHC啟動子下游,構(gòu)建α-MHCCNN1轉(zhuǎn)基因表達(dá)載體(圖2A)。用顯微注射法將線性化的轉(zhuǎn)基因表達(dá)載體注射到C57BL/6J小鼠的受精卵中,轉(zhuǎn)入受體假孕ICR小鼠中,小鼠出生14d提取基因組DNA,用PCR擴增CNN1基因215bp目的片段,鑒定CNN1轉(zhuǎn)基因小鼠的基因型(圖2B),共得到4只首建鼠,且均可傳代。分別提取CNN1首建鼠的F1代陽性轉(zhuǎn)基因小鼠和同齡陰性對照小鼠心臟組織總蛋白,用CNN1單克隆抗體進行Western Blot分析,結(jié)果顯示5號及6號首建鼠心臟組織內(nèi)CNN1蛋白表達(dá)量明顯高于同齡陰性對照小鼠(圖2C)。
2.3 超聲檢查CNN1轉(zhuǎn)基因小鼠的心臟幾何構(gòu)型及心功能
將3月齡的CNN1轉(zhuǎn)基因小鼠和同窩陰性對照小鼠進行心臟超聲影像分析(表1,圖3),結(jié)果顯示,CNN1轉(zhuǎn)基因小鼠收縮期左室內(nèi)徑(LVID,systolic)增加28%(P<0.01,n=12),舒張期左室內(nèi)徑(LVID,diastolic)增加16.2%(P<0.01,n=12),收縮期左室后壁厚度(LVPW,systolic)減小15.7%(P<0.01,n=12),舒張期左室后壁厚度(LVPW,diastolic)減小21%(P<0.01,n=12),射血分?jǐn)?shù)EF(ejection fraction)降低11.5%(P<0.01,n=12),短軸縮短率FS(fraction shortening)降低14.6%(P<0.05,n=12)。

表1 3月齡CNN1轉(zhuǎn)基因小鼠心臟結(jié)構(gòu)和功能M型超聲分析(n=12)Tab.1 The cardiac structure and function analysis of 3-month transgenic mice by M-mode echocardiograph(n=12)
2.4 CNN1轉(zhuǎn)基因小鼠心臟病理檢查
將6月齡CNN1轉(zhuǎn)基因小鼠和同窩陰性對照小鼠的心臟進行病理解剖,并進行HE染色和Masson染色。HE染色可見CNN1轉(zhuǎn)基因小鼠心臟全心擴大,心臟室壁明顯變薄,心腔變大(圖4A,B),高倍鏡下可見心肌細(xì)胞不均勻肥大,細(xì)胞間隙變大(圖4C,D),Masson染色可見CNN1轉(zhuǎn)基因小鼠心臟心肌間質(zhì)纖維明顯增多(圖4E,F(xiàn))。(圖見封3)
3 討論
Calponins是肌動蛋白結(jié)合蛋白家族,在脊椎動物細(xì)胞中廣泛表達(dá)。按其等電點(isoelectric point,pI)分為堿性調(diào)寧蛋白(h1 calponin,CNN1,pI 8~10),中性調(diào)寧蛋白(h2 calponin,h2CaP,pI 7~8),酸性調(diào)寧蛋白(h3 calponin,h3CaP,pI 5~6)[16]。這3個成員的前273個氨基酸殘基具有很高的同源性(>70%),都是由單一CH結(jié)構(gòu)域(calponin homologydomain)和29個氨基酸殘基組成的CLR(calponin-like repeat)三拷貝串聯(lián)重復(fù)序列組成。但它們的羧基末端序列有較大的差異[17]。堿性調(diào)寧蛋白大多表達(dá)于終末分化和非增殖性的平滑肌細(xì)胞中,其在平滑肌組織中的含量與原肌球蛋白(tropomyosin)相似,為肌動蛋白的1/7。中性調(diào)寧蛋白主要分布于心肌組織中。酸性調(diào)寧蛋白是一種無組織表達(dá)特異性的變異體,其在腦組織中含量最豐富。
本文利用Western Blot檢測了CNN1在野生型小鼠心臟中的時程表達(dá),出生后的小鼠心臟中均檢測到了CNN1的表達(dá),并發(fā)現(xiàn)CNN1在cTnTR141W擴張型心肌病小鼠模型中的表達(dá)比野生型小鼠低,推測其對心臟發(fā)育及心血管系統(tǒng)可能具有重要的作用。
本文中,首建鼠Founder 5和Founder 6的后代小鼠PCR檢測結(jié)果顯示外源基因能穩(wěn)定地傳遞到下代。Western Blot結(jié)果顯示,CNN1在5號和6號首建鼠心臟組織中與野生型小鼠相比有較高表達(dá),表明成功建立了心臟特異表達(dá)的α-MHC-CNN1轉(zhuǎn)基因小鼠。
我們建立的心臟特異表達(dá)CNN1的轉(zhuǎn)基因小鼠的心臟超聲影像分析結(jié)果顯示,與野生型小鼠心臟相比,收縮期和舒張期左室內(nèi)徑增加,收縮期和舒張期左室后壁厚度變薄,射血分?jǐn)?shù)和短軸縮短率降低。心臟組織病理觀察結(jié)果顯示,CNN1轉(zhuǎn)基因小鼠心臟全心擴大,心臟室壁明顯變薄,心腔變大,高倍鏡下可見CNN1轉(zhuǎn)基因小鼠心肌細(xì)胞不均勻肥大,細(xì)胞間隙變大,心肌間質(zhì)纖維明顯增多。

圖3 CNN1轉(zhuǎn)基因小鼠M型超聲分析截圖Fig.3 Analysis of the mouse heart by echocardiography
目前,關(guān)于心臟特異表達(dá)CNN1的轉(zhuǎn)基因小鼠尚未見報道,本文成功建立了心臟特異表達(dá)的α-MHC-CNN1轉(zhuǎn)基因小鼠,實驗發(fā)現(xiàn),CNN1過表達(dá)可使心臟發(fā)生心腔增大,室壁變薄,心臟收縮功能減弱等改變,此轉(zhuǎn)基因小鼠的建立為進一步研究CNN1對心臟正常發(fā)育,以及對CNN1在心臟發(fā)育和心肌病的發(fā)生過程中的生物學(xué)功能及可能的機制加以研究,提供了有價值的模型動物。
[1]Takahashi K,Hiwada K,Kokubu T.Isolation and characterization of a 34,000-dalton calmodulin-and Factinbinding protein from chicken gizzard smooth muscle[J].Biochem Biophys Res Commun,1986,141:20-26.
[2]Takahashi K,Nadal-Ginard B.Molecular cloning and sequence analysis of smooth muscle calponin[J].J Biol Chem,1991,266:13284-13288.
[3]Childs TJ,Watson MH,NovyRE,etal.Calponin and tropomyosin interactions[J].BiochemBiophys Acta,1992,1121:41-46.
[4]Graceffa P.Evidence for interaction between smooth muscle tropomyosin and caldesmon[J].FEBS Lett,1987,218:139-142.
[5]Winder SJ,Walsh MP.Calponin:thin filament-linked regulation of smooth muscle contraction[J].Cell Signal,1993,5:677-686.
[6]Shirinsky VP,Biryukov KG,Hettasch JM,et al.Inhibition of the relative movement of actin and myosin by caldesmon and calponin[J].J Biol Chem,1992,267:15886-15892.
[7]Noda S,Ito M,Watanabe S,et al.Conformational changes of actin induced by calponin[J].Biochem Biophys Res Commun,1992,185:481-487.
[8]Kathleen GM,Samudra SG.Signaltransduction in smooth muscle:cross-bridge regulation by thin filament-associated proteins[J].J Appl Physiol,2001,91:953-962.
[9]Miano JM,Olson EN.Expression of the smooth muscle cell calponin gene marks the early cardiac and smooth muscle cell lineages during mouse embryogenesis[J].J Biol Chem,1996,271:7095-7103.
[10]Tan FL,Moravec CS,Li JB,et al.The gene expression fingerprint of human heart failure[J].PNAS,2002,99:11387-11392.
[11]Gordan JW,Ruddle FH.Integration and stable germline transmission of genes injected intomousepronuclei[J].Science,1981,214(4526):1244-1246.
[12]Truett GE,Heeger P,Mynatt RL,et al.Preparation of PCR-quality mouse genomic DNA with hot sodium hydroxide and tris(HotSHOT)[J].Biotechniques,2000,29(1):52-54
[13]Zhou YQ,F(xiàn)oster FS,Brian JN,etal.Comprehensive transthoracic cardiac imaging in mice using ultrasound biomicroscopy with anatomical confirmation by magnetic resonance imaging[J].Physiol Genomics,2004,18:232-244.
[14]馮娟,董偉,全雄志,等.cTnTR141W轉(zhuǎn)基因小鼠擴張型心肌病模型的建立[J].中國比較醫(yī)學(xué)雜志,2007,17(10):563-567.
[15]董偉,馮娟,全雄志,等.cTnTR92Q轉(zhuǎn)基因小鼠肥厚型心肌病模型的建立[J].中國比較醫(yī)學(xué)雜志,2008,18(5):5-8.
[16]Danninger C,GimonaM.LivedynamicsofGFP-calponin:isoform-specific modulation of the actin cytoskeleton and autoregulation by C-terminal sequences[J].J Cell Sci,2000,113:3725-3736.
[17]Gimona M and Mital R.The single CH domain of calponin is neither sufficient nor necessary for F-actin binding[J].J Cell Sci,1998,111:1813-1821.

