一種蛋白質質譜分析中快速胍基化新方法
王雪穎,張養軍,王 昕,3,
佟 巍2,秦偉捷2,毛心麗1,2,錢小紅2
(1.沈陽藥科大學,遼寧 沈陽 110015;2.軍事醫學科學院放射與輻射醫學研究所,北京蛋白質組研究中心,蛋白質組學國家重點實驗室,北京 102206;3.防化指揮工程學院,北京 102205)
一種蛋白質質譜分析中快速胍基化新方法
王雪穎1,2,張養軍2,王 昕2,3,
佟 巍2,秦偉捷2,毛心麗1,2,錢小紅2
(1.沈陽藥科大學,遼寧 沈陽 110015;2.軍事醫學科學院放射與輻射醫學研究所,北京蛋白質組研究中心,蛋白質組學國家重點實驗室,北京 102206;3.防化指揮工程學院,北京 102205)
胍基化修飾在蛋白質組學鑒定及定量研究中發揮著重要的作用,本研究建立了一種蛋白質質譜分析中微波輔助快速胍基化的新方法。采用標準肽段系統地優化了反應溶劑p H值、O-甲基異脲的濃度及微波加熱時間,發現標準肽段在p H 12的氨水溶液中,O-甲基異脲的濃度為1.5 mol/L,微波高火加熱1 min的胍基化效率為99%。將此方法應用于馬心肌紅蛋白和牛血清白蛋白胰蛋白酶酶切肽段,質譜檢測結果表明,含賴氨酸肽段的平均胍基化效率(95%)大于文獻報道的平均胍基化效率(85%)。與傳統水浴加熱胍基化方法相比,微波輔助加熱胍基化方法縮短了反應時間,提高了反應效率,降低了肽段N端副反應。
胍基化;微波輔助;肽;蛋白質定量
胍基化是多肽和蛋白質重要的化學修飾之一。經胍基化反應,多肽的賴氨酸(lysine)轉化為高精氨酸,其原理示于圖1。胍基化反應被廣泛應用于提高多肽在基質輔助激光解吸電離(MALDI)質譜中的離子化效率和信號強度[1-2];改變多肽在質譜中的碎片裂解效率以改善多肽的二級譜圖質量和提高多肽的覆蓋率[3];或根據研究的需要特異性地封閉賴氨酸的ε-氨基[4-6]。胍基化反應在蛋白質組學的相對定量研究中也有應用,例如Carabetta等[7]采用金屬內切蛋白酶Lys-N酶切方法結合15N/14N標記的O-甲基異脲試劑進行胍基化反應,在提高了離子化效率和檢測靈敏度的同時,實現了對大腸桿菌(E.coli)中多A聚合酶I(PAPI)蛋白質的相對定量。但是,目前報道的各種胍基化方法仍存在不足,一是胍基化反應時間長,文獻報道的有30 min[8]、2 h[5-6]、過夜[7]甚至4天的反應時間[9];二是胍基化的反應效率還有待提高,Beardsley等[10]考察了血紅蛋白(hemoglobin)、牛血清白蛋白(bovine serum albumin)和新月柄桿菌(caulobacter crescentus)中的ctr A蛋白酶切肽段的胍基化反應情況,3種蛋白酶切肽段的平均胍基化效率僅為85%。
為了解決這些問題,本研究選用具有揮發性的氨水為胍基化堿性溶劑,通過微波高火加熱的方式,建立一種新型快速的胍基化方法,并與傳統水浴加熱方式做比較。

圖1 胍基化反應原理示意圖Fig.1 The reaction schematic diagram of guanidination
1 實驗部分
1.1 儀器與裝置
4800基質輔助激光解吸電離飛行時間串聯質譜儀:美國 ABsciex公司產品;Sartorius BP211d分析天平:瑞士Sartorius公司產品;Thermo Orion MODEL 818 p H計:美國Thermo公司產品;微波爐:廣東Galanz公司產品;C18 zip tip脫鹽柱:美國Promega公司產品。
1.2 材料與試劑
標準肽段(色譜方法測定純度為99%,絕對含量70%):上海吉爾生化公司產品;馬心肌紅蛋白、牛血清白蛋白:美國Sigma公司產品;α-氰基-4-羥基肉桂酸(St.Louis,MO):美國Sigma公司產品;二硫蘇糖醇和測序級胰蛋白酶(Madison,WI):美國Promega公司產品;三氟乙酸、O-甲基異脲半硫酸鹽、碘乙酰胺:美國 Acros Organics公司產品;乙腈(色譜純,Phillipsburg,ΜSA):美國J.T.Baker公司產品;乙酸、氨水等其他試劑為分析純:北京化學試劑公司產品。實驗用水經 Milli-Q A10型純水儀制備(Bedford,MA):美國Millipore公司產品。
1.3 標準肽段的胍基化反應條件優化
取1μL 1 g/L的標準肽段(DVDPGEHYIIK,相對分子質量1 285.64),加入5μL 25%的氨水,依次改變O-甲基異脲終濃度(50,100,200,400,600,1 000,1 500 mmol/L)、溶液 p H值(9.0,10.0,10.5,11.0,11.5,12.0,13.0)和微波高火加熱時間(15,30,60,90,120 s)等反應條件,再加入25μL 10%三氟乙酸(TFA)中止反應,然后進行質譜分析,計算峰強度比值H1327/(H1327+H1285),來評估標準肽段的胍基化反應程度及特異性。
1.4 蛋白質酶切
將100μg馬心肌紅蛋白(Myoglobin)溶于100μL 50 mmol/L碳酸氫銨緩沖液中,95℃加熱變性10 min后,冷卻到室溫,加入2μg胰蛋白酶,37 ℃ 孵育,分別在 5、10、15、20、25、30 min,1、2 h,過夜等不同時間段后各取5μL酶切液,然后加入100 m L水,微波高火加熱到95℃,加入酶切樣品,低火微波加熱5~10 min,中止酶切反應。最后將各時間點的酶切液混合。
將100μg牛血清白蛋白(BSA)溶解于50 μL 8 mol/L 尿 素 (含 10 mmol/L DTT,50 mmol/L NH4HCO3緩沖液,p H 8.0)中,37 ℃溫育1 h,加入IAA使其終濃度為50 mmol/L,室溫放置于暗處2 h,加入50 mmol/L緩沖液使反應體系中尿素終濃度小于1 mol/L,加入2μg胰蛋白酶,37℃孵育過夜,微波輔助加熱中止酶切反應。
1.5 傳統水浴胍基化與微波輔助加熱胍基化
1.5.1 傳統水浴加熱胍基化方法[11]取1μL 1 g/L馬心肌紅蛋白酶切液,加入5.5μL 7 N氨水混勻,再加入1.5μL 7.9 mol/LO-甲基異脲,渦旋混勻,65℃水浴恒溫5~10 min,最后加入15μL 10%的TFA終止反應。用Zip Tip C18反相小柱脫鹽,分別用100%和50%乙腈沖洗小柱,然后用10μL 0.1%TFA平衡脫鹽柱,上樣10μL,最后用5μL 80%ACN/0.1%TFA 洗脫。脫鹽完成后進行質譜檢測。
1.5.2 微波輔助加熱胍基化方法 取1μL 1 g/L馬心肌紅蛋白酶切液,加入5μL 25%的氨水(p H 12),渦旋混勻,加入新鮮配制的O-甲基異脲,使其終濃度為1.5 mol/L,混勻后高火微波1 min。然后加入25μL 10%的TFA終止反應。用Zip Tip C18反相小柱脫鹽,進行質譜檢測。
1.6 牛血清白蛋白胰蛋白酶酶切肽段胍基化反應
取上述1μL 1 g/L牛血清白蛋白胰酶酶切肽段,加入5μL p H 12的氨水,渦旋混勻,再加入現配制的O-甲基異脲,使其終濃度為1.5 mol/L,混勻后高火微波1 min。然后加入25μL 10%的TFA終止反應。用Zip Tip C18反相小柱脫鹽,取反應產物進行質譜分析,計算峰強度比值H原肽段/(H原肽段+H胍基化肽段),來評估肽段的胍基化反應效率及特異性。
1.7 質譜分析條件
待測樣品混合基質(α-氰基-4-羥基肉桂酸)溶液點靶分析。上樣量為1 pmol,馬心肌紅蛋白胰酶酶切肽段作為標準物對儀器進行外標校正,校準至誤差≤0.1 u,相對標準偏差≤10 ppm。一級質譜數據采集使用MS-positive反射模式,掃描范圍600~3 500,激光能量5 000,每張譜圖累加800次。二級質譜數據采用MS/MS-1 k V反射模式,從一級譜圖中選擇信噪比大于20的峰,母離子選擇范圍設定其相對分辨率為150,激光能量為5 500,每張譜圖累加1 200次。儀器控制軟件為4800Exp LorerTMsoftware。本研究所有質荷比(m/z)均為單同位素峰質量數。
2 結果與討論
2.1 標準肽段胍基化反應條件優化
影響胍基化反應的主要因素包括:反應體系的p H值、O-甲基異脲的濃度、反應的溫度等。本研究通過改變傳統的水浴加熱方式,采用高火微波加熱方式,并從溶劑種類、反應溶劑p H值、O-甲基異脲的濃度、微波時間等方面對胍基化反應進行了優化。
2.1.1 胍基化反應溶劑的選擇 胍基化反應在堿性環境中進行,常用的堿性試劑有氫氧化鈉[2,12]、碳酸鈉[1,3]、氨水[11,13]。由于氨水具有揮發性,容易從反應體系中除去,可減少質譜分析時[M+Na]+峰的干擾,故本實驗選用氨水為反應溶劑。
2.1.2 反應溶液p H的優化 反應體系的p H值是影響胍基化效率的關鍵因素之一。從反應原理分析,在強堿性條件下有利于賴氨酸ε-氨基(p Ka=10.53)的去質子化從而使反應順利進行;同時鑒于在p H大于13.6時多肽將發生水解副反應[12],實驗考察了在25%的氨水溶劑中,p H值在9~13.5,O-甲基異脲的終濃度為1.5 mol/L,微波輔助加熱1 min條件下的胍基化反應效率,反應結果示于圖2a。隨著反應體系的p H增加至12,胍基化的反應效率達到最大值97%,p H值再增加則胍基化效率幾乎保持不變。所以,最佳的p H值是11.5~13,此區間標準肽段的胍基化反應效率可達95%以上。
2.1.3O-甲基異脲濃度的優化 文獻報道常用的胍基化試劑有:O-甲基異脲硫酸氫鹽、O-甲基異脲半硫酸鹽、氨基氰、吡唑-1-羧酰胺、S-甲基-硫脲及其衍生物[14],因O-甲基異脲硫酸氫鹽或O-甲基異脲半硫酸鹽對賴氨酸側鏈反應的專一性強,故多選擇O-甲基異脲試劑。另外O-甲基異脲硫酸氫鹽是由一分子HSO4-和一分子O-甲基異脲組成,其飽和溶液p H值為0.76;而O-甲基異脲半硫酸鹽是由一分子O-甲基異脲和1/2分子SO42-組成,其飽和溶液p H 值為2.60[11]。O-甲基異脲半硫酸鹽對胍基化反應體系的p H值影響小,故選用此試劑。
O-甲基異脲半硫酸鹽的濃度也是直接影響胍基化效率的重要因素之一。圖2b顯示了25%氨水溶液、p H值為12時,O-甲基異脲半硫酸鹽的終濃度從0.1~1.5 mol/L變化所對應的胍基化效率,在1 mol/L和1.5 mol/L時,胍基化效率為96%以上,終濃度為1.5 mol/L時,反應效率最高為99%。
2.1.4 微波輔助加熱時間的優化 縮短化學反應的時間以減少由于反應時間長而引起的副反應、提高研究的效率和加快整個研究的進程等為優化反應條件的共同目標之一。傳統的縮短胍基化反應時間的手段是水浴加熱,如Chervenka等[9]對胰凝乳蛋白酶原(chymotrypsinogen)進行胍基化反應時,在4℃反應4天;當反應溫度提高到37℃時,反應時間縮短到2 h[5]。Rich-ard等[11]在水浴65℃時對肽段進行胍基化,反應時間縮短到5~10 min。
微波加熱不同于一般的溫度從高向低的熱傳導過程,溫度的升高直接發生于被加熱物體內部而不是發生于加熱腔內或是在容器上,所以微波加熱具有加熱速度快,加熱均勻的特點。本實驗主要考察了標準肽段微波高火15、30、60、90、120 s的反應,結果示于圖2c,發現標準肽段在30 s~2 min胍基化效率都達96%以上,反應時間低于文獻報道的5~10 min[11]。分析原因,可能是微波加熱提高了反應速率。
2.2 水浴加熱與微波輔助加熱胍基化方法的比較
選用肌紅蛋白胰酶酶切肽段為模型,按文獻[11]報道的水浴方法與微波輔助胍基化方法分別進行胍基化反應。并按不同時間點將酶切所產生的含漏切位點的馬心肌紅蛋白肽段與過夜酶切的肽段混合,以便考察微波輔助胍基化方法對含漏切位點肽段和無漏切位點肽段胍基化的反應效率。
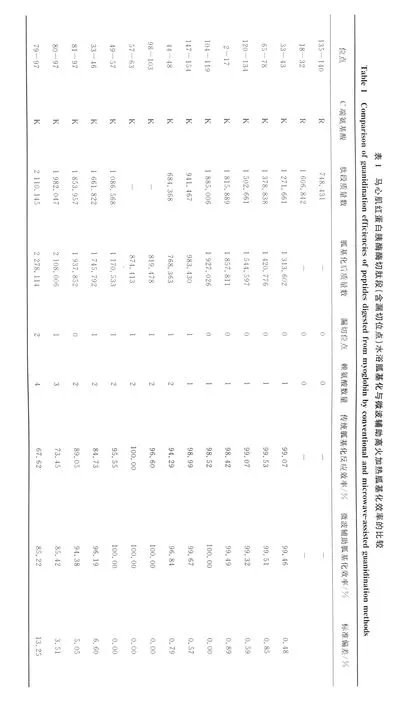
在25%氨水(p H 12),O-甲基異脲終濃度為1.5 mol/L,微波高火加熱1 min的條件下反應,馬心肌紅蛋白酶切肽段胍基化反應結果示于表1和圖3,水浴方法與微波輔助胍基化方法都能使無漏切位點肽段(peptide 1-7)胍基化效率達到98%以上,對含有漏切位點的肽段(peptide 8-14)胍基化效率可達到95%,但微波輔助加熱的方法更占優勢。隨著賴氨酸數量的增多,肽段的(peptide 16)胍基化反應效率降低。所選肽段胍基化反應的標準偏差小于15%。
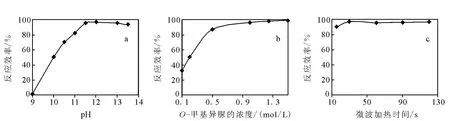
圖2 不同條件對標準肽段胍基化反應效率的影響a.氨水的p H值;b.O-甲基異脲的濃度;c.微波加熱時間Fig.2 Different reaction conditions on guanidination efficiencies of standard peptide a.p H of ammonia;b.concentration of O-methylisourea hemisulfate;c.time of microwave heating
在對比實驗中,發現N端伯胺基也會發生修飾反應。N端伯胺基與O-甲基異脲的反應與N端氨基酸種類有關,在馬心肌紅蛋白酶切肽段微波加熱方法中,以Y、L、H、F、A、G氨基酸為N端的肽段都發生了副反應。其中以A(peptide 1)、G(peptide 6)為 N 端的肽段的胍基化效率分別為5%和16%。Y、L、H、F氨基酸為N端的氨基胍基化效率在1.5%以下,可忽略。A和G為N端的肽段胍基化的原因可能是結構簡單,空間位阻小,導致副反應的可能性增大。而這兩個肽段在水浴加熱方式反應中副反應分別為7%和22%。據文獻報道[11],在馬心肌紅蛋白和細胞色素C酶切肽段水浴加熱方式胍基化數小時,M、S、V、L、F、E、A 都會發生副反應。相比之下,由于微波輔助胍基化可在1 min完成,因此副反應更少。
在分析肽段N端副反應時,其中以A為N端的肽段(peptide 1)質量數為748.4,N端被胍基化后質量數增加為790.4,同時肌紅蛋白含一個漏切位點的肽段質量數增加也為790.4,為了驗證748.4的N端是否被胍基化,在 MALDITOF-TOF質譜上做了二級質譜分析,比較b、y離子是否匹配。當N端被修飾,b離子質荷比增加42,而y離子不變。y離子的信號強于b離子,所以實驗著重觀察了y離子是否匹配。如圖4所示,實驗發現790.4肽段的y離子與748.4完全匹配,從而證明了以丙氨酸為N端的肽段的確發生了胍基化反應。其他N端是否發生副反應也可以通過此方法進行驗證。
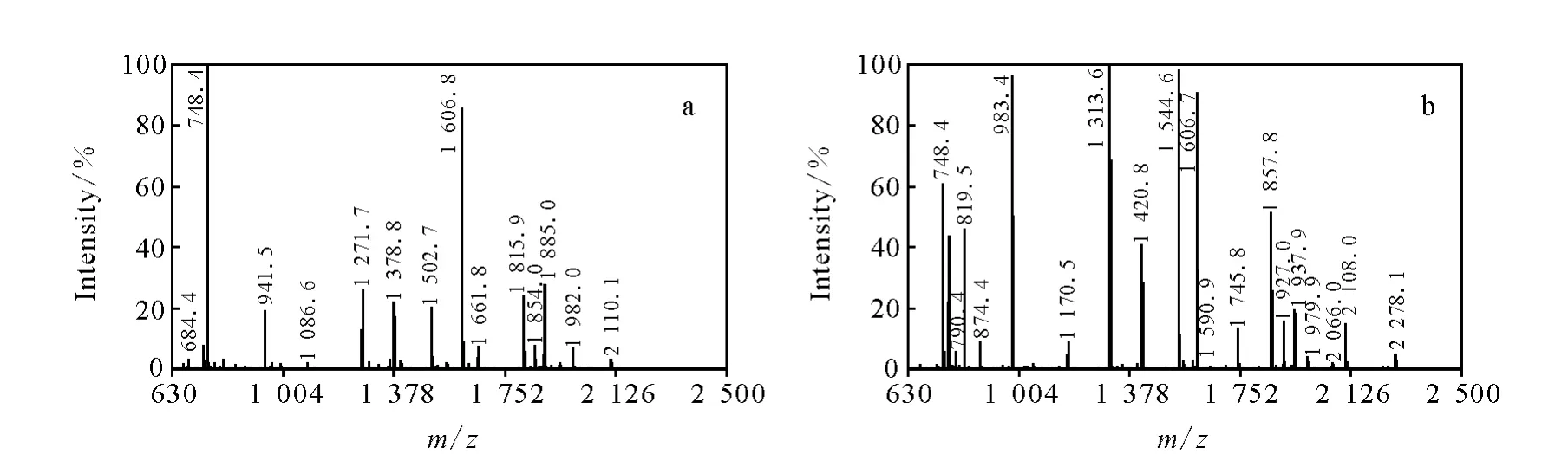
圖3 馬心肌紅蛋白胰酶酶切肽段胍基化前(a)和胍基化后(b)的 MALDI-TOF/TOF-MS圖Fig.3 MALDI-TOF/TOF mass spectra of peptides from myoglobin before guanidination(a)and after microwave-assisted guanidination(b)
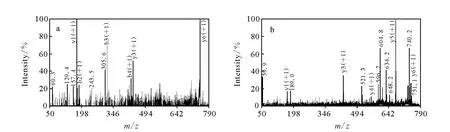
圖4 馬心肌紅蛋白酶切肽段T135-140(ALELFR)N端被修飾前(a)和被修飾后(b)的 MALDI-TOF/TOF-MS的二級圖Fig.4 MALDI-TOF/TOF MS/MS spectra of pepetide1 before(a)and after(b)guanidination
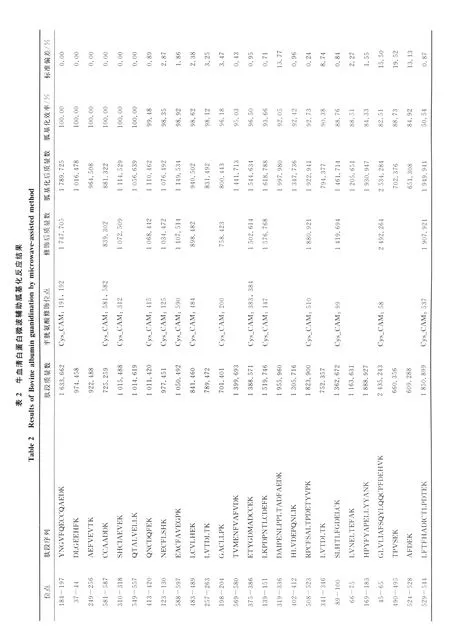
2.3 微波輔助加熱胍基化方法的驗證
為了進一步驗證微波輔助加熱胍基化方法的可靠性,選擇牛血清白蛋白(BSA)胰蛋白酶酶切肽段進行胍基化反應,實驗結果列于表2。在質譜所鑒定到的26個以賴氨酸為C端的肽段中,其中有11個肽段的胍基化效率達98%以上,8個肽段的胍基化達到90%以上,6個肽段的胍基化效率82%以上,1個含脯氨酸肽段的胍基化為50%。所選肽段胍基化反應的標準偏差均小于20%。證明了本實驗建立的胍基化方法的普適性。實驗所選擇的兩個蛋白質(馬心肌紅蛋白和牛血清白蛋白)含賴氨酸肽段的平均胍基化效率(95%)大于文獻報道的平均胍基化效率(85%)[10]。 另 外, 肽 段 (RPCFSALTPDETYVPK)的胍基化效率僅為50%,其原因可能是脯氨酸的吡咯環的空間位阻大,影響賴氨酸側鏈氨基的胍基化反應。
對于肽段N端副反應的考察,不僅觀察了BSA以R結尾的肽段,也考察了理論酶切肽段賴氨酸側鏈氨基完全胍基化后的N端是否發生修飾。實驗發現此副反應不但與N端氨基酸的種類有關,也與肽段本身的結構有關。其中以L、E、G、S氨基酸為N端的肽段,副反應胍基化效率超過15%,以A為N端的肽段副反應為5%。除了以 W、P、I、F這4個氨基酸為N端的肽段在BSA的肽段沒有考察到,其余以D、H、M、V、T、C、N、R、Q、Y為 N 端的肽段沒有發現胍基化副反應。
3 結論
本實驗改進了傳統胍基化的方法。采用微波輔助加熱1 min,在p H 11.5~13的氨水溶液中,O-甲基異脲半硫酸鹽的終濃度在1 mol/L和1.5 mol/L時,馬心肌紅蛋白和牛血清白蛋白胰酶酶切且含賴氨酸肽段的平均胍基化效率(95%)大于文獻報道的平均胍基化效率(85%)。與水浴加熱胍基化方法相比,微波輔助加熱胍基化方法縮短了反應時間,提高了反應效率,降低了肽段N端副反應,使得本方法在蛋白質定性定量分析中發揮重要的作用。
[1]HALE J E,BUTLER J P,KNIERMAN M D,et al.Increased sensitivity of tryptic peptide detection by MALDI-TOF mass spectrometry is achieved by conversion of lysine to Homoarginine[J].Anal Biochem,2000,287(1):110-117.
[2]BRANCIA F L,OLIVER S G,GASKELL S J.Improved matrix-assisted laser desorption/ionization mass spectrometric analysis of tryptichydrolysates of proteins following guanidination of lysine-containing peptides[J].Rapid Commun Mass Spectrom,2000,14(21):2 070-2 073.
[3]HENNRICH M L,BOERSEMA P J,VAN DEN TOORN H,et al.Effect of chemical modifications on peptide fragmentation behavior upon electron transfer induced dissociation[J].Anal Chem,2009,81(18):7 814-7 822.
[4]林虹君,衛軍營,賈 偉,等.胍基化修飾結合稀土金屬標記應用于蛋白質相對定量研究[J].質譜學報,2010,31(5):284-290.
[5]ZHOU C,ZHANG Y,QIN P,et al.A method for rapidly confirming protein N-terminal sequences by matrix-assisted laser desorption/ionization mass spectrometry[J].Rapid Commun Mass Spectrom,2006,20(19):2 878-2 884.
[6]ZHAO L,ZHANG Y,WEI J,et al.A rapid isolation and identification method for blocked N-terminal peptides by isothiocyanate-coupled magnetic nanoparticles and MS[J].Proteomics,2009,9(18):4 416-4 420.
[7]CARABETTA V J,LI T,SHAKYA A,et al.Integrating Lys-N proteolysis and N-terminal guanidination for improved fragmentation and relative quantification of singly-charged ions[J].J Am Soc Mass Spectrom,2010,21(6):1 050-1 060.
[8]WANG DXU W,MCGRATH SC,PATTERSON C,et al.Direct identification of ubiquitination sites on ubiquitin-conjugated CHIP using MALDI mass spectrometry[J].J Proteome Res,2005,4(5):1 554-1 560.
[9]CHERVENKA C H,WILCOX P E.Chemical derivatives of chymotrypsinogenⅡreaction withO-methylisourea [J].J Biol Chem,1956,222:635-647.
[10]BEARDSLEY R L,KARTY J A,REILLY J P.Enhancing the intensities of lysine-terminated tryptic peptide ions in matrix-assisted laser desorption/ionization mass spectrometry[J].Rapid Commun Mass Spectrom,2000,14(23):2 147-2 153.
[11]BEARDSLEY R L,REILLY J P.Optimization of guanidination procedures for MALDI mass mapping[J].Anal Chem,2002,74(8):1 884-1 890.
[12]KEOUGH T,LACEY M P,YOUNGQUIST R S.Derivatization procedures to facilitate de novo sequencing of lysine-terminated tryptic peptides using postsource decay matrix-assisted laser desorption/ionization mass spectrometry[J].Rapid Commun Mass Spectrom,2000,14(24):2 348-2 356.
[13]COCKRILL S L,FOSTER K L,WILDSMITH J,et al.Efficient micro-recovery and guanidination of peptides directly from MALDI target spots[J].Biotechniques,2005,38(2):301-304.
[14]RODRIGUEZ F,ROZAS I,ORTEGA J E,et al.Guanidine and 2-Aminoimidazoline Aromatic Derivativesα2-adrenoceptor antagonists,1:toward new antidepressants with heteroatomic linkers[J].J Med Chem,2007,50(18):4 516-4 527.
A Novel Method of Fast Guanidination in Protein Analysis
WANG Xue-ying1,2,ZHANG Yang-jun2,WANG Xin2,3,TONG Wei2,QIN Wei-jie2,MAO Xin-li1,2,QIAN Xiao-hong2
(1.Shenyang Pharmaceutical University,Shenyang 110015,China;2.State Key Laboratory of Proteomics,Beijing Proteome Research Center,Beijing Institute of Radiation Medicine,Beijing 102206,China;3.Institute of Chemical Defense,Beijing 102205,China)
Guanidination plays an obvious role in identification and quantification of proteins.A quick microwave-assisted guanidination reaction method was established in this work.The reaction conditions,including buffer p H,concentration ofO-methylisourea hemisulfate and time of microwave heating,were optimized using a standard peptide.The peptide was microwave heated for 1 min with 1.5 mol/LO-methylisourea and near p H 12 of the mixture,the conversion rate of lysine to homoarginine was 99%.Further examination was carried out by applying this microwave-assisted guanidination method to tryptic digested peptides of myoglobin and bovine albumin.The average guanidination efficiency washigher than that reported in literature.Compared with the conventional guanidination methods,the microwave-assisted guanidination method can shorten reaction time,enhance reaction efficiency,and reduce side reactions on the N-terminal of peptides.
guanidination;microwave-assisted;peptides;protein quantification
O 657.63
A
1004-2997(2011)05-0257-08
2011-02-14;
2011-06-01
國家高技術研究發展計劃(2006AA02A308)、國家自然科學基金項目(30621063,20635010,20735005,20875101)、973計劃(2007CB914104、2010CB912701、2011CB910603)資助
王雪穎(1988~),女(漢族),天津人,碩士研究生,藥物分析專業。E-mail:piaopiaoxiaoxue@126.com
錢小紅(1955~),女(漢族),江蘇人,研究員,從事蛋白質組學研究。E mail:qianxh1@yahoo.com.cn

