植物來源的抗腫瘤藥物研究進展
王超磊,孫炳峰,姚和權,吳曉明,徐進宜*
(1.中國藥科大學藥學院,江蘇南京 210009;2.中國科學院上海有機化學研究所,上海 200032)
植物來源的抗腫瘤藥物研究進展
王超磊1,2,孫炳峰2,姚和權1,吳曉明1,徐進宜1*
(1.中國藥科大學藥學院,江蘇南京 210009;2.中國科學院上海有機化學研究所,上海 200032)
綜述喜樹堿、紫杉醇、鬼臼毒素和combretastatin A-4等4類植物來源的抗腫瘤藥物的作用機制、構效關系及衍生物的研究進展。植物來源的抗腫瘤藥物已逐步在臨床腫瘤治療領域占據主導地位,而充分利用我國豐富的藥用植物資源,研發高效低毒的天然抗腫瘤藥物也已成為廣大藥學工作者的熱點課題。
天然活性產物;結構修飾;衍生物;抗腫瘤活性;作用機制;構效關系
惡性腫瘤是危害人類生命和健康的嚴重疾病之一。從植物中尋找有效的抗腫瘤藥物已成為國內外藥學研究者的熱點研究課題,從1981年到2008年的27年間已上市的抗腫瘤藥物中,有62.9%來自天然產物或其衍生物[1-2],可見天然產物在抗腫瘤藥物的研究與開發中的重要地位。目前,臨床上已經篩選出20多種植物來源的抗腫瘤藥物。
1 喜樹堿類藥物
1.1 抗腫瘤作用機制
DNA拓撲異構酶(Topo)是廣泛存在于生物體內的一類必需酶,通過調節DNA超螺旋、連鎖、去連鎖以及核酸解鏈作用而影響DNA拓撲結構,主要分為TopoⅠ和TopoⅡ,其中TopoⅠ已成為設計新型抗腫瘤藥物的重要靶酶。與TopoⅡ抑制劑相比,TopoⅠ抑制劑的抗腫瘤活性更高,抗瘤譜更廣。研究表明:喜樹堿(camptothecin,CPT,1)作為TopoⅠ抑制劑,并非通過抑制TopoⅠ的催化活性而發揮抗癌作用,而是通過與TopoⅠ-DNA可裂解復合物可逆性結合,形成CPT-TopoⅠ-DNA三元復合物,促進可裂解復合物的穩定,形成“路障”(road blocker),抑制復制叉(replication fork)的進程,從而導致細胞死亡[3]。
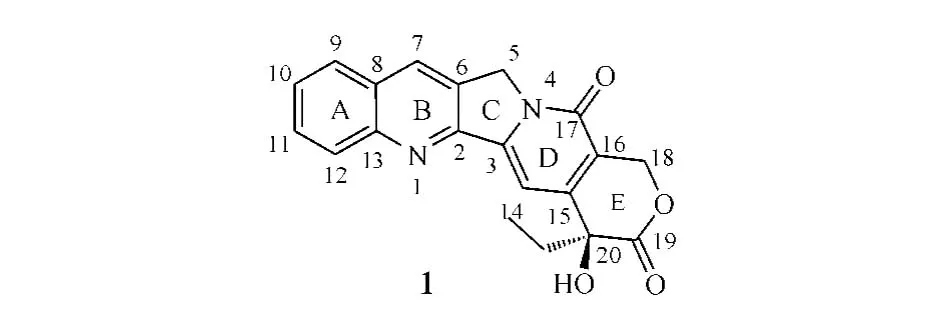
1.2 構效關系
CPT及其類似物是目前臨床上廣泛應用的一類特異性TopoⅠ抑制劑。喜樹堿最早于1966年從珙桐科植物喜樹(Camptothecaacuminate)根皮中分離出來,具有喹啉類生物堿內酯結構,A~D環的修飾對其活性會產生一定影響,而E環內酯環對其鍵合TopoⅠ更為必要,將E環水解開環或去除都會導致其抗癌活性完全消失。天然CPT水溶性較差,E環在生理條件下易開環而失去活性,因此其結構改造研究主要集中在增加其水溶性和E環穩定性方面。
研究發現,CPT及其衍生物結構中取代基的種類、數量和位置都會對其細胞毒活性產生影響。通常A環和B環(喹啉環)的修飾對化合物活性影響較小,7、9、11位引入合適的取代基可保持或提高化合物的活性并降低其毒性;C、D環的修飾或在12、14位引入取代基可使化合物活性降低或失去;在7位取代基上引入可形成氫鍵的基團能增強化合物與TopoⅠ的結合能力,從而提高其活性;E環只能耐受一些微小的修飾,例如,將六元內酯環擴環成七元內酯環,以提高內酯環穩定性及其化合物活性,而將20位羥基烷基化或酰化也可起到穩定內酯環及提高化合物活性的作用[4]。
1.3 結構修飾及相關衍生物
1.3.1 A環修飾喹啉環(A和B環)是CPT最常見的結構修飾位點,通過對其修飾改造,得到了許多水溶性較好、內酯穩定性增加、細胞毒活性較高的衍生物。目前已有3個此類CPT衍生物應用于臨床,其中,在A環10位上引入親水性基團以增加水溶性而得到的抗腫瘤前藥伊立替康(irinotecan,2),先后于1994年和1996年在日本和美國獲準上市,用于治療結腸直腸腫瘤;在A環9和10位上分別引入親水性基團叔胺基和羥基而得到的水溶性更高的拓撲替康(topotecan,3),于1996年被美國FDA批準上市,用作治療卵巢腫瘤的二線藥物,且其口服制劑于2007年在美國上市,用于治療復發性小細胞肺癌。
在伊立替康開發成功不久,美國Supergen公司又在一系列A環取代的CPT衍生物中發現9-氨基CPT在體內外都表現出很高的細胞毒活性,但進一步的研究發現其半衰期較短,水溶性和脂溶性均較差,且對光、熱、氧不穩定,給生產、儲存帶來困難,臨床使用受到限制。因此,研發者將注意力轉移到了合成9-氨基CPT時的中間體9-硝基CPT(rubitecan,4)上,其化學性質穩定,易獲得,可在體內轉化為活性形式——9-氨基CPT,該藥早在20世紀90年代中期已完成治療肺癌、乳腺癌、結腸直腸癌、卵巢癌、胃癌、前列腺癌、白血病和黑色素瘤等的Ⅰ、Ⅱ、Ⅲ期臨床研究,目前該化合物用于胰腺癌治療的研究仍處于Ⅲ期臨床試驗階段[5]。
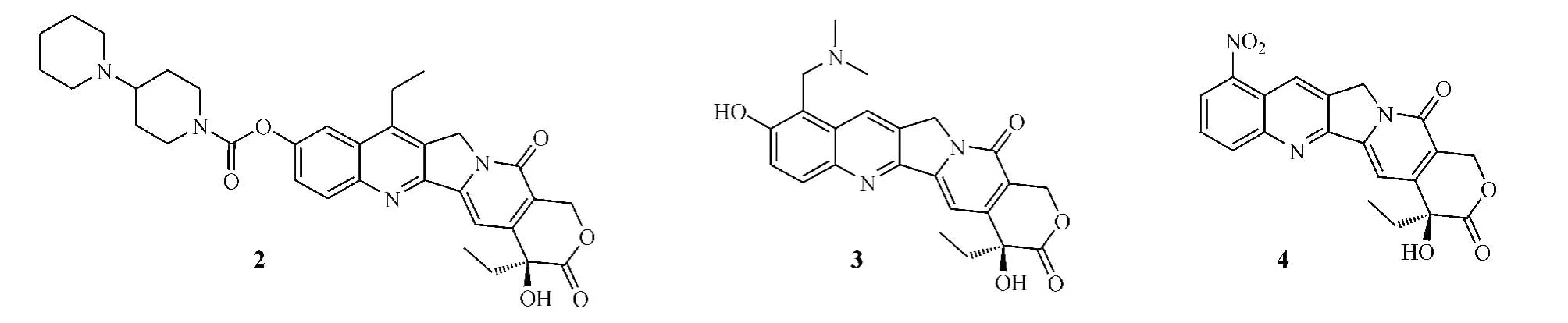
1.3.2 B環修飾在研究如何提高CPT類似物水溶性的同時,為了提高藥物的血液穩定性及細胞攝取率,實現口服給藥,人們又合成了一系列脂溶性CPT衍生物。其中,silatecans是B環7位連有硅烷基側鏈的一類CPT衍生物,硅烷基側鏈使得這類化合物具有很強的親脂性,更易于分布到脂質雙分子層中,避免被血漿中的酶快速降解,從而提高了生物利用度,改善了藥動學性質。其最具代表性的化合物是karenitecin(BNP1350,5)和DB-67(6)[6],前者是美國BioNumerik公司開發的半合成CPT衍生物。用4種異種移植腫瘤的裸鼠模型進行的試驗顯示,karenitecin的生物利用度達67%,而拓撲替康為30% (Schellens等,BrJCancer,1996年)。另有試驗表明:DB-67在SCID大鼠血漿中的半衰期為1.4 h,AUC為17 mg·h·L-1[7]。目前karenitecin治療非小細胞肺癌(NSCLC)、卵巢癌、乳腺癌、結腸癌和黑色素瘤的研究已進入Ⅲ期臨床試驗階段,用于治療成人轉移性實體腫瘤的研究也已進入Ⅰ期臨床試驗。
在B環7位上引入親水基團而得到的水溶性CPT衍生物貝洛替康(belotecan,CKD-602,7)于2004年被韓國食品藥品管理局批準上市,用于治療卵巢癌和小細胞肺癌。
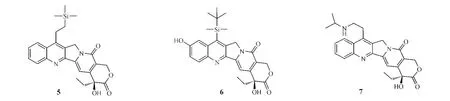
1.3.3 A和B環同時修飾魯托替康(lurtotecan,8)即是由葛蘭素史克公司開發的A和B環同時修飾的全合成水溶性CPT衍生物,對卵巢癌、乳腺癌和結腸癌等療效顯著。由于其7位引入了甲基哌嗪叔胺基團,10、11位引入了乙二氧基環,從而大大提高了水溶性和細胞毒活性。魯托替康在pH為5時在水中最大溶解量達5.8 g·L-1,而CPT和拓撲替康分別為0.003和3.1 g·L-1。細胞毒性試驗顯示,魯托替康的抗腫瘤活性為拓撲替康的3~5倍(Luzzio等,JMedChem,1995年);且臨床前體內試驗顯示,一定劑量的魯托替康可致裸鼠異種移植的HT29和SW48腫瘤縮小60%(Emerson等,CancerRes,1995年)。然而,Ⅰ期臨床研究發現魯托替康的療效并不理想,進而開發了魯托替康脂質體NX-211,目前NX-211治療卵巢癌、頭癌、頸癌和肺癌的研究已進入Ⅱ期臨床試驗階段[8]。
依沙替康(exatecan,DX-895951f,9)是日本Daiichi公司開發的水溶性CPT類似物,它以一個帶氨基的六元環相并合的結構將A和B環的7和9位連接,同時在A環10位引入甲基,11位引入氟原子,從而提高了E環內酯環的穩定性,水溶性也大大增加。臨床前研究顯示,依沙替康具有高抗癌活性,其抗乳腺癌、結腸癌、腎癌、胃癌、卵巢癌、肺癌和子宮癌的活性是拓撲替康的28倍(Mitsui等,JpnJ CancerRes,1995年)。目前,其治療肉瘤、膽管癌和肺癌的Ⅰ、Ⅱ期臨床試驗正在進行中,且治療局灶性和轉移性胰腺癌的研究也已進入Ⅲ期臨床試驗[9]。

1.3.4 C和E環修飾DRF-1042(10)是由印度Dr.Reddy制藥公司開發的、對C環修飾而得到的微水溶性半合成CPT衍生物,具良好的抗癌活性,臨床前研究顯示具較好的口服生物利用度和血漿穩定性[10]。Ⅰ期臨床試驗顯示,該化合物半衰期為9.9 h,對難治性實體瘤療效顯著,并具有較好的口服藥動學性質[11]。目前,該化合物正處于Ⅱ期臨床研究階段。
將六元內酯環擴大為3-羥基七元內酯環,即在羥基與羧基間引入亞甲基而獲得的新型高喜樹堿類化合物(homocamptothecins,hCPT,11),與CPT相比,其內酯環的穩定性大大增加,從而活性提高。在此類化合物中,具有代表性的化合物是Beaufour-Ipsen公司與Roche公司共同開發的diflomotecan (BN-80915,12),其在體外對HT29、A549和T24r腫瘤株的IC50分別達8.4、3.4和0.40 nmol·L-1,活性優于hCPT和CPT[12]。由于該化合物可與DNATopoⅠ形成三元不可裂解復合物,因此體內半衰期延長。目前,該化合物已進入Ⅱ期臨床研究,有望成為第一個上市的hCPT類Topo抑制劑[13]。
2 紫杉醇類藥物
2.1 抗腫瘤作用機制
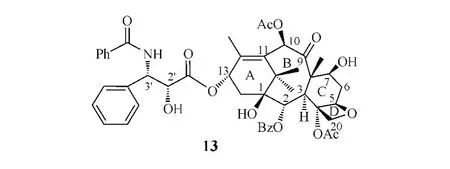
正常情況下,微管和微管蛋白二聚體之間存在動態平衡,有絲分裂時微管在鈣離子的作用下解聚,形成紡綞體和紡綞絲,牽引染色體向兩極移動。紫杉醇(paclitaxel,Taxol?,13)主要與β微管蛋白N端第31位氨基酸和第217~231位氨基酸結合,促進微管蛋白二聚體的形成和微管裝配,打破微管聚合與解聚的動態平衡,阻礙紡綞絲的形成,導致細胞周期停滯于G2/M期,使快速分裂的腫瘤細胞生長受抑并死亡。
2.2 構效關系
紫杉醇是1971年由Wani等首先從短葉紅豆杉中提取分離出來的具抗癌活性的二萜類化合物,1992年由美國FDA正式批準上市,用于治療晚期卵巢癌。目前紫杉醇已作為一線抗腫瘤藥物在40余國上市,而其半合成類似物多西他賽(docetaxel,Taxotere?,14)于1995年率先在墨西哥、南非上市,1998年在美國上市。雖然紫杉醇和多西他賽在臨床上得到了廣泛應用,但仍然有較多問題需要解決,例如水溶性較差以及易產生多藥耐藥性等。紫杉醇和多西他賽的多藥耐藥性的產生主要是由于它們易與P-糖蛋白結合而被代謝。因此,為了克服或部分克服這些缺點,研究者們對紫杉醇進行了一系列的結構改造,開發出多種新化合物實體。
紫杉醇13α位側鏈的空間分布及構象對其活性至關重要:其中2'R/3'S的立體構型和3'位的酰胺取代都是其活性所必需,若3'位酰胺被氨基取代則活性消失;而3'位苯基或苯基類似基團亦為活性所必需;另外,2'位游離羥基也是活性必需基團,羥基酰化后,其體外活性降低,但體內活性未受影響。
紫杉醇骨架的[6/8/6]稠合方式對其活性十分重要,若發生改變或開環,其促進微管聚合的作用降低,細胞毒性完全喪失;4、5、20位的四元氧環也與其活性密切相關,若無此環或開環則活性完全喪失; 1位羥基缺失,其活性下降;2位苯甲酰氧基和4位乙酰氧基的存在對其活性至關重要,若失去則活性大大下降;7、9、10位含氧基團的存在對其活性影響不大,但若10位氧化成酮則活性消失[14]。
2.3 結構修飾及相關衍生物
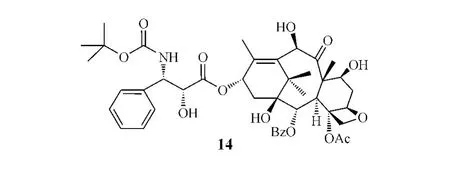
Larotaxel dehydrate(15)是由Sanofi-Aventis公司開發的紫杉醇衍生物,其8位甲基以環丙基替代,側鏈中苯甲酰基用叔丁氧羰基取代。它對耐多西他賽的白血病細胞系p-388有細胞毒作用,并可穿過血腦屏障,這可能是其對P-糖蛋白的親和力降低所致。Ⅱ期臨床研究顯示該化合物對耐紫杉醇的晚期乳腺癌有較高的治療指數[15],目前其正處于Ⅲ期臨床研究階段。
Cabazitaxel(16)是由Sanofi-Aventis公司開發的多西他賽二甲氧基衍生物,即在多西他賽的7和10位羥基上引入兩個甲基修飾而成,具有不被P-糖蛋白轉運外排、可穿過血腦屏障的優點[16],其與潑尼松聯用治療激素抵抗性前列腺癌的研究正處于Ⅲ期臨床試驗階段。
TPI-287(17)則是將紫杉醇側鏈上3'位苯基替換為異丁基,并在母核上引入了一個丙烯基縮醛結構,導致其與紫杉醇及多西他賽在結構上發生較大變化,從而使其難與P-糖蛋白相結合,避免了P-糖蛋白介導的藥物外排,克服了紫杉醇的多藥耐藥性。目前,該化合物處于Ⅰ/Ⅱ期臨床研究階段,用于治療晚期胰腺癌和激素抵抗性前列腺癌[17]。
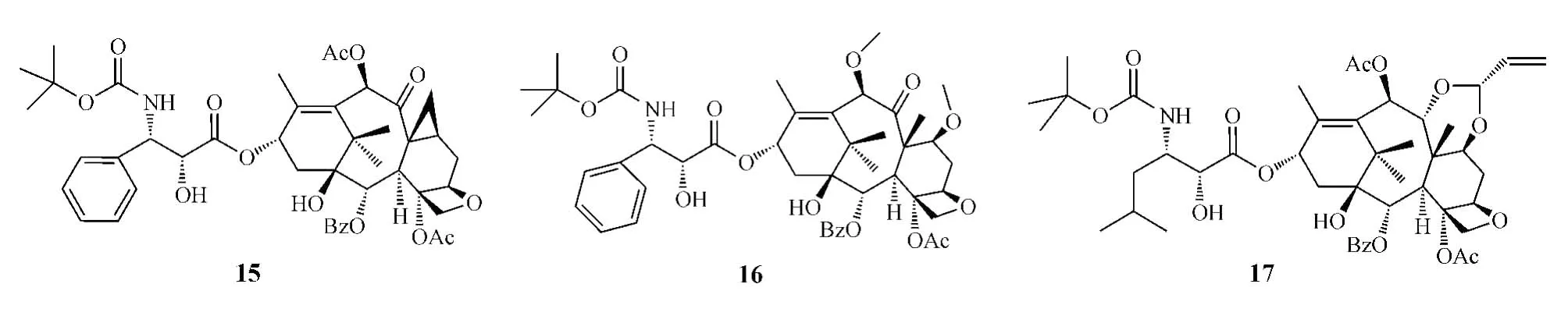
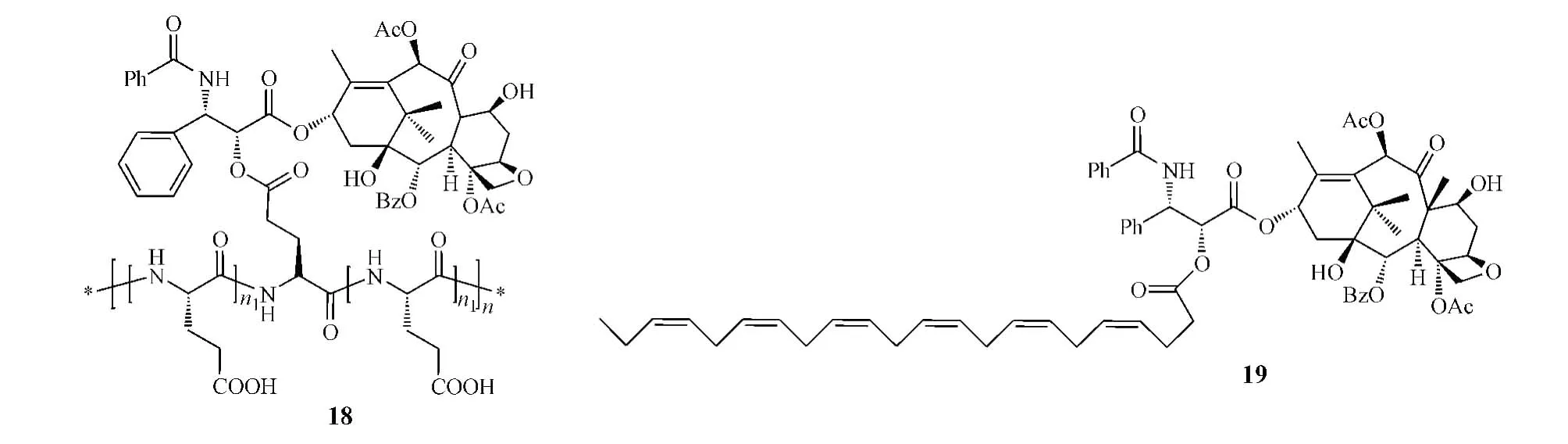
為提高紫杉醇的水溶性,改善其藥動學性質,有研究者將紫杉醇和水溶性高分子聚合物聚谷氨酸通過酯鍵連接而形成聚谷氨酸-紫杉醇偶聯物Xyotax (paclitaxel poliglumex,18)[18],該偶聯物為一前藥,可通過內吞作用進入細胞,在相關酶的作用下釋放出游離的紫杉醇而發揮抗腫瘤作用,且由于其較大的結構,不能被P-糖蛋白識別而避免了P-糖蛋白介導的藥物外排[19],同時由于其水溶性增加,避免了傳統紫杉醇藥物因為需使用表面活性劑而導致的一些副作用。目前,該前藥處于Ⅲ期臨床研究階段。
研究表明:由于癌細胞代謝速率加快,其對脂肪酸攝取量增加,因此將脂肪酸與化療藥物共價連接,可提高藥物對癌細胞的靶向性及治療指數。Taxoprexin(DHA-paclitaxel,19)便是紫杉醇和二十二烷六烯酸(DHA)通過酯鍵連接而形成的DHA-紫杉醇偶聯物[20]。臨床前研究顯示,該偶聯物在體外完全沒有活性,在血漿中轉化為活性紫杉醇的速率很低,而在癌細胞中的轉化率是血漿中的21倍,提高了藥物靶向性。在移植M109腫瘤小鼠中進行的實驗顯示,分別給予等摩爾劑量或等毒性劑量的該偶聯物和紫杉醇后,該偶聯物的AUC分別是紫杉醇的8倍或57倍[21]。目前,該偶聯物處于Ⅲ期臨床研究階段。
3 鬼臼毒素類藥物
3.1 抗腫瘤作用機制
研究表明:鬼臼毒素(podophyllotoxin,20)及其衍生物由于結構的不同主要有兩種抗腫瘤作用機制:鬼臼毒素本身可通過破壞有絲分裂的細胞中微管蛋白集結以及微管的形成,使細胞有絲分裂停滯在M期,干擾腫瘤細胞分裂,從而抑制腫瘤生長;而依托泊苷和替尼泊苷等鬼臼毒素的4'位去甲基衍生物則是以共價鍵形成穩定的藥物-DNA-TopoⅡ三元復合物,最終導致DNA單鏈及雙鏈的斷裂,使腫瘤細胞周期終止于G期(DNA合成前期)[22]。盡管鬼臼毒素及其衍生物與微管蛋白或TopoⅡ相互作用的方式尚不明確,但作為TopoⅡ抑制劑的鬼臼毒素衍生物與抑制微管蛋白聚合的衍生物在結構上的差異已比較明確,主要表現在TopoⅡ抑制劑衍生物的4'位甲氧基脫甲基成羥基、4位取代基為β構型以及4位上有大體積的取代基團。
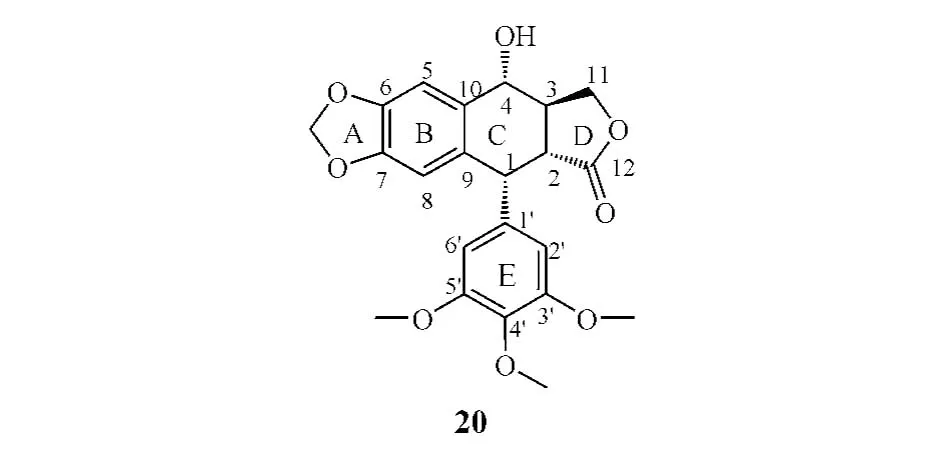
3.2 構效關系
鬼臼毒素是從小蘗科鬼臼屬植物中提取到的木質素類抗腫瘤活性成分,具有顯著的抗腫瘤活性,但毒副作用也較大,尤其是對胃腸道的毒性較大,不適于臨床使用。為了提高其細胞毒活性和TopoⅡ抑制活性,降低毒副作用,人們嘗試對其A、C、D、E環進行廣泛修飾,合成了大量衍生物。現已發現對A環的修飾往往會造成化合物活性降低,因此目前進入臨床應用及臨床研究的鬼臼毒素衍生物均為C、E環修飾產物,且大多為TopoⅡ抑制劑。
研究表明:作為TopoⅡ抑制劑的鬼臼毒素衍生物,其C環4位取代基必須為β構型,若為α構型則活性顯著降低;4'位羥基為活性所必需;D環反式γ-內酯環是其具有強效抗腫瘤活性的一個重要結構[23],但近年來,也有諸多文獻報道了具抗腫瘤活性的D環開環的鬼臼毒素衍生物[24-26];此外,A環間二氧戊環以及E環也是活性必需結構。
3.3 結構修飾及相關衍生物
早在20世紀60年代,瑞士Sandoz公司先后半合成了兩個鬼臼毒素的糖苷化合物,即依托泊苷(etoposide,21)和替尼泊苷(teniposide,22),它們均為C、E環修飾的衍生物,具有高抗腫瘤活性,均被美國FDA批準上市,廣泛用于睪丸癌、淋巴癌、白血病、NSCLC等的臨床治療,且依托泊苷的水溶性前藥、注射用磷酸依托泊苷(etopopohos,23)也獲準上市。然而,這類化合物存在水溶性差及易產生獲得性耐藥、骨髓抑制和嚴重的胃腸道反應等缺點[27]。因此,尋找高效低毒、對多藥耐藥腫瘤細胞有效的鬼臼毒素類抗腫瘤藥物已成為當前研究熱點。
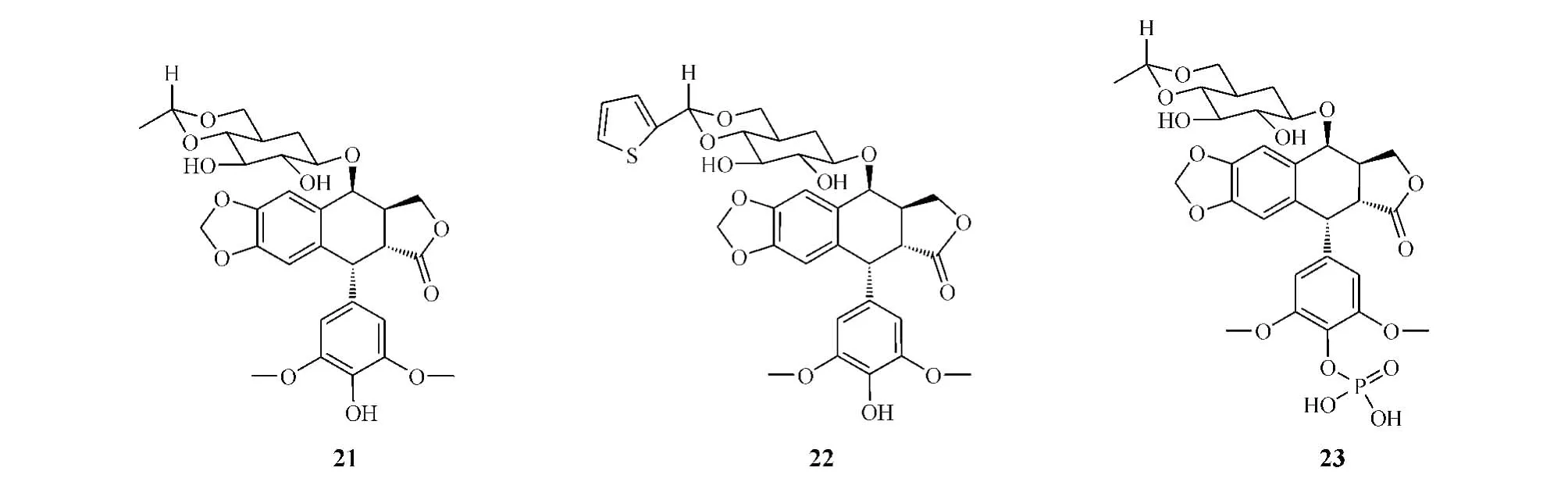
由日本Nippon Kayaku公司研發的NK-611 (24)是用一個二甲胺基取代依托泊苷C環上乙叉糖苷部分的2″位羥基而獲得的鬼臼毒素衍生物,二甲氨基的引入使得其水溶性顯著提高,達依托泊苷的120倍。研究人員發現,NK-611對TopoⅡ有很強的抑制作用,對多種人類癌細胞系,包括肺癌、胃腸道癌、卵巢癌、辜丸癌、乳腺癌、頭頸癌和白血病等都有很好的細胞毒活性,且對人類腫瘤異種移植模型也有較高抗腫瘤活性。其藥效與依托泊苷相當,但依托泊苷和NK-611會產生交叉耐藥性。目前,該化合物已進入Ⅱ期臨床研究階段(Rassmann等,InvestNewDrugs,1999年)。
GL-331(25)是在C環上引入4-硝基苯胺基、E環脫去一個甲基而得到的鬼臼毒素衍生物,與依托泊苷相比,其在體內外實驗中都表現出較強的抗腫瘤活性。對KB細胞系的細胞毒活性測試顯示,依托泊苷和GL-331對腫瘤細胞的ID50分別為0.49和0.2μmol·L-1,而對TopoⅡ的ID50分別為50和10μmol·L-1(Wang等,JMedChem,1990年)。用鼻咽癌、結腸癌、肝癌、胃癌、宮頸癌和結腸癌細胞進行的試驗顯示,GL-331對這些癌細胞的ID50在0.5~2μmol·L-1之間,是依托泊苷的3~10倍(Huang等,CancerLett,1996年)。該化合物目前已進入Ⅱ期臨床研究階段,主要用于耐依托泊苷的惡性腫瘤的治療[28]。
TOP-53(26)是在C環上引入了一個乙基二叔胺基團而獲得的鬼臼毒素衍生物,與依托泊苷相比,是一個更有效的TopoⅡ抑制劑,對TopoⅡ的抑制活性是依托泊苷的2倍(IC50分別為59和106μmol·L-1);且在細胞模型和動物模型中,對多種不同腫瘤細胞系都有較好的抑制活性,尤其對NSCLC的療效更好(Utsugi等,CancerRes,1996年)。研究發現,TOP-53能特異性地分布到肺部,因而更適用于肺癌的治療[29]。目前,該化合物正處于Ⅱ期臨床研究階段。
4 Combretastatin A-4類藥物
4.1 抗腫瘤作用機制
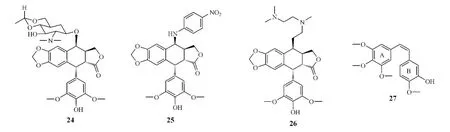
Combretastatins是Pettit小組從南非植物Combretumcaffrum中提取分離的具有抗腫瘤活性的系列天然二苯乙烯類化合物,體外試驗表明:其具有較高的抑制腫瘤細胞增殖活性,其中combretastatin A-4(CA-4,27)的活性最強,它不僅對腫瘤細胞(包括多藥耐藥腫瘤細胞)的增殖具有抑制活性,而且還可有效抑制微管蛋白聚合以及選擇性抑制腫瘤血管增生。
研究顯示,CA-4能夠競爭性抑制微管與秋水仙堿的結合,表明CA-4具有與秋水仙堿相似的微管結合位點,可致腫瘤細胞和內皮細胞周期阻滯于G2/M期。CA-4的抗腫瘤血管作用機制與血管生成抑制劑不同,后者僅阻止新血管的生成,而CA-4則可特異性靶向破壞已生成的腫瘤血管,使腫瘤缺失氧氣和營養供給,從而導致腫瘤“餓死”[30]。
4.2 構效關系
CA-4雖然在體外實驗中表現出良好的抗癌活性,但因水溶性差,且順式二苯乙烯結構不穩定,易異構化成反式構型,其體內活性并不能令人滿意。因此,藥物化學家們對CA-4進行結構修飾,合成了數百個CA-4衍生物。由于CA-4結構簡單,且A環的修飾往往導致化合物活性降低,故對其修飾主要圍繞B環進行,目前進入臨床研究的CA-4衍生物大多是B環修飾產物。
研究表明:三甲氧基苯環(A環)是CA-4類化合物具有細胞毒性和抑制微管蛋白活性所必需的,這可能是由于3個甲氧基在空間結構上更有利于化合物與作用位點結合;保持CA-4衍生物的順式結構和A、B兩環間存在剛性基團,是化合物獲得較高的細胞毒性和微管蛋白抑制活性的必要保證,因為這樣可使A、B兩環分別與微管蛋白的α和β鏈上兩處結合位點的作用更加緊密;B環的4位甲氧基也可用一些小分子的取代基,如甲基、鹵素等取代,而對B環羥基的修飾可形成CA-4前藥,增強療效[31]。
4.3 結構修飾及相關衍生物
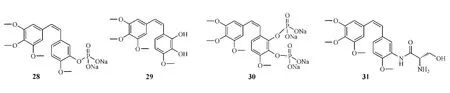
將CA-4的B環上3位羥基磷酸化而得到的高水溶性前藥CA-4磷酸二鈉鹽(CA-4P,28)能有效抑制微管蛋白的聚合,IC50為(214±1.4)μmol·L-1(Lin等,MolPharmacol,1988年)。體內研究顯示,給原位和皮下移植實體瘤的小鼠腹腔注射CA-4P 100 mg·kg-1(300 mg·m-2)6 h后,小鼠腫瘤血管容積減少90%,腫瘤血流減少50%~60%(Chaplin等,AnticancerRes,1999年)。由于在臨床前研究中顯示出較明顯的體內外抗腫瘤作用,CA-4P已于2002年進入臨床研究,并于2006年5月被美國FDA批準為罕見病藥物,用于治療卵巢癌患者,尤其是與卡鉑和紫杉醇聯用,治療對鉑類藥物產生耐藥性的患者及未分化、髓樣、Ⅳ期乳頭狀和Ⅳ期濾泡型甲狀腺癌患者。該藥也在歐洲獲得了罕見病藥物資格,用于治療未分化甲狀腺癌患者。其用于治療不同腫瘤的研究目前在歐美正處Ⅰ/Ⅱ/Ⅲ期臨床試驗階段[32-33]。
對天然產物combretastatin A-1(CA-1,29)進行結構修飾而獲得的二磷酸衍生物OXi4503(30)由美國OXiGENE公司研制。臨床前研究顯示,該藥對CaNT乳腺癌鼠模型的療效顯著,其腹腔注射1 mg· kg-1后,腫瘤血管容積減少50%;當劑量加大到10、25、50 mg·kg-1時,腫瘤血管容積減少80%以上;當給藥劑量達100、200和400 mg·kg-1時,腫瘤細胞生長明顯受抑[34]。OXi4503目前正處Ⅰ期臨床研究階段。
Ombrabulin(AVE8062,31)是Sanofi-Aventis公司研發的水溶性CA-4前藥,即CA-4的B環上3位羥基被生物電子等排體胺基取代而獲得的衍生物,其在水中的最大溶解量是14.7 g·L-1,高于CA-4的0.11 g·L-1(Ohsumi等,AnticancerDrugDes,1999年)。動物實驗顯示,該藥能抑制腫瘤增殖,在近40種腫瘤動物模型中,其靜脈注射給藥后24 h內,均觀察到腫瘤發生缺血性壞死[35];且在給藥30 min后,腫瘤血流完全停滯,而正常組織血流僅少量減少,并在24 h內即恢復至給藥前水平[36]。目前,該藥已進入Ⅲ期臨床研究,用于治療NSCLC[37]。
5 結語
從植物中尋找開發有效抗腫瘤新藥的前景是廣闊的。目前,眾多不同結構和作用機制的天然活性產物已成為國內外抗腫瘤新藥研究的熱點,如冬凌草甲素(oridonin)、白樺酸(betulinic acid)、23-羥基白樺酸(23-hydroxy betulinic acid)等萜類化合物,由于其獨特的結構和良好的抗腫瘤活性,正引起越來越多的藥學工作者的重視,其中白樺酸在國內作為抗黑色素瘤藥物正處于Ⅰ期臨床研究階段,冬凌草甲素正處在申報新藥階段。筆者所在課題組對23-羥基白樺酸以及冬凌草甲素的結構修飾研究也取得一定進展,已初步獲得這些化合物的構效關系,并看好它們的進一步研究價值和應用前景[38-42]。
在我國連續啟動的兩批重大新藥創制項目中,植物來源藥物特別是利用我國植物資源的天然藥物的研發都被列為重點支持對象。由于植物來源的抗腫瘤藥物的作用機制獨特,抗癌療效顯著,已在臨床應用上逐步占據主導地位。但是這些藥物也存在選擇性差,易產生毒副作用及耐藥性,甚至殺死正常細胞等問題。因此,在從天然產物中尋找安全、經濟和高選擇性的抗癌活性物的基礎上,對這些植物來源的化合物進行結構修飾,以獲得低毒性、高活性的抗腫瘤候選新藥,仍然是今后藥學研究者的努力方向。有理由相信,隨著人們對天然產物研究的深入,從天然產物中提取有效成分,并通過對其進行結構簡化和修飾,必將會有更多的抗腫瘤活性成分被研發出來,并應用于臨床。
[1]Cragg G M,Newman D J.Impact of natural products on developing new anti-cancer agents[J].Chem Rev,2009,109(7):3012-3043.
[2]Mohammad S.Anticancer agents from medicinal plants[J].Bangladesh J Pharmacol,2006,1(2):35-41.
[3]Liu L F,Desai SD,Li T K,et al.Mechanism of action of camptothecin[J].Ann NY Acad Sci,2000,922(1):1-10.
[4]Li Q Y,Zu Y G,Shi R Z,et al.Review camptothecin:current perspectives[J].Curr Med Chem,2006,13(17): 2021-2039.
[5]Liew ST,Yang L X.Design,synthesis and developmentof novel camptothecin drugs[J].Curr Pharm Des,2008,14 (11):1078-1097.
[6]Basili S,Moro S.Novel camptothecin derivatives as topoisomerase I inhibitors[J].Expert Opin Ther Patents,2009,19(5):555-574.
[7]ZamboniW C,Jung L L,Strychor S,et al.Plasma and tissue disposition of nonliposomal DB-67 and liposomal DB-67 in C.B-17 SCID mice[J].Invest New Drugs,2008,26 (5):399-406.
[8]Flaherty K T,Stevenson JP,Twelves C J,et al.The clinical development of lurtotecan:experience with water-soluble and liposomal forms[M]∥Adams Val R,Burke T G.Cancer Drug Discovery and Development:Camptothecins in Cancer Therapy(PartⅡ).Totowa:Humana press,2005:301-316.
[9]Abou-Alfa G K,Letourneau R,Harker G,etal.Randomized PhaseⅢstudy of exatecan and gemcitabine compared with gemcitabine alone in untreated dvanced pancreatic cancer[J].J Clin Oncol,2006,24(27): 4441-4447.
[10]Upreti V V,Mamidi R N,Katneni K,et al.Quantitative determination of DRF-1042 in human plasma by HPLC: validation and application in clinical pharmacokinetics[J].Biomed Chromatogr,2003,17(6):385-390.
[11]Chatterjee A,Digumarti R,Katneni K,et al.Safety,tolerability,and pharmacokinetics of a capsule formulation of DRF-1042,a novel camptothecin analog,in refractory cancer patients in a bridging phase I study[J].J Clin Pharmacol,2005,45(4):453-460.
[12]Lavergne O,Demarquay D,Bailly C,et al.Topoisomerase I-mediated antiproliferative activity of enantiomerically pure fluorinated homocamptothecins[J].J Med Chem,2000,43(11):2285-2289.
[13]Kroep JR,Gelderblom H.Diflomotecan,a promising homocamptothecin for cancer therapy[J].Expert Opin Investig Drugs,2009,18(1):69-75.
[14]FangW S,Liang XT.Recentprogress in structure activity relationship and mechanistic studies of taxol analogues[J].Mini Rev Med Chem,2005,5(1):1-12.
[15]Metzger-Filho O,Moulin C,Evandro A,et al.Larotaxel: broadening the road with new taxanes[J].Expert Opin Investig Drugs,2009,18(8):1183-1189.
[16]Tuma R S.Cabazitaxelmay be new second-line standard for patients with castrate-resistant prostate cancer[J].Oncol Times,2010,32(8):44-46.
[17]Chen SM,Meng L H,Ding J.New microtubule-inhibiting anticancer agents[J].Expert Opin Investig Drugs,2010,19(3):329-343.
[18]Bonomi P.Paclitaxel poliglumex(PPX,CT-2103):macromolecular medicine for advanced non-small-cell lung cancer[J].Expert Rev Anticancer Ther,2007,7(4): 415-422.
[19]Singer JW,Baker B,De Vries P,et al.Poly-(L)-glutamic acid-paclitaxel(CT-2103)[XYOTAX],a biodegradable polymeric drug conjugate:characterization,preclinical pharmacology,and preliminary clinical data[M]∥Maeda H,Kabanov A,Kataoka K,et al.Polymer Drugs in the Clinical Stage:Advantage and Prospects.New York:Kluwer Academic/Plenum Publishers,2003:81-99.
[20]Jones R J,Hawkins R E,Eatock M M,et al.A phase II open-label study of DHA-paclitaxel(Taxoprexin)by 2-h intravenous infusion in previously untreated patients with locally advanced ormetastatic gastric or oesophageal adenocarcinoma[J].Cancer Chemother Pharmacol,2008,61 (3):435-441.
[21]Bradley M O,Webb N L,Anthony FH,et al.Tumor targeting by covalent conjugation of a natural fatty acid to paclitaxel[J].Clin Cancer Res,2001,7(10):3229-3238.
[22]Srivastava V,Negi A S,Kumaar JK,etal.Plant-based anticancer molecules:a chemical and biological profile of some important leads[J].Bioorg Med Chem,2005,13 (21):5892-5908.
[23]Liu Y Q,Yang L,Tian X.Podophyllotoxin:current perspectives[J]Curr Bioact Compd,2007,3(1):37-66.
[24]Castro M A,Jose M,CorralM,etal.Synthesis and biological evaluation of new podophyllic aldehyde derivatives with cytotoxic and apoptosis-inducing activities[J].JMed Chem,2010,53(3):983-993.
[25]Gordaliza M,Castro M A,Miguel JM,et al.Synthesis and cytotoxic evaluation of C-9 oxidized podophyl-lotoxin derivatives[J].Bioorg Med Chem,2007,15(4): 1670-1678.
[26]Larsson O,Axelson M.Use of cyclolignans and new cyclolignans:US,7709526B2[P].2010-05-04.
[27]Mukherjee A K,Basu S,Sarkar N,et al.Advances in cancer therapy with plant based natural products[J].Curr Med Chem,2001,8(12):1467-1486.
[28]Liu JM,Chen L T,Chao Y,etal.Phase IIand pharmacokinetic study of GL331 in previously treated Chinese gastric cancer patients[J].Cancer Chemother Pharmacol,2002,49(5):425-428.
[29]Masahiko Y,Takashi K,Kumio A,etal.Specific distribution of TOP-53 to the lung and lung-localized tumor is determined by its interaction with phospholipids[J].Clin Cancer Res,2000,6(11):4396-4401.
[30]任萱,林莉萍,丁健.Combretastatin A4的抗腫瘤作用研究進展[J].中國新藥雜志,2007,16(17): 1336-1340.
[31]Chaudhary A,Pandeya SN,Kumar P,et al.Combretastatin A-4 analogs as anticancer agents[J].Mini Rev Med Chem,2007,7(12):1186-1205.
[32]Rustin G J,Shreeves G,Nathan P D,et al.A Phase Ib trial of CA4P(combretastatin A-4 phosphate),carboplatin,and paclitaxel in patients with advanced cancer[J].Br JCancer,2010,102(9):1355-1360.
[33]Samarin J,Rehm M,Krueger B,et al.Up-regulation of connective tissue growth factor in endothelial cells by the microtubule-destabilizing agent combretastatin A-4[J].Mol Cancer Ther,2009,7(2):180-188.
[34]Hill S A,Tozer G M,Pettit G R,et al.Preclinical evaluation of the antitumour activity of the novel vascular targeting agent Oxi 4503[J].Anticancer Res,2002,22 (3):1453-1458.
[35]Hori K,Saito S.Microvascular mechanisms by which the combretastatin A-4 derivative AC7700(AVE8062) induces tumour blood flow stasis[J].Br J Cancer,2003,89(7):1334-1344.
[36]Hori K.Antineoplastic strategy:Irreversible tumor blood flow stasis induced by the combretastatin A-4 derivative AVE8062(AC7700)[J].Chemotherapy,2005,51(6): 357-360.
[37]Delmonte A,Sessa C.AVE8062:a new combretastatin derivative vascular disrupting agent[J].Expert Opin Investig Drugs,2009,18(10):1541-1548.
[38]Bi Y,Xu JY,Wu XM,et al.Synthesis and cytotoxic activity of 17-carboxylic acid modified 23-hydroxy betulinic acid ester derivatives[J].Bioorg Med Chem Lett,2007,17 (5):1475-1478.
[39]Xu JY,Yang JY,Ran Q,et al.Synthesis and biological evaluation of novel 1-O-and 14-O-derivatives of oridonin as potential anticancer drug candidates[J].Bioorg Med Chem Lett,2008,18(16):4741-4744.
[40]劉宏民,閻學斌,劉振中.冬凌草甲素衍生物及其制備方法:中國,99101179.1[P].2000-06-07.
[41]徐進宜,吳曉明,楊靜怡,等.冬凌草甲素類衍生物、其制備方法及用途:中國,200710133915.X.[P].2010-06-02.
[42]Willmann M,Wacheck V,Buckley J,et al.Characterization of NVX-207,a novel betulinic acid-derived anticancer compound[J].Eur J Clin Invest,2009,39(5): 384-394.
Progresses in Study on the Plant-originated Anti-tumor Drugs
WANG Chao-lei1,2,SUN Bing-feng2,YAO He-quan1,WU Xiao-ming1,XU Jin-yi1
(1.SchoolofPharmacy,ChinaPharmaceuticalUniversity,Nanjing210009,China;2.ShanghaiInstituteof OrganicChemistry,ChineseAcademyofSciences,Shanghai200032,China)
The recent progresses in the mechanism of action and structure-activity relationship of four classes of the plant-originated anti-tumor drugs,camp to therins,paclitaxels,podophyllotoxins and combretastatin A-4,as well as their derivatives have been summerized in this paper.The plant-originated antitumor drugs have been gradually dominated in the clinical cancer treatment.Taking full advantage of rich resources of medicinal plants in China and developing new natural anti-tumor drugswith high activity and low toxicity have now become a hot topic studied by pharmaceutical researchers.
active natural product;structure modification;derivatives;anti-tumor activity;mechanism of action;structure-activity relationship
R979.1
A
1001-5094(2011)05-0193-10
10.3969/j.issn.1001-5094.2011.05.001
[接受日期]2011-03-03
[項目資助]國家自然科學基金項目(No.30973610);教育部科學技術研究重點項目(No.108069)
*通訊作者:徐進宜,教授;
研究方向:天然活性產物的結構修飾、半合成及生物活性研究;
Tel:025-83271445;E-mail:jinyixu@china.com
(責任編輯:范鳴)

