醫用耗材分類編碼與統一高效的監管體系
韓春雷 陳默蓉
1 醫用耗材分類編碼是統一高效的監管體系的基礎
長期以來,醫用耗材尤其是高值耗材管理在各醫療機構中并不規范。由于醫用耗材屬于流動資產,各醫療機構以及衛生主管部門往往把管理的重點放在供應及時和資產安全上。事實上,供應及時和資金安全僅僅是醫用耗材管理中最簡單、最基本的要求。醫療機構應該把更多的精力放在醫用耗材的應用安全和滿足可追溯的需要上。
近幾年,醫用耗材的管理越來越引起各級醫療機構的重視。各醫療機構為了管理的需要,紛紛開發了個性化的醫用耗材管理系統。在開發醫用耗材管理系統的過程中,各醫療機構都會面臨有沒有統一的醫用耗材分類編碼、能否利用耗材現有的條形碼這兩個問題。
一方面,由于沒有統一的醫用耗材分類代碼,各醫療機構在開發管理系統時只能根據各自的理解和需要對醫用耗材進行分類和編碼。另一方面,醫用耗材尤其高值耗材主要從國外進口,不同國家、不同廠家的編碼并不遵循相同的編碼規則,導致各廠家條形碼無法兼容。醫療衛生機構在管理進口醫用耗材時只能放棄各廠家現有的條形碼,通過人工的方式將醫用耗材的各項信息錄入信息系統,造成重復勞動,浪費了大量的人力、物力,整個供應鏈的效率極低。另外,由于人工錄入時不可避免地出現一些差錯,導致賬實不能嚴格相符,造成患者使用耗材型號、批號等詳細信息有可能出現張冠李戴。當醫用耗材發生質量問題時,給追溯工作造成麻煩,無法完全滿足可追溯的要求。國產醫用耗材也存在同樣的問題,各廠家自行編寫條形碼,供應鏈的各個環節條塊分割,致使各醫療機構對醫用耗材的管理無法實現統一。
從降低管理成本、加強醫療安全及構建高效的監管體系的角度,有必要統一醫用耗材分類編碼,提高對醫用耗材的管理效率。
2 醫用耗材分類編碼應該得到相關各方共同的支持
2.1 醫用耗材分類編碼應取得衛生行政部門的支持
1999年1月21日,衛生部在修訂《全國衛生系統醫療器械、儀器設備(商品、物資)分類與代碼》WZB01-90的基礎上,發布中華人民共和國行業標準《全國衛生行業醫療器械、儀器設備(商品、物資)分類與代碼》WS/T 118-1999。
2.2.1 該標準保持了GB7635-1987《全國工農業產品(商品、物資)分類與代碼》設置的門類,用英文字母表示其順序,如R表示普通機械。其中人工臟器及功能輔助裝置6846、口腔科材料6863、衛生材料及敷料6864、醫用縫合材料及凝固材料6865、醫用高分子制品6866、醫用橡膠材料6867。
2.2.2 該標準按物資的基本屬性和使用方向分類,為層次代碼結構,不包括門類,共分為4層,每層由兩位數字表示。每層均適當留有空碼,以備增加或調整類目的需要。各層中數字為“99”的代碼均表示收容類目。第四層數字代碼表示具體名稱。如人工心肺機泵管68671711、人造血管68461401、其他人工管道68461499等。
2.2.3 該標準涵蓋了基本醫用耗材,分類比較細,但自1999年以來沒有更新,新增的耗材特別是高值耗材如支架、導管、封堵器等無法歸類。而且,該標準以“建立統一的經濟核算和物資管理制度,實現經濟、技術信息的自動化”為出發點和目標,無法體現現代的管理要求,滿足統一高效的監管體系的需要。
2008年,衛生部委托中國醫學裝備協會對“全國衛生行業醫療器械、儀器設備(商品、物資)分類與代碼”(WS/T 118-1999)進行修訂。修訂過程中,對介入、骨科等部分高值醫用耗材的分類與代碼也進行了考慮。但是,僅僅在“全國衛生行業醫療器械、儀器設備(商品、物資)分類與代碼”框架內編寫醫用耗材代碼,難以滿足現代醫用耗材管理的實際需要。就心血管介入產品的球囊為例,在臨床應用中根據學科不同分為介入球囊、外周動脈球囊、結構心臟病專用球囊、瓣膜病球囊、大血管病變球囊,因而要求編碼要更加細化、完善,使每一個品目都能有其相對應的編碼,而不是歸入大類中。
醫用耗材雖然多為一次性使用,但與儀器設備相比使用量巨大,特別是植入類與介入類耗材使用風險不亞于某些搶救設備,使用期限往往比儀器設備更久,甚至伴隨患者終生。所以,對耗材管理信息全面性的要求更強,對其分類編碼應執行更加嚴格的標準。
2.2 醫用耗材分類編碼應取得藥監部門的支持
國家食品藥品監督管理局2000年發布了《醫療器械分類規則》(國家食品藥品監督管理局令第15號)。2001年,根據《醫療器械監督管理條例》及《醫療器械分類規則》,藥監局組織對原國家醫藥管理局1998版《中國醫療器械產品分類目錄》進行了全面的修訂調整。
2002年8月28日,藥監局發布了《醫療器械分類目錄》(國藥監械[2002]302號)(見下目錄)。該分類方法執行在“分類規則”指導下的目錄分類制,使用風險是制定產品分類目錄的基礎。分類目錄盡可能適應管理的需要,做到科學合理。依據《醫療器械分類目錄》不能確定醫療器械分類時,由省級藥品監督管理局根據分類規則進行預先分類,報國家食品藥品監督管理局核定。《醫療器械分類目錄》按GB7635-87《全國工農業產品(商品、物資)分類與代碼》和國家醫藥管理局、衛生部、總后衛生部、國家中醫藥局聯合制定的《醫療器械產品(商品、物資)分類與代碼》標準要求編排,分類規則與WS/T118-1999基本一致。
但是,《醫療器械分類目錄》實行的編碼比較簡單,如植入材料和人工器官6846、口腔科材料6863、醫用衛生材料及敷料6864、醫用縫合材料及粘合劑6865、醫用高分子材料及制品6866、介入器材6877。
2003年以來,國家食品藥品監督管理局每年都對《醫療器械分類目錄》進行了多次增補,編碼規則一直沒有根本性改變,編碼層級也沒有提高,遠遠無法滿足由于學科的不斷進步和發展而增加的耗材品目及可追溯等管理需要。
國家食品藥品監督管理局負責醫用器械的注冊審批和監管,醫用耗材分類與編碼應取得國家食品藥品監督管理局的大力支持,在準入環節把好關,各醫療機構的管理工作就能更好、更統一的開展。
醫療器械分類目錄(2002)
01.《醫療器械分類目錄》的說明 02.6801基礎外科手術器械
03.6802 顯微外科手術器械 04.6803神經外科手術器械
05.6804 眼科手術器械 06.6805耳鼻喉科手術器械
07.6806 口腔科手術器械 08.6807胸腔心血管外科手術器械
09.6808 腹部外科手術器械 10.6809泌尿肛腸外科手術器械
11.6810 矯形外科(骨科)手術器械 12.6812婦產科用手術器械
13.6813 計劃生育手術器械 14.6815注射穿刺器械
15.6816 燒傷(整形)科手術器械 16.6820普通診察器械
17.6821 醫用電子儀器設備 18.6822 醫用光學器具、儀器及內窺鏡設備
19.6823 醫用超聲儀器及有關設備 20.6824醫用激光儀器設備
21.6825 醫用高頻儀器設備 22.6826物理治療及康復設備
23.6827 中醫器械 24.6828醫用磁共振設備
25.6830 醫用X射線設備 26.6831醫用X射線附屬設備及部件
27.6832 醫用高能射線設備 28.6833醫用核素設備
29.6834 醫用射線防護用品、裝置 30.6840臨床檢驗分析儀器
31.6841 醫用化驗和基礎設備器具 32.6845體外循環及血液處理設備
33.6846 植入材料和人工器官 34.6854手術室、急救室、診療室設備及器具
35.6855 口腔科設備及器具 36.6856病房護理設備及器具
37.6857 消毒和滅菌設備及器具 38.6858醫用冷療、低溫、冷藏設備及器具
39.6863 口腔科材料 40.6864醫用衛生材料及敷料
41.6865 醫用縫合材料及粘合劑 42.6866醫用高分子材料及制品
43.6870 軟件 44.6877介入器材
2.3 醫用耗材分類編碼應取得生產企業的支持
2009年12月16日,國家食品藥品監督管理局發布《關于印發醫療器械生產質量管理規范(試行)的通知》(國食藥監械[2009]833號)。為更好地貫徹實施《醫療器械生產質量管理規范(試行)》,規范無菌和植入性醫療器械生產質量管理體系及其監督檢查工作,國家食品藥品監督管理局同時發布了《關于印發醫療器械生產質量管理規范無菌醫療器械實施細則和檢查評定標準(試行)的通知》(國食藥監械[2009]835號)和《關于印發醫療器械生產質量管理規范植入性醫療器械實施細則和檢查評定標準(試行)的通知》(國食藥監械[2009]836號)。
《醫療器械生產質量管理規范(試行)》是醫療器械生產質量管理體系的基本準則,適用于醫療器械的設計開發、生產、銷售和服務的全過程。《醫療器械生產質量管理規范(試行)》第十四條、第二十七條、第三十四條、第三十五條、第三十八條、第三十九條從不同角度提出了可追溯的要求。
2.3.1 第二十七條:“采購信息應當清楚地表述采購產品的要求,包括采購產品類別、驗收準則、規格型號、規范、圖樣,必要時包括過程要求、人員資格要求、質量管理體系要求等內容。生產企業應當根據可追溯性要求的范圍和程度,保持相關的采購信息。”
2.3.2 第三十八條:“生產企業應當建立可追溯性的程序并形成文件,規定醫療器械可追溯性的范圍、程度、唯一性標識和所要求的記錄。生產植入性醫療器械,在規定可追溯性要求時,應當包括可能導致醫療器械不滿足其規定要求的所有零件、部件和工作環境條件的記錄。同時生產企業應當要求代理商或經銷商保持醫療器械的分銷記錄以便追溯,需要時可獲得此記錄。”
2.3.3 醫療器械生產質量管理規范植入性醫療器械檢查評定標準(試行)檢查項目3002進一步提出“每一個產品都有唯一的標識符”(如:序列號、日期、批代碼、批號)可以追溯到操作源頭,向前可追溯到顧客,向后可追溯到生產過程中使用的組件、原材料和工作環境,體現了全過程風險管理的系統管理思想。
2.3.4 第五十七條對醫療器械不良事件監測提出了要求。第六十二條規定對存在安全隱患的醫療器械生產企業應當采取召回等措施。這一系列條例均建立在醫療器械唯一性標識和醫療器械的設計開發、生產、銷售和服務的全過程可追溯的基礎上。
隨著《醫療器械生產質量管理規范(試行)》及配套的實施細則和檢查評定標準的發布,并于2011年1月1日起開始實施,制定一套標準化的醫用耗材分類代碼成為許多生產企業的強烈愿望。
2.4 醫用耗材分類編碼應取得醫療機構的支持
2010年1月18日,國家衛生部發布《醫療器械臨床使用安全管理規范(試行)》(衛醫管發〔2010〕4號),規范了各醫療機構在醫用耗材的臨床使用時應注意的安全問題及要求。
2.4.1 《規范》第十二條規定“醫療機構應當按照國家分類編碼的要求,對醫療器械進行唯一性標識,并妥善保存高風險醫療器械購入時的包裝標識、標簽、說明書、合格證明等原始資料,以確保這些信息具有可追溯性。”
2.4.2 第二十條規定“醫療機構應當嚴格執行《醫院感染管理辦法》等有關規定,對消毒器械和一次性使用醫療器械相關證明進行審核……醫護人員在使用各類醫用耗材時,應當認真核對其規格、型號、消毒或者有效日期等,并進行登記。對使用后的醫用耗材等,屬醫療廢物的,應當按照《醫療廢物管理條例》等有關規定處理。”
2.4.3 第二十一條規定“臨床使用的大型醫用設備、植入與介入類醫療器械名稱、關鍵性技術參數及唯一性標識信息應當記錄到病歷中。”
以上條款對醫療器械使用環節的唯一性標識和可追溯性提出了要求,在規范了醫療機構醫療器械使用安全管理的同時,大大增加了醫護人員和醫療器械保障管理人員的工作量,增加了醫療器械臨床應用和醫療器械管理的難度,對建設和完善醫用耗材管理信息系統和臨床信息系統(CIS)提出了更高的要求。制定一套標準化的醫用耗材分類代碼成為各醫療機構的迫切要求。
2.5 醫用耗材分類編碼應取得政府采購機構和招標代理機構的支持
2004年,為規范高值醫用耗材采購行為,減輕患者不合理負擔,衛生部決定在北京、天津、遼寧、上海、浙江、湖北、廣東、重慶等8省市進行高值醫用耗材集中采購試點工作。2008年,衛生部組織了首次全國醫療機構高值醫用耗材集中采購工作。
對于集中采購而言,醫用耗材名稱和分類代碼始終是困擾招標代理機構的一個問題。由于沒有統一的名稱和標準的分類代碼,大大增加了招標代理機構的工作量,導致了大量的重復勞動,時間成本極高。甚至導致集中采購一再推遲,影響了新產品的使用和集中采購的規范。
為進一步解決各省的采購和配送問題,衛生部大力推動建立了以省為單位的集中招標采購和監督管理平臺,準備拓展集中采購范圍,逐步將檢驗試劑、醫用耗材及乙類大型設備納入其中。制定統一的名稱和標準的分類代碼,是各省順利實現醫用耗材集中采購和監督管理的基礎。
《2008年衛生部招標分類目錄》中心血管高值耗材的編碼方式如下:
第1、2位:
08代表心血管類
第3、4位:
10代表冠狀動脈介入類;
11代表心臟起搏器類;
12代表電生理導管類;
13代表周圍血管介入類產品;
第5、6位(以電生理導管類為例):
11~13代表標測導管;
22~24代表消融導管;
32~35代表其它導管。
第7、8位:……
2.6 醫用耗材分類編碼應盡可能取得海關的支持
海關根據進出口通關的需要,編制了《商品綜合分類表》,并每年進行調整。《商品綜合分類表》的第一列為商品編號,是10位編碼。前八位與《中華人民共和國進出口稅則》中的稅則號列和《中華人民共和國統計商品目錄》中的商品編號完全一致;第9、10位根據進口環節稅、進出口暫定稅和貿易管制需要而增設。《中華人民共和國進出口稅則》由國務院關稅稅則委員會辦公室、中華人民共和國財政部關稅司以世界海關組織《商品名稱及編碼協調制度公約》為基礎,結合我國進出口實際情況編制而成。《商品綜合分類表》對醫療器械尤其是高值耗材的描述較少。主要涉及部分醫療器械,如硫化橡膠(硬質橡膠除外)制的衛生及醫療用品編碼為4014000000或4014900000;導管、插管及類似品編碼為9018390000;心臟起搏器編碼為9021500000;其他彌補生理缺陷、殘疾用器具等(包括穿戴、攜帶或植入人體內的器具及零件)編碼9021900090……。
由于海關《商品綜合分類表》和《進出口稅則》編寫的目的是為了滿足進出口管理的需要,對醫療器械歸類不夠具體。一方面容易造成醫療耗材尤其是高值耗材進口環節監管上的疏失(走私、低報),另一方面與衛生部、食品藥品監督管理局的監管工作無法銜接。該編碼無法滿足醫療衛生行業醫療器械監管的需要。
2.7 醫用耗材分類編碼應盡可能取得中國物品編碼中心的支持
中國物品編碼中心于1988年經國務院同意成立,是統一組織、協調、管理全國的物品編碼與自動識別標識工作的專門機構,隸屬于國家質量監督檢驗檢疫總局。1991年4月中國物品編碼中心代表我國加入國際物品編碼協會(GS1,原名EAN International),是統一組織、協調、管理我國物品編碼與自動識別標識工作的專門機構。據統計,全球已有150多個國家采用GS1系統,在醫療衛生領域,日本、德國、英國、法國、澳大利亞等60多個國家采用GS1系統對藥品和醫療器械等醫療衛生產品進行標識管理。
GS1 Healthcare是自發的、全球性的醫療衛生領域應用者的團體,包括藥品和醫療器械制造商、零售商和經銷商、團購組織、醫院、藥店、物流供應商、政府管理實體及相關協會等。GS1 Healthcare的使命是將全球統一標識系統成功地引入醫療衛生領域,并集合領域內專家,保障患者安全和供應鏈效率。
為了全面做好全球通用的商品條碼技術體系在我國醫療衛生領域的應用推廣工作,中國物品編碼中心于2008年成立了醫療衛生推進工作組,工作范圍涉及醫藥POS、醫藥物流、醫院、醫保、醫藥數據庫等醫療衛生領域多方面工作。并于2007年首先試驗建立了植入性醫療器械與患者直接關聯的追溯系統,系統使用GS1標準標識醫療器械,并在上海地區的醫院得到應用。
綜上所述,衛生部、藥監局、各生產企業、各醫療機構、政府采購機構、海關、中國物品編碼中心都依據各自的工作要求編制了編碼,各編碼規則不同,不能互相兼容。
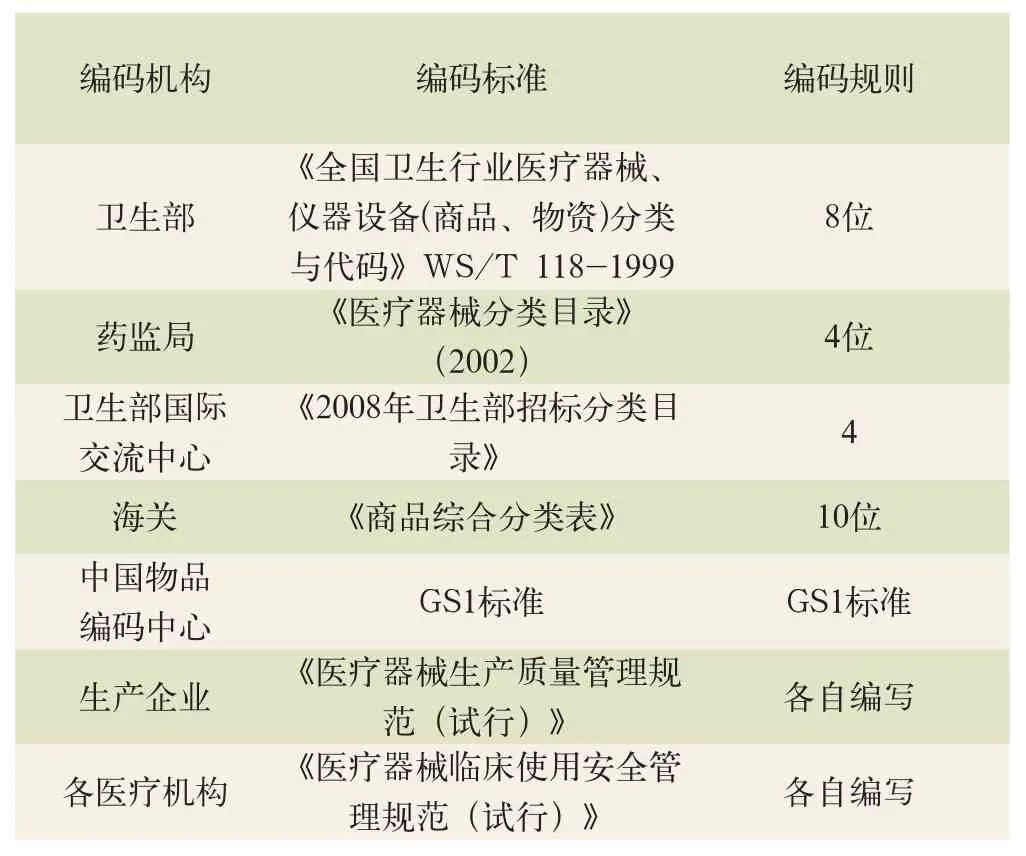
表1 相關各方醫用耗材編碼標準與編碼規則
3 醫用耗材分類編碼的初步設想
3.1 綜合各分類代碼的優點,與GS1標準兼容
3.2 廣泛參與,信息完備,共同認可,能夠滿足各方面管理需要
3.3 采用主條碼和次條碼的結構;主條碼用于識別產品,包含生產商、產品和規格等信息;次條碼用于標識產品的信息,包括產品批號、生產日期、有效期。
3.4 可考慮采用二維碼或射頻碼
3.5 有較好的可擴展性,充分滿足未來發展的需要
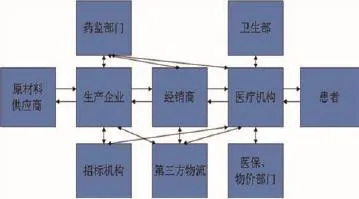
圖1 統一高效的監管體系
3.6 通過利益攸關各方的共同努力,力爭出臺新的醫用耗材分類與代碼行業標準或國家標準。對不符合醫用耗材分類與代碼標準的醫用耗材,應逐步限制使用,直至最終成為各方面共同認可的規范。以此為基礎,構建統一高效的醫用耗材監管體系,實現醫用耗材從生產、進口、招標、采購、供應、使用、患者整個體系的統一監管,醫用耗材供應鏈管理的效率將大幅度提升,最終帶來醫用耗材臨床應用安全的提升和巨大的財富效應。
[1]中華人民共和國衛生部、全國衛生系統醫療器械、儀器設備(商品、物資)分類與代碼,WZB01-90[S].1990-05.
[2]國家食品藥品監督管理局令第15號,醫療器械分類規則[S].2000-02-17.
[3]國家食品藥品監督管理局.醫療器械分類目錄(國藥監械[2002]302號)[S].2002-08-28.
[4]國家食品藥品監督管理局.關于印發醫療器械生產質量管理規范(試行)的通知,國食藥監械[2009]833號[S].2009-12-16.
[5]中華人民共和國衛生部,醫療器械臨床使用安全管理規范(試行),衛醫管發〔2010〕4號[S].2010-01-18.
[6]國家質檢總局.商品條碼管理辦法[S].2005-10-01.
[7]中華人民共和國衛生部令第48號,醫院感染管理辦法[S].2006-06-15.
[8]楊國華,龐浩,楊曉燕.高值醫用耗材管理與使用目錄編碼分析[J].中國醫學裝備,2006,3(12).
[9]陳金雄,陳大鵬,徐榮,等.醫院物資條形碼全流程管理信息系統的研究與開發[J].醫療衛生裝備,2009,30(10):34.
[10]王敏,葛毅,鄧厚斌,等.關于醫院醫用耗材分類的標準和方法[J].醫療設備信息,2007,22(3).
[11]王敏,葛毅,鄧厚斌.適應醫用耗材有效管理的編碼方法和數據庫設計的研究[J].2008年中華臨床醫學工程及數字醫學大會暨中華醫學會醫學工程學分會第九次學術年會論文集,2008.

