廣泛耐藥結核分枝桿菌耐藥機制及其疾病診斷的研究進展
范曉萍,張文宏
復旦大學附屬華山醫院感染科,上海 200040
自20世紀90年代以來,全球結核病疫情回升,其中結核分枝桿菌耐藥是一重要原因。尤其是耐多藥結核病(multidrug-resistant tuberculosis,MDR-TB)和廣泛耐藥結核病(extensively drug-resistant tuberculosis,XDR-TB)的出現給全球結核病的控制帶來極大挑戰。MDR-TB是指由至少對異煙肼(isoniazid,INH)和利福平(rifampicin,RMP)2種一線抗結核藥物耐藥的結核分枝桿菌引起的結核病。MDR-TB治療需要用二線抗結核藥物,但2000年全球開始出現對二線抗結核藥物耐藥的XDR-TB。XDR-TB曾有多種不同定義方式,但因氟喹諾酮類藥物和二線抗結核藥物藥敏試驗的可靠性和可重復性高,2006年世界衛生組織(World Health Organization,WHO)將對氟喹諾酮類藥物和至少3種二線靜脈用抗結核藥物﹝卷曲霉素(capreomycin,CM)、卡那霉素(kanamycin,KM)、阿米卡星(amikacin,AM)﹞中1種耐藥的耐多藥結核分枝桿菌引起的結核病定義為XDR-TB[1]。最近大多數文獻報道,2006年全球新增MDR-TB 500 000例,其中7% MDR-TB變異為高致病性XDR-TB。截至2008年底,已在55個國家和地區監測到XDR-TB[2]。XDR-TB診治困難、費用昂貴、治愈率低、病死率高,是結核病治療的一大難題。
1 流行病學
WHO和國際防癆和肺病聯合會(International Union Against Tuberculosis and Lung Disease,IUATLD)1994年建立了全球性抗結核藥物耐藥監測計劃。截至2007年,抗結核藥物耐藥監測項目已完成4輪,覆蓋109個國家和地區。2002~2007年第4輪監測結果顯示,37個國家和地區報道了XDR-TB, 3 818 例MDR-TB病例中8.0%為XDR-TB(304例);其中蘇聯等5個國家分別報道25例及以上XDR-TB,占MDR-TB的6.6%~23.7%[2]。XDR-TB的發病率地區間差異很大,在MDR-TB中所占比例從愛爾蘭的0%到塞爾維亞的33.3%不等。據WHO報道,2006年有充分藥敏結果的所有MDR-TB中,7%為XDR-TB。盡管現在缺乏全球性關于XDR-TB發病趨勢的資料,但MDR-TB的發病數從2000年約27萬例增至2006年約49萬例,據此推算,XDR-TB的發病例數也在增加[3,4]。截至2010年1月,已有58個國家和地區至少報道了1例XDR-TB病例。我國2007~2008年全國結核病耐藥性基線調查發現,每年新發肺結核病約56萬例,其中MDR-TB約12萬例,XDR-TB約1萬例。
2 廣泛耐藥結核分枝桿菌產生的危險因素及耐藥機制
2.1 危險因素
MDR-TB是XDR-TB產生的前提。MDR-TB的出現促使二線抗結核藥物的應用,應用過程中又出現了XDR-TB。多篇文獻報道,結核病不充分及不合理的治療與MDR-TB及XDR-TB密切相關。其中Karagoz等報道了土耳其Sureyyapasa胸心血管疾病教研醫院結核病患者的耐藥情況,新發結核病中MDR-TB發病率為3.2%,而先前接受治療的患者發病率為13.5%,后者遠遠高于前者[5]。人類免疫缺陷病毒(human immunodeficiency virus,HIV)合并感染亦與結核分枝桿菌耐藥相關,且HIV合并感染在新發病例中與對利福平單獨耐藥相關,與其他耐藥方式無關[6]。還有多篇文獻報道,監獄中犯人MDR-TB的發病率遠高于正常人。如Mokaddas等報道,從佐治亞監禁的患肺結核病犯人中分離的結核分枝桿菌對二線抗結核藥物高度耐藥,從接受過治療的MDR-TB患者中分離的結核分枝桿菌對2種或2種以上二線抗結核藥物耐藥的發生率為54%,在新發MDR-TB患者中為17%[7]。Law等對香港地區MDR-TB危險因素進行研究,發現非常住人口、外出頻繁及年輕人與復治MDR-TB患者相關,而與初治患者無關[8]。現代交通的發達使耐多藥結核分枝桿菌跨區域播散成為可能,傳播性耐藥值得引起重視[9]。
2.2 耐藥機制
XDR-TB的產生主要有以下幾種機制:獲得性耐藥、擴大性耐藥和傳播性耐藥。這3種耐藥機制的成因不同。
編碼抗結核分枝桿菌藥物靶點及相關代謝酶的染色體基因突變是結核分枝桿菌耐單藥產生的主要分子機制[10,11]。耐多藥是因為多種藥物靶基因突變,對結核病患者個體來說耐藥性來源于自發性突變[12],染色體多個相互獨立基因自發突變逐步累加是產生XDR-TB的分子基礎;多數廣泛耐藥分離株存在耐單藥相關基因改變,推測廣泛耐藥的產生由相關耐單藥基因突變、多代遺傳積累所致。盡管就單個患者來說自發突變率很低,但對于載菌量大的患者,針對某種藥物的基因突變所致耐藥還是可能的。對長期應用一種抗結核藥物的患者,該藥物的耐藥性很快被篩選出來,以耐該藥的結核分枝桿菌占主導地位,該耐藥形式稱為獲得性耐藥(acquired resistance)[13,14]。
XDR-TB的治療需要至少4種有效藥物或部分有效藥物,或5~7種療效不確切的藥物。治療至痰陰轉后18個月,如病變廣泛 ,應延長到24個月,治療時可選擇的有效抗結核藥物有限。對常見抗結核藥物耐藥的結核分枝桿菌耐藥相關基因見表1。
表1與結核分枝桿菌耐藥相關的基因[7]
Tab.1GeneticmutationsrelatedtoresistanceofMycobacteriumtuberculosis
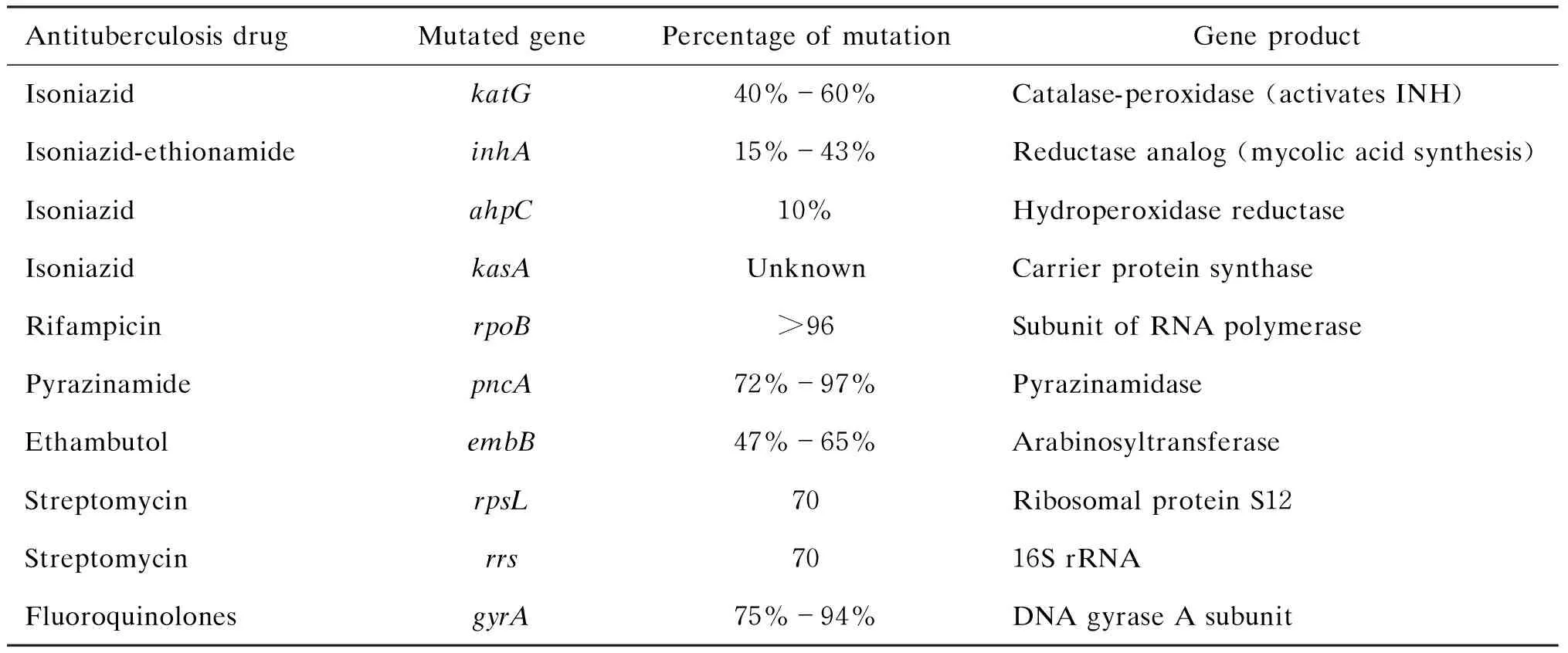
Antituberculosis drugMutated genePercentage of mutationGene productIsoniazidkatG40%-60%Catalase-peroxidase (activates INH)Isoniazid-ethionamideinhA15%-43%Reductase analog (mycolic acid synthesis)IsoniazidahpC10%Hydroperoxidase reductaseIsoniazidkasAUnknownCarrier protein synthaseRifampicinrpoB>96Subunit of RNA polymerasePyrazinamidepncA72%-97%PyrazinamidaseEthambutolembB47%-65%ArabinosyltransferaseStreptomycinrpsL70Ribosomal protein S12Streptomycinrrs7016S rRNAFluoroquinolonesgyrA75%-94%DNA gyrase A subunit
結核病的治療必須應用2種及以上敏感藥物,藥物短缺、質量差,治療不當,患者依從性差,自行停藥或終止治療可導致耐藥結核病產生,還可導致抗結核治療過程中結核分枝桿菌的耐藥譜逐步增加,即擴大性耐藥(amplified resistance)[13]。
耐藥結核分枝桿菌可通過與患者直接接觸而傳播,該耐藥形式稱為傳播性耐藥(transmitted resistance)[13],也稱為原發性耐藥(primary resistance)。有數據表明,與MDR-TB患者接觸后發展為耐藥活動性肺結核的概率較高,故對所有與結核病患者接觸的人都應進行密切監測。XDR-TB患者病死率更高,對與其接觸者應進行更嚴密的監測,及早發現,及早治療,減少傳播。
獲得性耐藥主要是在抗結核藥物壓力下對天然存在的染色體突變的選擇,主要由不恰當化療造成,反映的是結核病治療管理的質量。原發性耐藥患者所占比例高低主要反映當地耐藥結核分枝桿菌傳播水平的高低,是評價與制定結核病控制和規劃的重要依據。
3 診斷
快速、準確的藥敏試驗對結核病的預防、控制至關重要,但目前結核病的診斷率低。WHO預計2005年痰菌陽性的新發結核病患者確診率達70%,但該目標遠遠沒有實現[15]。目前診斷耐藥結核病的診斷方法有多種,主要有以下幾種。
3.1 傳統培養方法
目前的“金標準”是瓊脂比例法(agar proportion method)[16,17],可準確計算對某種藥物耐藥的結核分枝桿菌比例。有實驗比較改良羅氏培養基直接比例法與廣泛應用的改良羅氏培養基間接比例法,前者在MDR-TB發病率為2%、5%、20%和50%的人群中效價比最高。然而液體培養法(liquid culture method)對于一線抗結核藥物更可靠[16,17]。氟喹諾酮類藥物和靜脈用二線抗結核藥物的藥敏試驗相對其他二線藥物更準確、可靠。然而傳統培養方法需8~12周,有一定的滯后性,在治療過程中可能會有新的耐藥結核分枝桿菌出現,不能及時反映目前耐藥情況。
3.2 液體培養基法
自動化液體培養系統有更高的敏感度,但需2~4周出結果,且費用昂貴。BACTEC-460 輻射測量系統可連續檢測接種標本的培養管熒光強度變化,判斷是否有結核分枝桿菌生長,目前該系統已被結核桿菌生長指示管(Mycobacteriagrowth indicator tube)960系統取代。后者可快速檢測結核分枝桿菌對一線、二線抗結核藥物的耐藥情況,僅需數天即可出結果,但費用較昂貴。2007年WHO公布了在資源貧乏地區液體培養法、藥敏試驗及快速菌種鑒定的指導政策。
3.3 快速表型檢測法
快速表型檢測法包括鏡下藥敏檢測法(microscopic observation drug-susceptibility assay,MODS)、TK medium、FASTPlaque-Response等。以傳統方法作標準,MODS對利福平藥敏一致率為100%,對異煙肼藥敏一致率為97%,對利福平合并異煙肼藥敏一致率為99%,對乙胺丁醇和鏈霉素的藥敏一致率略低,分別為95%和92%。MODS的最大缺點是需要倒置顯微鏡觀察結核分枝桿菌的生長情況[18]。TK培養基是一種比色法,可在菌落長出前通過觀察培養基的顏色改變來檢測細菌的生長活性,并可鑒別結核分枝桿菌與非結核分枝桿菌,也可進行藥敏試驗,但目前尚缺乏該方面的文獻資料。FASTPlaque-Response是一種噬菌體擴增法,可直接應用于痰標本,并可對含有藥物的標本進行藥敏檢測。該方法敏感度高,但特異度較差,目前缺乏直接應用于痰標本的足夠證據。
3.4 免疫學方法
近年來發展了新的細胞免疫檢測方法——γ干擾素釋放試驗(interferon γ release assay,IGRA),即用結核分枝桿菌抗原與可疑感染者的全血或單個核細胞體外37 ℃孵育過夜,用酶聯免疫吸附試驗(enzyme-linked immunosorbent assay,ELISA)或酶聯免疫斑點(enzyme-linked immunosorbent spot,ELISPOT)法測定致敏T細胞受抗原刺激后IFN-γ釋放水平,從而判定是否有結核分枝桿菌感染[19]。但該法受患者自身免疫條件影響,敏感度、特異度不夠,且不能鑒別潛伏期結核和活動性結核。
3.5 分子生物學新技術
分子生物學技術可在數小時至數天內檢測出對某種抗結核藥物耐藥的結核分枝桿菌特定基因突變,不需要結核分枝桿菌培養及藥敏試驗,且敏感度較傳統方法大大提高。如表1所示,對利福平耐藥患者中,結核分枝桿菌95%有rpoB基因突變[17]。因利福平單耐藥率低,所以可將利福平耐藥檢測作為MDR-TB統計的替代指標。GenoTypeMTBDR線性探針技術對利福平耐藥檢測的敏感度、特異度高,可直接用于抗酸染色陽性的呼吸道分泌物標本及培養株檢測[16]。GenoTypeMTBDRplus可用于對異煙肼耐藥的inhA基因啟動子區域及對利福平耐藥的rpoB基因的熱點突變區域進行檢測。該方法對異煙肼耐藥檢測的敏感度為84%(70%~90%),特異度為99%[16]。目前已開發出針對二線藥物檢測的GenoTypeMTBDRsl技術。DNA直接測序是檢測耐藥基因突變的另一方法,準確率高,但費用昂貴,需要特定的實驗室設備。分子生物學技術可以迅速、準確檢測出針對某種抗結核藥物耐藥的結核分枝桿菌突變基因,但并不是針對所有的耐藥藥物都能檢測到相應的基因突變,到目前為止還有許多抗結核藥物耐藥相應突變基因未能發現。此外,不同藥物的基因突變有不同的地理分布特點,目前還缺乏統一的分子生物學方法作為檢測未知耐藥基因的標準,需進一步對不同地區耐藥基因特點進行研究,以建立統一的診斷標準。
4 結語
XDR-TB治療指南推薦對每個患者必須采用從標準化、經驗化到個體化的治療方案,根據患者用藥情況、藥敏結果制訂合理的治療方案,采取DOTS-Plus方法,指導并監測患者用藥。目前XDR-TB治療效果缺乏大樣本、多中心的文獻資料。MDR-TB治療時間長,至少18~24個月,需應用昂貴、毒性大、療效差的二線藥物。描述性研究發現,其治療成功率遠低于敏感結核病,僅為75%[20]。XDR-TB治療效果比MDR-TB更差,病死率和治療失敗率更高[21,22],尤其是在合并HIV感染的患者。
總之,XDR-TB治療時間長,病死率高,治療效果差,目前可用藥物種類有限、費用昂貴、不良反應多。目前尚缺乏快速、準確的診斷方法,藥敏試驗診斷技術的滯后是耐藥結核分枝桿菌傳播及耐藥產生的重要原因之一,亟需開發快速、準確的新型診斷方法。加強對耐藥結核病患者的管理,規范耐藥結核病患者的治療,同時應對與XDR-TB患者接觸的人群及潛伏期XDR-TB患者進行有效治療,減少耐藥結核分枝桿菌的傳播。對XDR-TB的治療是一項任重而道遠的任務,需要醫務工作者、研究人員、政府等多方的共同努力。
[1] Centers for Disease Control and Prevention (CDC). Revised definition of extensively drug-resistant tuberculosis [J]. MMWR, 2006, 55: 1176.
[2] Wright A, Zignol M, van Deun A, Falzon D, Gerdes SR, Feldman K, Hoffner S, Drobniewski F, Barrera L, van Soolingen D, Boulabhal F, Paramasivan CN, Kam KM, Mitarai S, Nunn P, Raviglione M, Global Project on Anti-Tuberculosis Drug Resistance Surveillance. Epidemiology of antituberculosis drug resistance 2002-07: an updated analysis of the Global Project on Anti-Tuberculosis Drug Resistance Surveillance [J]. Lancet, 2009, 373(9678): 1861-1873.
[3] World Health Organization. Antituberculosis drug resistance in the world: fourth global report [R/OL]. Geneva: World Health Organization, 2008. Report No WHO/HTM/TB/2008.394. http://extranet.who.int/iris/handle/123456789/848?locale=en.
[4] Matteo Z, Mehran SH, Abigail W, Catharina LW, Paul N, Catherine JW, Brian GW, Christopher D. Global incidence of multidrug resistant tuberculosis [J]. J Infect Dis, 2006, 194(4): 479-485.
[5] Karagoz T, Pazarli P, MocinOY, Duman D, Duman G, Salturk C, Unal O. Evaluation of drug resistance in pulmonary tuberculosis patients at Sureyyapasa Chest Disease Hospital, Istanbul, Turkey [J]. Int J Tuberc Lung Dis, 2008, 12(6):631-635.
[6] Khue PM, Phuc TQ, Hung NV, Jarlier V, Robert J. Drug resistance and HIV co-infection among pulmonary tuberculosis patients in Haiphong City, Vietnam [J]. Int J Tuberc Lung Dis, 2008, 12(7): 763-768.
[7] Mokaddas E, Ahmad S, Samir I. Secular trends in susceptibility patterns of Mycobacterium isolates in Kuwait, 1996-2005 [J]. Int J Tuberc Lung Dis, 2008, 12(3): 319-325.
[8] Law WS, Yew WW, Chiu LC, Kam KK, Tam CM, Chan CK, Leung CC. Risk factors for multidrug resistant tuberculosis in Hong Kong [J]. Int J Tuberc Lung Dis, 2008,12(9): 1065-1070.
[9] Satti H, Seung K, Keshavjee S, Furin J. Extensively drug-resistant tuberculosis, Lesotho [J]. Emerg Infect Dis, 2008,14(6): 992-993.
[10] Gillespie SH. Evolution of drug resistance in Mycobacterium tuberculosis: clinical and molecular perspective [J]. Antimicrob Agents Chemother, 2002, 46(2): 267-274.
[11] Dorman SE, Chaisson RE. From magic bullets back to the magic mountain: the rise of extensively drug-resistant tuberculosis [J]. Nat Med, 2007, 13(3): 295-298.
[12] Francis J. Drug-Resistant Tuberculosis: A Survival Guide for Clinicians [M]. 2nd ed. San Francisco, CA: Francis J Curry National Tuberculosis Center, 2008.
[13] Blower SM, Chou T. Modeling the emergence of the “hot zones”: tuberculosis and the amplification dynamics of drug resistance [J]. Nat Med, 2004, 10(10): 1111-1116.
[14] LoBue PA, Moser KS. Isoniazid- and rifampin-resistant tuberculosis in San Diego County, California, United States, 1993-2002 [J]. Int J Tuberc Lung Dis, 2005, 9(5): 501-506.
[15] World Health Organization. Global tuberculosis control 2005: surveillance, planning, financing[R/OL].Geneva: WHO, 2005. Report No WHO/HTM/TB/2005.349. www.who.int/entity/tb/publications/global_report/2005/pdf/Full.pdf .
[16] Causse M, Ruiz P, Gutierrez JB, Zerolo J, Casal M. Evaluation of new GenoTypeMTBDRplus for detection of resistance in cultures and direct specimens for Mycobacterium tuberculosis [J]. Int J Tuberc Lung Dis, 2008,12(12): 1456-1460.
[17] Kim SJ. Drug-susceptibility testing in tuberculosis: methods and reliability of results [J]. Eur Respir J, 2005, 25(3): 564-569.
[18] Moore DA, Evans CA, Gilman RH, Caviedes L, Coronel J, Vivar A, Sanchez E, Piedo Y, Saravia JC, Salazar C, Oberhelman R, Hollm-Delgado MG, LaChira D, Escombe AR, Friedland JS. Microscopic-observation drug-susceptibility assay for the diagnosis of TB [J]. N Engl J Med, 2006, 355(15): 1539-1550.
[19] Arend SM, Engelhard AC, Groot G, Kirsten DB, Peter A, Tom HM, Jaap TD. Tuberculin skin testing compared with T-cell responses to Mycobacterium tuberculosis specific and nonspecific antigens for detection of latent infection in persons with recent tuberculosis contact [J]. Clin Diagn Lab Immunol, 2001, 8(6): 1089-1096.
[20] Chan ED, Laurel V, Strand MJ, Chan JF, Huynh MLN, Globle M, Iseman MD. Treatment and outcome analysis of 205 patients with multidrug-resistant tuberculosis [J]. Am J Respir Crit Care Med, 2004, 169(10): 1103-1109.
[21] Migliori GB, Lange C, Girardi E, Centis R, Besozzi G, Kliiman K, Ortmann J, Matteelli A, Spanevello A, Cirillo DM, SMIRA/TBNET Study Group. Extensively drug-resistant tuberculosis is worse than multidrug-resistant tuberculosis: different methodology and settings, same results [J]. Clin Infect Dis, 2008, 46(6): 958-959. doi: 10.1086/528875.
[22] Kim HR, Hwang SS, Kim HJ, Lee SM, Yoo CG, Kim YW, Han SK, Shim YS, Yim JJ. Impact of extensive drug resistance on treatment outcomes in non-HIV-infected patients with multidrug-resistant tuberculosis [J]. Clin Infect Dis, 2007, 45(10): 1290-1295. doi: 10.1086/522537861-73.

