白假絲酵母活性代謝物種類及分離技術的研究進展
王慧,曹穎瑛,李燕,譚光國,朱臻宇
1. 第二軍醫大學藥學院,上海 200433; 2. 北京中國人民解放軍總后勤部鄭常莊干部休養所,北京 100141
白假絲酵母是一種人類常見條件致病真菌,通常存在于正常人口腔、上呼吸道、腸道及陰道,在人體抵抗力下降時會引起感染甚至危及生命。近年來,深部真菌感染日益成為醫院內主要感染,其中白假絲酵母成為假絲酵母感染中最常見的病原[1]。
白假絲酵母是一種具有多種形態的真菌,形態有厚膜孢子、酵母、假菌絲、菌絲等。其中菌絲相與酵母相的轉化被認為是影響致病的重要因素。已有許多研究證實,不產生菌絲相的基因缺陷型白假絲酵母在動物模型中致病性降低,而酵母相的白假絲酵母則有助于播散性感染[2]。生物被膜是由酵母細胞、菌絲和細胞外多聚基質3部分組成的一種結構群體[1]。在白假絲酵母中,生物被膜的形成會使其對一些臨床常用抗真菌感染藥物產生高度耐藥性。因此,白假絲酵母的形態變化對其在宿主環境下的生存、致病及耐藥性有很大意義。在白假絲酵母形態轉化過程中,能自發向細胞外釋放一些特定信號分子,調節微生物的密度變化,這類小分子物質稱為群體感應分子(quorum sensing molecule)。目前白假絲酵母中已確定的群體感應分子有法尼醇(farnesol)、酪醇(tyrosol)和麝油酸(farnesoic acid)[3]。此外,不同形態的白假絲酵母對氨基酸的攝取不完全相同,甚至存在很大差異[4]。
在宿主中生存時,受大量外界環境的影響,如宿主的免疫系統、滲透性、溫度、pH值、氧化水平、養分有效性、氧化還原態等,白假絲酵母會發生很大變化,承受極大的外界壓力。處于逆境中的白假絲酵母會于數分鐘內在基因和代謝水平上作出適當反應,最終使細胞獲得對逆境的抗性[5]。這些對外界環境產生的應激性使白假絲酵母快速適應外界環境,對其耐藥性的產生起一定作用。當處于對數生長期的白假絲酵母面臨高溫、NaCl、H2O2、CuSO4、高濃度乙醇、弱有機酸(山梨酸酯和苯甲酸)等脅迫時,會不同程度引起細胞內海藻糖(trehalose)濃度上升[5-7];受高滲和檸檬酸影響時會積累大量甘油(glycerol);受高溫和氧化應激時會生成大量阿拉伯糖醇(D-arabitol)[8],這些化合物都對白假絲酵母的生物大分子有一定的保護作用。
1 胞外活性代謝物
白假絲酵母在生長過程中,會產生一些有機化合物,分泌至胞外,其中部分為群體感應分子。對這類化合物的提取和分離主要是收集培養上清液,再對培養上清液進行一系列處理,然后供分析。
1.1 法尼醇
法尼醇是第1個被發現的白假絲酵母生長過程中分泌的胞外群體感應分子[9]。有文獻報道,它能影響白假絲酵母的雙相性和被膜生長,抑制芽管形成[10],抑制酵母向菌絲轉化[11],抑制被膜形成;同時也會增強由H2O2等引起的氧化性應激下白假絲酵母的存活率[12],是目前發現的白假絲酵母中作用最強、研究最多的群體感應分子。
法尼醇是揮發性的萜類化合物,因此常用氣相色譜-質譜(gas chromatography-mass spectrometry,GC-MS)進行檢測。 Hornby等[10]將收集的含法尼醇的培養上清液進行過濾后直接進樣,或采用乙酸乙酯液-液萃取,進一步提純其中脂溶性有效成分,并分別采用反相高效液相色譜-質譜(reversed-phase high performance liquid chromatography-mass spectrometry,RP-HPLC-MS)、衍生化GC-MS、薄層色譜法(thin layer chromatography,TLC)對法尼醇進行鑒定。而Ghosh等[13]也是將培養上清液過濾后,用液-液萃取(乙酸乙酯)結合GC-MS方法來分離、檢測法尼醇。與Hornby等不同的是,樣品并未進行衍生化處理,若采用己烷或乙酸乙酯/己烷(1∶4)萃取上清液,只適用于提取法尼醇;而用乙酸乙酯萃取,可同時提取白假絲酵母中苯乙醇(phenylethyl alcohol)、法尼醇、色醇(tryptophol)和酪醇4種小分子。Martins 等[14]采用頂空固相微萃取(headspace-solid phase microextraction,HS-SPME)/GC-MS同時測定浮游和被膜型白假絲酵母中異戊醇、2-苯乙醇、1-十二醇、橙花叔醇和法尼醇等醇類化合物。Gregus等[15]采用乙腈沉淀蛋白的方法處理樣品后,用超高效液相色譜-質譜 (ultra-performance liquid chromatography-mass spectrometry,UPLC-MS)測定尼醇和酪醇。
1.2 麝油酸
Oh等[16]最早分離出麝油酸,并發現其能抑制酵母向菌絲轉化。與法尼醇相比,麝油酸的分泌有局限性,僅能在特定菌株中表達,且作用相對較弱,僅為法尼醇的3%[3]。高濃度麝油酸可抑制白假絲酵母菌絲生長,但不抑制酵母生長[16,17]。相對法尼醇,麝油酸對酵母向菌絲形態轉化的選擇性更強[18]。
Oh等[16]將培養上清液凍干,用甲醇復溶,離心后取上清液;再用旋轉蒸發儀將甲醇溶液揮干,用己烷復溶;正相高效液相色譜(normal-phase high performance liquid chromatography,NP-HPLC)進行分離,收集流出的有效成分;揮干,用0.1 ml的90%乙腈復溶,RP-HPLC進行梯度洗脫,獲得麝油酸單體;并用GC-MS和核磁共振波譜(nuclear magnetic resonance,NMR)進行結構鑒定。
1.3 酪醇
Chen等[19]指出,酪醇的分泌會促進菌絲生長,從而縮短轉化時間。在利于菌絲生長的條件下,酪醇還會縮短細胞發展成芽管的時間,促進芽管形成,該作用在被膜生長的早期和中期最為顯著[20]。
Chen等[19]固相萃取、富集白假絲酵母培養液后,用RP-HPLC純化、制備酪醇,并對其結構進行NMR鑒定。Alem等[20]改良了上述方法,縮短了酪醇的出峰時間。Ghosh等[13]采用乙酸乙酯液-液萃取結合GC-MS的方法分離、鑒定酪醇,該法同樣可用于測定白假絲酵母中苯乙醇、法尼醇、色醇等其他小分子。魏昕等[21]將生物被膜培養上清液離心、抽濾后,采用HPLC檢測酪醇。Gregus等[15]將收集的液體用乙腈沉淀蛋白后,采用UPLC-MS測定酪醇,同時測定了法尼醇和酪醇。
1.4 苯乙醇和色醇
有報道,苯乙醇和色醇在白假絲酵母中起抑制菌絲形成和細胞生長的作用,但這2個化合物對白假絲酵母形態的影響機制尚不明確[3,22],但要達到500 μmol/L才能抑制絲化現象[22],所以其在正常濃度范圍內抑制菌絲的作用有待進一步研究。此外,研究還發現色醇具有細胞毒性[22]。Lingappa等[22]用氯仿萃取培養上清液,用MS鑒定這2種化合物。Hazen等[23]采用將上清液過濾后以GC方法測定苯乙醇和色醇。Kosalec等[24]采用液相色譜-質譜(liquid chromatography-mass spectrometry,LC-MS)鑒別和定量色醇。Martins等[14]采用HS-SPME/GC-MS對苯乙醇等醇類進行分析。Ghosh等[13]采用乙酸乙酯液-液萃取方法分離、提純苯乙醇和色醇,并將濃縮液用GC-MS進行分析。
1.5 MARS
Hazen和Cutler[25]在白假絲酵母研究中發現了一種物質并命名為MARS,它能耐高溫,70 ℃下放置30 min還能保持穩定,但在分離48 h后或pH超出4~9.5時,就會失去抑制絲化的活性。不僅白假絲酵母可分泌MARS,熱帶假絲酵母也可分泌。Hazen 和 Cutler將含MARS的組分用吡啶或乙醚萃取后,經RP-HPLC進一步純化、收集。經鑒定,MARS有1個含氮雜環結構,能抑制假絲酵母中氨基酸攝取。但MARS分子結構及其在調節白假絲酵母形態轉化中的作用仍需深入研究。
2 胞內代謝物
白假絲酵母代謝產生用于合成蛋白質、核酸、類脂和多糖等的一些小分子物質,如氨基酸、核苷酸、有機酸和單糖衍生物等,與微生物細胞內生物合成息息相關。要對這類物質進行分析,首先要進行細胞破碎,目前主要方法有[26,27]化學試劑裂解、低滲溶液脹破、反復凍融和機械性方法,將細胞破碎后才能對胞內代謝物進行下一步研究。
2.1 氨基酸類
氨基酸對白假絲酵母形態轉化起一定作用。有文獻報道,血清和氨基酸都是已知的能誘導白假絲酵母發生形態轉化的物質,但其分子機制仍不明確[28]。氨基酸種類或數量不足也會刺激白假絲酵母的形態變化。白假絲酵母的2種形態對各種氨基酸的攝取需求也不完全相同,甚至存在很大差異[4,29,30]。
早期,對白假絲酵母中氨基酸的分析方法主要是往培養基中加入放射性核素標記的氨基酸(如L-3H-氨基酸),待菌體收集、洗滌完全后,吹干,轉移到閃爍瓶中,用液體閃爍計數器計數[6]。近年來,色譜技術廣泛運用于氨基酸的分析。Flynn等[31]采用柱前衍生化RP-HPLC對氨基酸進行測定。
2.2 海藻糖
海藻糖是化學性質穩定的非還原性二糖,由2個吡喃葡萄糖分子通過α-1,1-糖苷鍵連接而成[6]。它是細胞中的一種應激代謝物,當細胞處于長時間饑餓、高滲、熱激以及孢子萌發時,海藻糖含量會發生顯著變化,恢復正常環境后又迅速降解。因此,海藻糖含量的變化從某種程度上反映了機體對外界環境的響應,在對不同脅迫應答中,海藻糖的積累被認為起關鍵作用[5,7]。
Pfyffer等[32]采用熱乙醇將細胞破碎后,過濾取上清液,再經三甲基硅烷衍生化后進行GC分析,該法可同時測定甘油、核糖醇、阿拉伯糖醇和海藻糖。Cao等[33]和Lu等[34]將細胞以微波破碎后,收集上清液,用HPLC-MS分析海藻糖。Askew等[35]則用熱水萃取胞內代謝物,取上清液后用酶法分析海藻糖和甘油。
2.3 甘油和阿拉伯糖醇
白假絲酵母在生長過程中會積累大量甘油和D-阿拉伯糖醇,造成哺乳動物感染。在培養6 h后能產生最大量的甘油,在12 h產生最大量的D-阿拉伯糖醇和核糖醇。這些多元醇的釋放與胞外環境有關[36]。
1981年Bernard等[36]將細胞處理后,用三甲基硅醚衍生化,以α-甲基甘露苷作為內標,通過GC定量測定D-阿拉伯糖醇。Pfyffer等[32]采用熱乙醇將細胞破碎,過濾取上清液,有效成分經三甲基硅烷衍生化后進行GC分析。該法可同時測定甘油、核糖醇、阿拉伯糖醇和海藻糖,但未能將核糖醇和阿拉伯糖醇分開,且甘油出峰時間較靠前,可能被衍生化試劑的峰掩蓋。Kayingo和 Wong[8]以α-甲基甘露苷和α-甲基葡萄糖苷作為內標,通過GC分析同時測定D-阿拉伯糖醇、核糖醇、甘露醇和山梨醇(半乳糖醇),其中將D-阿拉伯糖醇和核糖醇(同分異構體)分離;但該法未能檢測甘油,作者進一步將樣品酶解后采用紫外吸光度法對甘油進行定量。Wesolowski等[37]和Askew等[35]也采用酶法分析胞內甘油。而Kayingo等[38]則采用放射性核素標記甘油(14C-甘油),收集菌體后,轉移到閃爍瓶中,用液體閃爍計數器計數。
3 結語
白假絲酵母的胞內、外活性代謝物種類繁多(表1),功能非常復雜。作為生物體基因表達的終產物,活性代謝物的變化反映了細胞對基因或環境變化的最終響應。通過對活性代謝物種類和含量的動態監測,結合已有的代謝網絡數據庫進行研究,將為深入探索白假絲酵母自身代謝調節機制提供新的思路。
表1白假絲酵母相關代謝物
Tab.1RelatedmetabolitesofCandidaalbicans
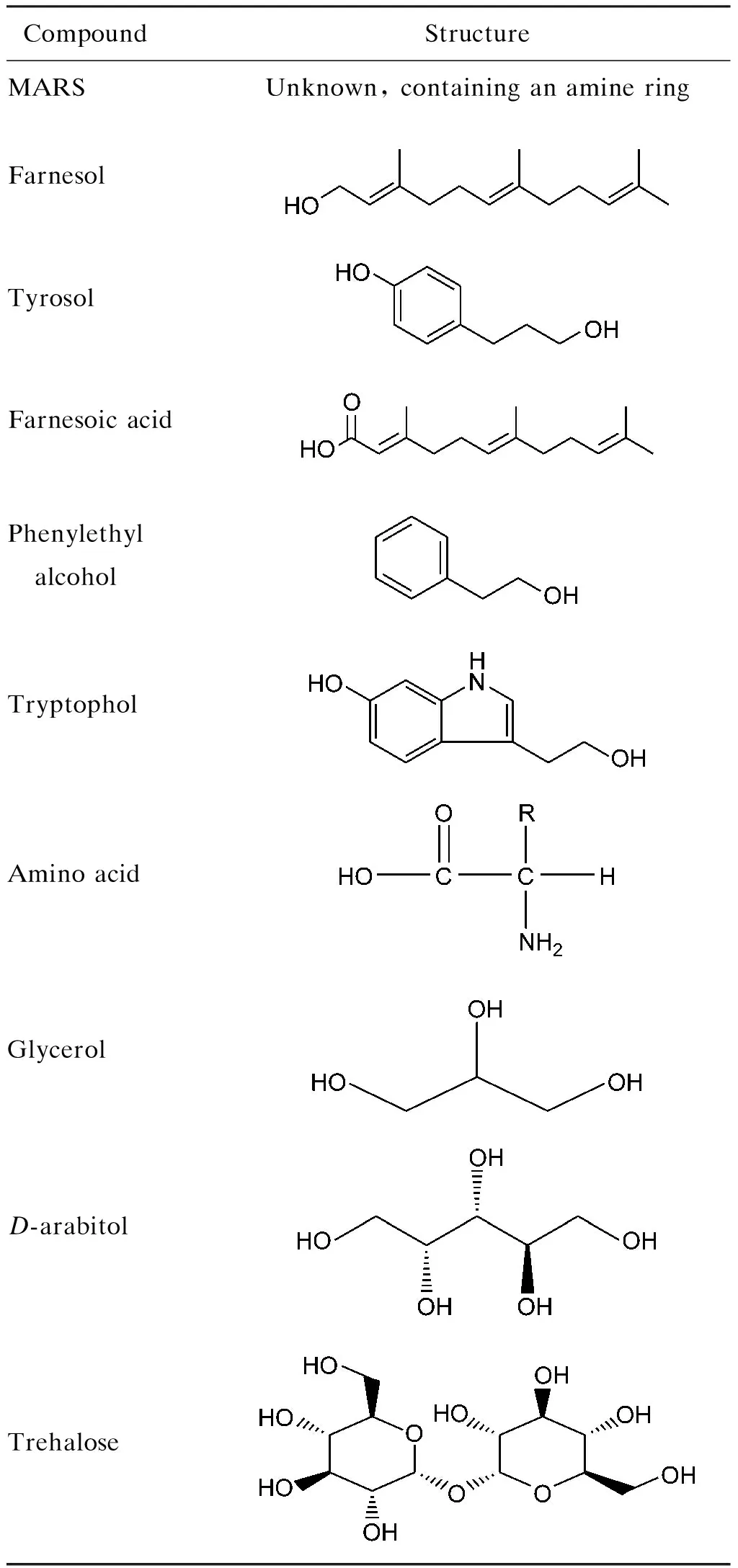
CompoundStructureMARSUnknown, containing an amine ringFarnesolTyrosol Farnesoic acidPhenylethyl alcoholTryptopholAmino acidGlycerolD-arabitolTrehalose
[1] 吳紹熙,郭寧如.深部真菌感染的診斷與治療. 抗真菌藥物與真菌感染診治研究學術會議論文集[C]. 2003: 21-30. http://www.ilib.cn/A-%E4%BC%9A%E8%AE%AE%E8%AE%B0%E5%BD%95ID~5406214.html.
[2] 劉澤虎. 氨基酸對白念珠菌形態學影響的研究[J].中國真菌學雜志,2009,4(2), 65-69.
[3] Kruppa M. Quorum sensing and Candida albicans. Mycoses, 2008, 52(1): 1-10.
[4] Torosantucci A, Angiolella L, Filesi C, Cassone A. Protein synthesis and amino acid pool during yeast-mycelial transition induced by N-acetyl-D-glucosamine in Candida albicans [J]. J Gen Microbiol, 1984, 130(12): 3285-3293.
[5] Voit EO. Biochemical and genomic regulation of the trehalose cycle in yeast: review of observations and canonical model analysis [J]. J Theor Biol, 2003, 223 (1): 55-78.
[6] 池振明, 梁麗琨, 朱開玲, 張風麗. 酵母海藻糖的代謝與調控研究進展[J]. 中國海洋大學學報, 2006, 36(2): 209-214.
[7] Alvarez-Peral FJ, Zaragoza O, Pedreo, Argüelles JC. Protective role of trehalose during severe oxidative stress caused by hydrogen peroxide and the adaptive oxidative stress response in Candida albicans [J]. Microbiology, 2002, 148(8): 2599-2606.
[8] Kayingo G, Wong B. The MAP kinase Hog1p differentially regulates stress-induced production and accumulation of glycerol and D-arabitol in Candida albicans [J]. Microbiology, 2005, 151(9): 2987-2999.
[9] Nickerson KW, Atkin AL, Hornby JM. Quorum sensing in dimorphic fungi: farnesol and beyond [J]. Appl Environ Microbiol, 2006, 72 (6):3805-3813.
[10] Hornby JM, Jensen EC, Lisec AC, Tasto JJ, Jahnke B, Shoemaker R, Dussault P, Nickerson K. Quorum sensing in the dimorphic fungus Candida albicans is mediated by farnesol [J]. Appl Environ Microbiol, 2001, 67 (7): 2982-2992.
[11] Langford ML, Hasim S, Nickerson KW, Atkin AL. Activity and toxicity of farnesol towards Candida albicans are dependent on growth conditions [J]. Antimicrob Agents Chemother, 2010, 54: (2): 940-942.
[12] Deveau A, Piispanen AE, Jackson AA, Hogan DA. Farnesol induces hydrogen peroxide resistance in Candida albicans yeast by inhibiting the Ras-cAMP signaling pathway [J]. Eukaryot Cell, 2010, 9(4): 569-577.
[13] Ghosh S, Kebaara BW, Atkin AL, Nickerson KW. Regulation of aromatic alcohol production in Candida albicans [J]. Appl Environ Microbiol, 2008,74: (23): 7211-7218.
[14] Martins M, Henriques M, Azeredo J, Rocha SM, Coimbra MA, Oliveira R. Morphogenesis control in Candida albicans and Candida dubliniensis through signaling molecules produced by planktonic and biofilm cells [J]. Eukaryot Cell, 2007, 6(12): 2429-2436.
[15] Gregus P, Vlcková H, Buchta V, Kestranek J, Krivcíková L, Nováková L. Ultra high performance liquid chromatography tandem mass spectrometry analysis of quorum-sensing molecules of Candida albicans [J]. J Pharm Biomed Anal, 2010, 53 (3): 674-681.
[16] Oh KB, Miyazawa H, Naito T, Matsuoka H. Purification and characterization of an autoregulatory substance capable of regulating morphological transition in Candida albicans [J]. Proc Nat Acad Sci USA, 2001, 98: (8): 4664-4668.
[17] Hogan DA. Talking to themselves: Autoregulation and quorum sensing in fungi [J]. Eukaryot Cell, 2006, 5(4): 613-619.
[18] Kim S, Kim E, Shin DS, Kang H, Oh KB. Evaluation of morphogenic regulatory activity of farnesoic acid and its derivatives against Candida albicans dimorphism [J]. Bioorg Med Chem Lett, 2002, 12(6): 895-898.
[19] Chen H, Fujita M, Feng Q, Clardy J, Fink GR. Tyrosol is a quorum-sensing molecule in Candida albicans [J]. Proc Nat Acad Sci USA, 2004, 101: (14): 5048-5052.
[20] Alem MAS, Oteef MDY, Flowers TH, Douglas LJ. Production of tyrosol by Candida albicans biofilms and its role in quorum sensing and biofilm development [J]. Eukaryot Cell, 2006, 5 (10): 1770-1779.
[21] 魏昕, 吳觀陵, 劉衛紅, 張琰, 胡琴. 白念珠菌的菌體密度與生物被膜形成及tyrosol分泌[J]. 中華微生物學和免疫學雜志, 2010, 30(4): 344-348.
[22] Lingappa PT, Prasad M, Lingappa Y, Hunt DF, Biemann K. Phenethyl alcohol and tryptophol: autoantibiotics produced by the fungus Candida albicans [J]. Science, 1969, 163 (863): 192-194.
[23] Hazen K, Cutler JE. Autoregulation of germ tube formation by Candida albicans [J]. Infect Immun, 1979, 24 (3):661-666.
[24] Kosalec I, Puel O. Isolation and cytotoxicity of low-molecular-weight metabolites of Candida albicans [J]. Front Biosci, 2008, 13: 6893-6904.
[25] Hazen KC, Cutler JE. Isolation and purification of morphogenic autoregulatory substance produced by Candida albicans [J]. J Biochem, 1983, 94 (3): 777-783.
[26] Maharjan RP, Ferenci T. Global metabolite analysis: the influence of extraction methodology on metabolome profiles of Escherichia coli [J]. Anal Biochem, 2003, 313(1): 145-154.
[27] Canelas AB, Pierick AT, Ras C, Seifar RM, Dam JC, Gulik WM, Heijnen JJ. Quantitative evaluation of intracellular metabolite extraction techniques for yeast metabolomics [J]. Anal Chem, 2009, 81 (17):7379-7389.
[28] Brega E, Zufferey R, Mamoun CB. Candida albicans Csy1p is a nutrient sensor important for activation of amino acid uptake and hyphal morphogenesis [J]. Eukaryot Cell, 2004, 3(1): 135-143.
[29] Braun PC. The effect of farnesol on amino acid incorporation by a wild-type and cell-wall variant strain of Candida albicans [J]. Can J Microbiol, 2005, 51(8): 715-718.
[30] Tripathi G, Wiltshire C, Macaskill S, Tournu H, Budge S, Brown AJP. Gcn4 co-ordinates morphogenetic and metabolic responses to amino acid starvation in Candida albicans [J]. EMBO J, 2002, 21(20): 5448-5456.
[31] Flynn NE, Patyrak ME, Seely JB, Wu GY. Glycine oxidation and conversion into amino acids in Saccharomyces cerevisiae and Candida albicans [J]. Amino Acids, 2010, 39(2): 605-608.
[32] Pfyffer GE, Rast DM. Accumulation of acyclic polyols and trehalose as related to growth form and carbohydrate source in the dimorphic fungi Mucor rouxii and Candida albicans [J]. Mycopathologia, 1989, 105(1): 25-33.
[33] Cao YY, Wang Y, Dai BD, Wang B, Zhang H, Zhu ZY, Xu YG, Cao YB, Jiang YY, Zhang GQ. Trehalose is an important mediator of Cap1p oxidative stress response in Candida albicans [J]. Biol Pharm Bull, 2008, 31(3): 421-425.
[34] Lu H, Zhu ZY, Dong LL, Jia XM, Sun XR, Yan L, Chai YF, Jiang YY, Cao YY. Lack of trehalose accelerates H2O2-induced Candida albicans apoptosis through regulating Ca2+signaling pathway and caspase activity [J]. PLoS One, 2011, 6(1): e15808.
[35] Askew C, Sellam A, Epp E, Hogues H, Mullick A, Nantel A, Whiteway M. Transcriptional regulation of carbohydrate metabolism in the human pathogen Candida albicans[J]. PLoS Pathog, 2009, 5(10): e1000612.
[36] Bernard EM, Christiansen KJ. Rate of arabinitol production by pathogenic yeast species [J]. J Clin Microbiol, 1981, 14(2): 189-194.
[37] Wesolowski J, Hassan RYA, Reinhardt K, Hodde S, Bilitewski U. Antifungal compounds redirect metabolic pathways in yeasts: metabolites as indicators of modes of action [J]. J Appl Microbiol, 2010, 108 (2): 462-471.
[38] Kayingo G, Martins A, Andrie R, Neves L, Lucas C, Wong B. A permease encoded by STL1 is required for active glycerol uptake by Candida albicans [J]. Microbiology, 2009, 155 (Pt 5): 1547-1557.

