一氧化氮、人乳頭瘤病毒和宮頸癌之間相互關系的研究進展
魏蘭蘭,劉爽,谷鴻喜,張鳳民
1.哈爾濱醫科大學微生物學教研室,哈爾濱 150086; 2.佳木斯大學醫學院遺傳學教研室,佳木斯 154007
2006年人乳頭瘤病毒(human papillomavirus,HPV)宮頸癌預防性疫苗的問世,標志著宮頸癌研究取得了巨大進步。但一系列研究表明,HPV預防性疫苗不可能完成全面預防宮頸癌的任務,更不具有任何治療功能。因此,進一步深入研究HPV和共刺激因子在宮頸癌發生中的作用及機制,發現更有效的預防和治療途徑依然具有重要現實意義。本文就一氧化氮(nitric oxide,NO)、HPV感染和宮頸癌發生三者之間的相互關系進行綜述。
1 HPV感染和宮頸癌
宮頸癌是女性最常見的惡性腫瘤之一。流行病學調查顯示,全世界每年約有50萬宮頸癌新發病例,約20萬婦女死于宮頸癌[1],其中80%發生于發展中國家。我國是宮頸癌高發區,每年新增宮頸癌病例約4.6 萬,死亡約2.6 萬,由此可見目前宮頸癌的防治任務仍十分艱巨。
HPV感染是引發宮頸癌的重要原因[2]。研究顯示,在高達99.7%的宮頸癌標本中可檢測到HPV存在[3]。德國科學家Harald zur Hausen亦因1976年提出并隨后證明“HPV可引起宮頸癌”而獲得2008年諾貝爾生理/醫學獎。
HPV是一種嗜上皮性病毒,屬雙鏈閉環的小DNA病毒。在目前已發現的近100個型別中,15~20個型別的HPV感染與宮頸癌及其他肛周生殖器腫瘤相關[2],稱為高危型HPV。高危型HPV主要包括HPV16、18、31、33、52、56、58、59、68等型別[4]。本文中提到的HPV均指高危型HPV。HPV DNA包括1個早期區,可編碼8個病毒調節蛋白(E1~E8);1個晚期區,可編碼2個病毒結構蛋白 (L1和L2) ;1個非編碼調控區。HPV通過E6和E7蛋白對抑癌基因p53和pRb降解或功能性滅活而促進腫瘤發生(圖1)。
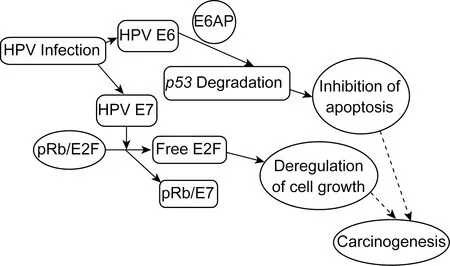
圖1HPV感染與腫瘤發生的關系
Fig.1RelationofHPVinfectionandcarcinogenesis
盡管HPV宮頸癌預防性疫苗于2006年問世,但仍有許多問題亟待證實,如其長期保護作用如何?臨床試驗和短期隨訪證實,宮頸癌預防性疫苗可減少HPV16和HPV18感染及相關宮頸息肉的發生,但宮頸癌的發生與超過15個型別的HPV感染相關,因此僅能覆蓋1、2個型別的HPV預防疫苗自然存在很大的局限性,且疫苗必須在HPV感染以前使用才起預防作用。高達70%的婦女在一生中出現過生殖道HPV感染,但大部分可自行消除,僅少部分發展成宮頸癌。該現象的具體原因尚不明了,一個可能因素就是機體全身或局部的免疫防御反應;另外,宮頸局部NO濃度增高[5,6]也可能起一定的輔助作用。
2 NO與腫瘤發生
1986年,Ignarro發現硝酸甘油釋放的NO可舒張血管平滑肌、擴張血管,從而有效緩解心絞痛。該研究成果解答了困擾醫學家、藥理學家百余年的問題,即硝酸甘油是如何有效緩解心絞痛的。此后,NO的生理作用引起了廣泛關注。由于該發現,Ignarro等3名科學家獲1998年諾貝爾生理/醫學獎。
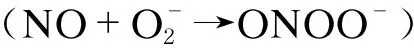
雖然NO與腫瘤發生的關系仍有爭論,但越來越多的研究表明,高濃度NO可通過引起DNA損傷和變異、抑制DNA修復酶、調節轉錄因子、改變基因表達、調節失控凋亡、誘發血管生成等方式參與腫瘤發生[8]。目前,對NO及RNS引起DNA損傷和變異的研究已相當深入。高濃度NO及RNS可引起雙鏈斷裂、單鏈斷裂及交聯等DNA損傷[5];RNS還可介導變異原8-硝基鳥嘌呤形成,從而誘導GC-AT轉位性DNA變異[6]。在人體及動物模型中,炎癥或感染部位iNOS增加所致高濃度NO可引發DNA損傷、變異,甚至腫瘤發生[6,9,10]。
在含有野生型p53的細胞中,高濃度NO可誘發DNA損傷和變異,同時也可抑制P53核外輸、下調小鼠雙微粒體2(murine double minute 2,MDM2)蛋白,抑制P53降解,從而增加P53的水平和活性[11]。激活的P53通過調節細胞周期參與DNA修復和啟動凋亡,在防止細胞DNA損傷、變異以及腫瘤發生中具有重要作用[12,13]。在NO誘導的DNA損傷中,雙鏈斷裂是一種嚴重的DNA損傷,可導致染色體斷裂、重排、突變及丟失重要遺傳信息。雙鏈斷裂損傷的有效修復主要包括2種途徑:發生在S/G2后期的同源重組 (homologous recombination,HR)[14,15]和發生在整個細胞周期的非同源末端連接 (nonhomologous end-joining, NHEJ)[16,17]。P53可分別通過激活錯配修復(mismatch repair,MMR) 基因及切除3′-DNA末端非配對堿基增加同源重組和非同源重組修復過程的忠實性。P53可通過參與核苷酸切除修復(nucleotide excision repair, NER)和堿基切除修復 (base excision repair, BER),降低8-硝基鳥嘌呤引起的DNA變異。美國國立衛生研究院(National Institutes of Health, NIH)腫瘤研究中心Wink在過去近20年里,對各種濃度NO引起的體內、外生理與病理作用進行了細致研究,表明在細胞培養系統中>400 nmol/L的NO可引起明顯DNA 損傷,同時誘導P53聚集及其活性增加(p-ser-15 P53增加),導致p21waf1增加及與p21waf1相關的細胞周期停滯,DNA修復增加[18]。他們還發現,在癌前病變潰瘍性結腸炎組織中,iNOS表達與p-ser-15 P53 水平呈正相關。免疫組化表明P53活性增加與p21waf1增高具有明顯一致性[19]。因此,在含有野生型p53的細胞中,高濃度NO有效激活P53,導致DNA修復活躍,使保護性細胞凋亡增加,從而大大降低NO造成的DNA損傷和變異,維持細胞的穩定性。
但在P53發生功能性變異和P53活性缺乏的細胞中,高濃度NO暴露既沒有增加DNA損傷后的修復,也沒有增加細胞保護性凋亡[20]。因此,NO暴露后的DNA損傷和變異修復不成功,但依然存活的細胞明顯增多,不可避免地導致腫瘤發生增加。
宮頸組織中含有3種NOS,宮頸癌的發生可能與宮頸局部微環境中NO濃度密切相關。研究發現,宮頸細胞病變患者的宮頸局部NO濃度增高[21]。最近有研究表明,NO與HPV之間具有一定的關系。
3 NO與HPV
NO對各種病毒復制的作用各不相同。對某些病毒可無任何影響,如RNA的正黏病毒、副黏病毒、冠狀病毒和DNA的小鼠痘病毒[22,23];對某些病毒可表現為抑制,如RNA的柯薩奇病毒、漢坦病毒及DNA的皰疹病毒、乙型肝炎病毒[22-24];而對于某些RNA 病毒則具有變異原的作用,如仙臺病毒。研究表明,在細胞培養基中加入0.25~0.5 mmol/L DETA-NO后,產生的NO 濃度與人體內炎性條件下產生的NO 濃度相當。在該濃度下,NO不影響HPV復制,但顯著增加HPVE6、E7轉錄。NO誘導增加的E6會進一步降解P53和PRb,降低P53的活性和功能,而 P53功能的降低又進一步減弱HPV感染細胞在高濃度NO暴露中P53維持細胞遺傳穩定性的能力,DNA雙鏈斷裂增加,有利于腫瘤發生[25]。
反之,HPV感染又可通過誘導宮頸局部NOS增加[21],改變宮頸局部NO濃度。臨床流行病學調查表明,在宮頸上皮內瘤變(cervical intraepithelial neoplasia,CIN)的上皮細胞和炎性細胞中,均可檢測到iNOS表達增加[26];高危型HPV感染婦女宮頸局部NO濃度(35.2~53.1 μmol/L)約是未感染婦女 (21.0~26.1 μmol/L)的2倍;而且在高危型HPV感染婦女中,宮頸上皮細胞形態正常或輕度改變者局部NO釋放明顯增加[21,27]。NO本身可導致氧化性DNA損傷,生成8-硝基鳥嘌呤和8 -氧代- 7,8 -二氫-2′-脫氧鳥苷。尖銳濕疣和CIN 2~3患者活檢組織均可檢測到這兩種損傷性標志物,且CIN 2~3患者活檢組織中8-硝基鳥嘌呤水平明顯高于尖銳濕疣。隨著CIN嚴重程度的增加,此類DNA損傷的發生明顯增加[26],表明高危型HPV感染細胞中NO濃度的增加相對較高。
4 結語
盡管目前研究表明,高濃度NO在HPV感染細胞中具有促進腫瘤發生的作用,但僅局限于細胞學水平。深入研究該機制可為宮頸癌的防治提供新的重要理論基礎和藥物實驗平臺,使用NOS抑制劑降低宮頸局部NO濃度,將為全面、有效防治宮頸癌帶來新的希望。
[1] Parkin DM, Bray F, Ferlay J, Pisani P. Global cancer statistics, 2002 [J]. CA Cancer J Clin, 2005, 55(2): 74-108.
[2] Zelkowitz R. Cancer. HPV casts a wider shadow [J]. Science, 2009, 323(5914): 580-581.
[3] de Gruijl TD, Bontkes HJ, Walboomers JM, Coursaget P, Stukart MJ, Dupuy C, Kueter E, Verheijen RH, Helmerhorst TJ, Duggan-Keen MF, Stern PL, Meijer CJ, Scheper RJ. Immune responses against human papillomavirus (HPV) type 16 virus-like particles in a cohort study of women with cervical intraepithelial neoplasia I. Differential T-helper and IgG responses in relation to HPV infection and disease outcome [J]. J Gen Virol, 1999, 80(2): 399-408.
[4] zur Hausen H. Papillomaviruses and cancer: from basic studies to clinical application [J]. Nat Rev Cancer, 2002, 2(5): 342-350.
[5] Ohshima H. Genetic and epigenetic damage induced by reactive nitrogen species: implications in carcinogenesis [J]. Toxicol Lett, 2003, 140-141: 99-104.
[6] Kawanishi S, Hiraku Y. Oxidative and nitrative DNA damage as biomarker for carcinogenesis with special reference to inflammation [J]. Antioxid Redox Signal, 2006, 8(5-6): 1047-1058.
[7] Martinez I, Gardiner AS, Board KF, Monzon FA, Edwards RP, Khan SA. Human papillomavirus type 16 reduces the expression of microRNA-218 in cervical carcinoma cells [J]. Oncogene, 2008, 27(18): 2575-2582.
[8] Hussain SP, He P, Subleski J, Hofseth LJ, Trivers GE, Mechanic L, Hofseth AB, Bernard M, Schwank J, Nguyen G, Mathe E, Djurickovic D, Haines D, Weiss J, Back T, Gruys E, Laubach VE, Wiltrout RH, Harris CC. Nitric oxide is a key component in inflammation-accelerated tumorigenesis [J]. Cancer Res, 2008, 68(17): 7130-7136.
[9] Alivisatos AP, Gu W, Larabell C. Quantum dots as cellular probes [J]. Annu Rev Biomed Eng, 2005, 7: 55-76.
[10] Hoki Y, Hiraku Y, Ma N, Murata M, Matsumine A, Nagahama M, Shintani K, Uchida A, Kawanishi S. iNOS-dependent DNA damage in patients with malignant fibrous histiocytoma in relation to prognosis [J]. Cancer Sci, 2007, 98(2): 163-168.
[11] Schneiderhan N, Budde A, Zhang Y, Brüne B. Nitric oxide induces phosphorylation of p53 and impairs nuclear export [J]. Oncogene, 2003, 22(19): 2857-2868.
[12] Marnett LJ, Riggins JN, West JD. Endogenous generation of reactive oxidants and electrophiles and their reactions with DNA and protein [J]. J Clin Invest, 2003, 111(5): 583-593.
[13] Tommasino M, Accardi R, Caldeira S, Dong W, Malanchi I, Smet A, Zehbe I. The role of TP53 in cervical carcinogenesis [J]. Hum Mutat, 2003, 21(3): 307-312.
[14] Kato TA, Okayasu R, Bedford JS. Signatures of DNA double strand breaks produced in irradiated G1 and G2 cells persist into mitosis [J]. J Cell Physiol, 2009, 219(3): 760-765,
[15] Jain S, Sugawara N, Lydeard J, Vaze M, Tanguy Le Gac N, Haber JE. A recombination execution checkpoint regulates the choice of homologous recombination pathway during DNA double-strand break repair [J]. Genes Dev, 2009, 23(3): 291-303.
[16] Rothkamm K, Krüger I, Thompson LH, L?brich M. Pathways of DNA double-strand break repair during the mammalian cell cycle [J]. Mol Cell Biol, 2003, 23(16): 5706-5715.
[17] Thacker J, Zdzienicka MZ. The XRCC genes: expanding roles in DNA double-strand break repair [J]. DNA Repair (Amst), 2004, 3(8-9): 1081-1090.
[18] Garner-Hamrick PA, Fostel JM, Chien WM, Banerjee NS, Chow LT, Broker TR, Fisher C. Global effects of human papillomavirus type 18 E6/E7 in an organotypic keratinocyte culture system [J]. J Virol, 2004, 78(17): 9041-9050.
[19] Hofseth LJ, Saito S, Hussain SP, Espey MG, Miranda KM, Araki Y, Jhappan C, Higashimoto Y, He P, Linke SP, Quezado MM, Zurer I, Rotter V, Wink DA, Appella E, Harris CC. Nitric oxide-induced cellular stress and p53 activation in chronic inflammation [J]. Proc Natl Acad Sci USA, 2003, 100(1): 143-148.
[20] Ho YS, Wang YJ, Lin JK. Induction of p53 and p21/WAF1/CIP1 expression by nitric oxide and their association with apoptosis in human cancer cells [J]. Mol Carcinog, 1996, 16(1): 20-31.
[21] Rahkola P, Mikkola TS, Ylikorkala O, Vaisanen-Tommiska M. Association between high risk papillomavirus DNA and nitric oxide release in the human uterine cervix [J]. Gynecol Oncol, 2009, 114(2): 323-336.
[22] Reiss CS, Komatsu T. Does nitric oxide play a critical role in viral infections [J]? J Virol, 1998, 72(6): 4547-4551.
[23] Akaike T, Fujii S, Kato A, Yoshitake J, Miyamoto Y, Sawa T, Okamoto S, Suga M, Asakawa M, Nagai Y, Maeda H. Viral mutation accelerated by nitric oxide production during infection in vivo [J]. FASEB J, 2000, 14(10): 1447-1454.
[24] Bhella D, Gatherer D, Chaudhry Y, Pink R, Goodfellow IG. Structural insights into calicivirus attachment and uncoating [J]. J Virol, 2008, 82(16): 8051-8058.
[25] Wei L, Gravitt PE, Song H, Maldonado AM, Ozbun MA. Nitric oxide induces early viral transcription coincident with increased DNA damage and mutation rates in human papillomavirus-infected cells [J]. Cancer Res, 2009, 69(11): 4878-4884.
[26] Hiraku Y, Tabata T, Ma N, Murata M, Ding X, Kawanishi S. Nitrative and oxidative DNA damage in cervical intraepithelial neoplasia associated with human papilloma virus infection [J]. Cancer Sci, 2007, 98(7): 964-972.
[27] Rahkola P, V?is?nen-Tommiska M, Tuomikoski P, Ylikorkala O, Mikkola TS. Cervical nitric oxide release and persistence of high-risk human papillomavirus in women [J]. Int J Cancer, 2010 [Epub ahead of print].

